作者简介: 黄玉萍, 女, 1988年生, 南京林业大学机械电子工程学院讲师 e-mail: h.y.p_2010@163.com
成熟度是确定番茄采摘时间和评估收获后果实品质的重要参数之一, 随着番茄成熟阶段的递进, 叶绿素含量逐渐下降, 而番茄红素含量逐步增加, 使得果实颜色由绿色转变为红色。 以六个成熟阶段的600个番茄为研究对象, 采用空间分辨光谱技术提取番茄的吸收( μa)和约化散射( μ's)系数光谱, 结合偏最小二乘判别分析(PLSDA)算法对番茄的不同成熟度进行判别。 由新型空间分辨光谱系统采集每个番茄样品的30个空间分辨光谱, 光谱区间为550~1 650 nm, 覆盖光源-检测器距离1.5~36 mm。 由于30根光纤对称布置, 平均具有相同光源-检测器距离的光纤数据, 获得15个新空间分辨光谱。 受水分强吸收影响, 1 300 nm之后的光谱区域信噪比较小, 仅550~1 300 nm的光谱区域被用来分析和计算番茄的 μa和 μ's。 另外, 由于光在组织中传输衰减, 光源-检测器距离超过12.5 mm的信号较弱, 仅靠近光源的9个空间分辨光谱(光源-检测器距离1.5~12.5 mm)被用来提取番茄的 μa和 μ's, 根据漫射近似方程逆算法获得 μa和 μ's在550~1 300 nm的光谱区间的光谱值。 随着番茄的成熟, μa光谱在675 nm处叶绿素吸收峰逐渐衰减伴随着560 nm处花青素和姜黄素吸收峰的增加, μ's光谱随着波长的增加单调递减。 比较分析 μa和 μ's评估番茄六成熟度与三成熟度分类效果, 同时, 针对表面颜色和内部颜色两方面对番茄成熟度进行分类。 数学模型结果表明, μa和 μ's光谱组合能够进一步提高单独 μa和 μ's光谱建立的番茄六成熟度分类模型性能, 尤其是 μa× μ's参数, 对基于内、 外颜色特征的番茄成熟度识别率分别为78.5%与85.5%。 μa和 μ's以及它们的组合对番茄三成熟度分类结果更优, 且基于内、 外颜色特征的成熟度分类准确率相近, 均可达到94%。 本研究证明光学吸收与约化散射系数光谱能够有效识别番茄成熟度, 为农产品品质无损检测提供了新的技术手段。
Maturity is one of the most important parameters in determining the picking time and assessing the postharvest quality. As the maturity of tomato fruit advanced, the chlorophyll content decreases, while anthocyanin starts to increase, resulting in color changes for tomato fruit, which suggests color characteristics is closely related to the maturity for tomatoes. The total 600 tomatoes at six maturity stages were used for the test, absorption and reduced scattering coefficients for tomato fruit were extracted by spatially resolved spectroscopy, partial least squares models discriminant analysis (PLSDA) models were built for evaluating tomato maturity. Spatially resolved (SR) spectra for each tomato sample were acquired using a novel spatially resolved spectroscopic system over the spectral region of 550~1 650 nm. Since the 30 fibers in SR probe were arranged in symmetry, each pair of symmetric spectra were averaged, which resulted in 15 relative reflectance spectra covering the light source-detector distances of 1.5~36 mm. Due to strong water absorption beyond 1 300 nm, only 550~1 300 nm was selected for extracting the absorption and reduced scattering coefficients of tomato fruit. Besides, nine SR spectra over the spatial distances from 1.5 to 12.5 mm were actually used to analyze the absorption and reduced scattering properties of tomato fruit in this study, because the signal beyond 12.5 mm was too weak to be useful. And then the values for the absorption and reduced scattering coefficient were obtained by the diffusion approximation equation coupled with a nonlinear inverse algorithm. Chlorophylls content decreases at 675 nm along with the increases of anthocyanin at 560 nm as tomato turns from green to red. The values of the reduced scattering coefficient decreased steadily with the increasing wavelength for all tested tomato samples over the spectral region of 550~1 300 nm. The classification results were compared using μa and μ's. Besides, tomato maturity stages were evaluated based on surface color and internal color. The results showed the combinations of μa and μ's could further improve classification results compared with single μa and μ's spectra, especially μa× μ's (multiplication of the two parameters wavelength by wavelength), which presented recognition rate of 78.5% and 85.5% for internal color and surface color, respectively. Better classification results were obtained for three ripeness stages using μa and μ's and their combinations, and the recognition rates were similar, around 94% for internal and surface color. The research demonstrated the optical absorption and scattering spectra could classify tomato ripeness stages effectively. The research provided a new means for nondestructive detection in agricultural products.
成熟度是评估番茄品质最重要因素之一, 随着番茄成熟阶段的递进, 叶绿素含量的下降和番茄红素含量的增加, 使得果实颜色由绿色转变为红色。 因此, 在判定番茄成熟方面, 颜色是一个重要参数[1]。
目前, 用于评估番茄成熟度的无损检测技术包括机器视觉、 光谱分析技术、 X射线技术、 核磁共振技术等。 机器视觉技术仅适用于检测样品的外部品质; 而X射线和核磁共振技术由于仪器价格较高, 检测速度较慢等因素限制了其广泛应用。 可见-近红外光谱检测技术以其快速、 无损和无需样品制备等优点被广泛用于番茄品质评估[2, 3]。 其主要根据比尔-朗伯定律(Beer-Lambertian Law), 通过样品组分或物理特性的变化引起相应光学特性的变化, 进而使得光谱特征也发生变化实现检测。 然而, 可见-近红外光谱只表征光在样品组织内部被吸收和散射的总体结果, 忽略了光子在样品组织中的传播信息, 且由于番茄组织的混浊性与异质性, 光在番茄组织内部的传播不完全遵守比尔-朗伯定律, 这将带来较大的检测误差。 另外, 可见-近红外光谱属于特定区域测量, 只能获得番茄很小部分的组织信息, 而番茄在成熟过程中, 组织变化的不均匀性也将导致检测误差的增大。
光与生物组织间的相互作用主要取决于吸收和散射特性, 它们分别与生物组织的化学成分和物理特性相关[4]。 基于辐射传输理论, 测量生物组织吸收和散射特性的方法包括时间分辨技术[5], 频域技术[6], 空间频域成像技术[7]和空间分辨技术[8]等。 时间分辨技术和频域技术仪器较贵, 且覆盖光谱区域较窄, 而空间频域成像技术检测时间较长等原因, 限制了它们在食品和果蔬检测中的应用。 空间分辨光谱技术测量距离恒定强度点光源不同距离处的反射率, 根据漫射近似方程反演算法估算出吸收和散射特性[9]。 相比较于时间分辨和频域技术, 空间分辨光谱技术所用仪器简单、 操作简便、 波长覆盖范围相对较宽。 因此, 该技术在食品和果蔬检测领域受到广泛关注[10]。 Xia[11]等采用单一光纤的移动实现牛肉的空间分辨光谱, 通过计算吸收和散射系数预测牛肉的嫩度。 该方法不但耗时, 还会引入较大的测量误差, 另外, 在测量过程中, 样品组织的特性有可能随着时间而改变, 长时间的测量也会引起光源输出的波动, 从而引入光学特性测量误差。 Herremans[12]和Do Trong[13]设计了光纤阵列探头, 探头上布置5根光纤可同时采集空间分辨光谱, 实现对食品和果蔬品质的评估。 但是, 由于所有检测光纤都固定在刚性探头, 不适用于检测曲面或不规则表面的样品, 而且, 探头布置的光纤较少, 光源-检测器距离也相对较小, 因此, 在检测食品的光学特性和解析样品品质与空间分辨光谱相关关系上很难取得令人满意的结果。 基于高光谱成像式空间分辨光谱技术以检测速度快、 非接触式和空间分辨率高等优点常被用于检测果蔬的品质[4]和成熟度[14, 15]。 高光谱成像式空间分辨光谱技术适用于检测表面平坦的样品, 对于曲面样品的测定, 会因为表面曲率而引起信号误差, 需要对所测的空间分辨反射光谱进行校正, 以确保准确估算光学特性[16]。 但校正方法往往比较复杂, 可能无法达到预期效果。 而且, 基于高光谱成像式空间分辨光谱系统的波长范围限制在400~1 000 nm。 在生物医学研究中, 光谱区域在600~1 300 nm被称之为“ 诊断窗口” , 因为该光谱区域的光在生物组织中具有良好的穿透性, 能够检测组织更深层的信息。 另外, 一些研究显示偏最小二乘判别分析(PLSDA)结合多元线性回归和主成分分析的优点, 常被用来建立农产品品质等方面的分类模型[17]。
本课题组开发的新型空间分辨光谱系统能够在550~1 650 nm光谱区域同时获得15个不同光源-检测器距离的空间分辨光谱, 光源-检测器距离达到1.5~36 mm。 本文采用该系统测量番茄在550~1 300 nm的吸收和散射特性, 并根据吸收和约化散射系数, 以及它们的组合建立番茄成熟度的PLSDA模型, 分析比较番茄各成熟阶段的识别率。
依据美国农业部给出的番茄不同成熟度颜色标准, 在美国密歇根州立大学的园艺研究与教学中心(Holt, Michigan, USA)采摘的600个“ Sun Bright” 番茄样品通过视觉评估被分为六个成熟度等级, 见图1。 按照表面颜色标准, 每个成熟度等级分别有100个样品, 若按内部颜色标准, Green, Breaker, Turning, Pink, Light red and Red六个成熟阶段分别有88, 84, 123, 102, 94和109个样品。
新型空间分辨光谱系统如图2所示, 具体描述详见文献[16]。 光谱采集与光源设置与文献[1]一致。 由于光在组织中传输衰减, 光源-检测器距离超过12.5 mm的信号太弱, 因此, 靠近光源的9个空间分辨光谱(光源-检测器距离1.5~12.5 mm)被用来分析和评估番茄的吸收和散射特性。 受水分强吸收影响, 1 300 nm之后的光谱区域信噪比较小, 仅550~1 300 nm的光谱区域被用来分析和计算番茄的吸收和约化散射系数。 光谱归一化后, 采用样本校正曲线(详见文献[16])在波长区间550~1 300 nm对空间分辨光谱进行校正, 得到600个番茄样品校正后空间分辨反射率。
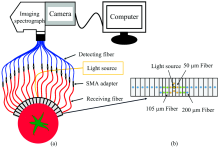 | 图2 空间分辨光谱系统(a)及其探头(b)Fig.2 Schematic of the spatially-resolved spectroscopy system (a), and the flexible probe (b) |
最后, 根据漫射近似方程逆算法计算出吸收和约化散射系数, 如图3所示。 空间分辨漫反射解析方程如下所示
其中r是光源-检测器距离; D=[3(μ a+μ s)-1]为扩散系数; μ eff=[3μ a(μ a+μ 's)1/2]为有效衰减系数; μ 't=μ a+μ 'a为总衰减系数; r1=(
s'> | 图3 吸收和约化散射系数的计算流程Fig.3 Procedure of calculating μ a and μ 's |
吸收和约化散射系数与组织成分和物理特性相关, 番茄的成熟过程伴随着组织成分与物理特性的变化, 因此, 吸收和约化散射系数理论上能够判别番茄的成熟度。 另外, 番茄组织内光的吸收和散射存在相互关系, 吸收系数(μ a)与约化散射系数(μ 's)组合对番茄成熟度的判别具有一定实际意义, 如有效衰减系数(μ eff=[3μ a(μ a +μ 's)1/2])可比较不同组织的透光特性及其波长依赖性[18]; Cen[4]等研究发现μ a× μ 's组合是预测桃子品质参数的有效组合。 MATLAB R2017a (The MathWorks, Inc., Natick, MA, USA) 和PLS Toolbox 8.2 (Eigenvector Research, Inc., Wenatchee, WA, USA)软件被用于建立吸收(μ a)和约化散射(μ 's)系数以及它们光谱点乘组合(μ eff和μ a× μ 's)的番茄成熟度偏最小二乘判别分析(PLSDA)模型。 600个番茄样品随机分成训练集和测试集, 其中训练集有400个样品, 测试集有200 个样品。 威尼斯百叶窗交叉验证法简单易行, 适用于较多样本的随机分类数据, 该方法被用于确定最小交叉验证分类误差平均值, 从而确定模型的最佳潜在变量数量。
图4显示番茄六个成熟度的吸收和约化散射系数在550~1 300 nm光谱区间的平均光谱。 由图4(a)观察到吸收系数光谱在番茄不同成熟度有着明显的变化。 随着番茄成熟阶段的递进, 叶绿素吸收峰(675 nm)逐渐衰减, 而花青素和姜黄素吸收峰(560 nm)逐渐增加, 这是由于随着番茄由Green转变成Red, 叶绿素含量减少, 而花青素开始增加[15], 从而出现了560和675 nm的吸收峰具有相反的趋势。 从吸收系数光谱图还可以发现, 在750 nm处有个微小的吸收峰, 这是由于水分吸收引起的。 在970和1 180 nm处有显著的吸收峰, 这是由水分和番茄组织中C— H, N— H和O— H吸收带的组合产生的。
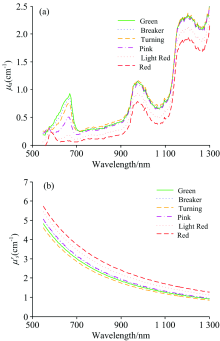 | 图4 番茄不同成熟度的平均吸收(a)和约化散射(b)系数光谱Fig.4 Mean spectra of (a) absorption (μ a) and (b) reduced scattering (μ 's) coefficients for tomato fruit at the six maturity stages |
图4(b)发现所有测试番茄的约化散射系数在550~1 300 nm光谱区域都随着波长增加单调递减。 约化散射系数与样品物理特性相关, 如细胞结构, 颗粒尺寸和密度等。 在番茄早期成熟阶段(Green到Breaker再到Turning), 细胞壁解聚和纤维素降解会导致约化散射系数的降低。 随着番茄从Turning到Pink, 再转变到Light Red, 最终到Red阶段, 可溶性果胶和纤维素会产生小分子, 而使得番茄组织的小颗粒密度增加, 从而扭转了约化散射系数的变化趋势, 使得约化散射系数大幅增加[14]。
由表1可知, 基于表面颜色特征的番茄六成熟度PLSDA模型结果, μ a和μ 's以及它们组合的识别率均高于内部颜色特征的识别率, 文献[1]表明, 番茄内部颜色的识别与光源-检测器距离相关, 且较大的光源-检测器距离光谱可更准确的判别番茄内部颜色, 本研究中考虑信噪比影响, 所获得光谱的光源-检测器距离仅限于12.5 mm, 无法全面准确地判别番茄内部颜色特征。 此外, 从表1中还可观察到μ 's无法准确识别番茄的成熟度, 这可能由于番茄的μ 's与番茄的物理特性相关, 番茄在成熟过程会经历细胞壁解聚和纤维素降解等复杂过程, 这些物理特性的变化与μ 's之间可能是非线性关系, 导致μ 's无法准确判别番茄成熟度。 但μ a和μ 's组合能有效提高单一μ a或μ 's对番茄成熟度的识别率, 说明番茄组织的吸收和散射特性存在一定的相关性, 能促进番茄成熟度分类。
| 表1 番茄成熟度测试集结果分析 Table 1 The overall classification accuracies for tomato maturity in test set |
若按三成熟度分类(Green/Breaker, Turning/Pink, Light red/Red), μ a和μ 's以及它们组合的识别率相较于六成熟分类结果均有很大幅度的提高, 基于表面颜色的识别率提高10%以上, 而基于内部颜色的识别率可提高20%以上, 且基于内外两种颜色特征的三成熟度识别率非常相近, 除了μ 's, 识别率均可达到94%左右。 基于表面颜色特征的三成熟度分类, μ a× μ 's能够提高单一μ a识别效果, 而对于内部颜色特征识别, μ a和μ 's组合与单一μ a识别率一致, 均为94%, 且μ a与μ eff在三个成熟度的判错样本也一致, 分别为3, 5, 4个, 而μ a× μ 's在三个成熟度的判错样本分别为3, 4, 5个, 说明μ a在基于内部颜色特征的三成熟度评估中起决定性作用。 总体而言, 不管是番茄六成熟度还是三成熟度的判别, μ a× μ 's均比其他参数获得更优的识别率。
表2给出了μ a× μ 's番茄六成熟度测试集分类结果, 通过对比各成熟阶段的分类结果, 在Green和Red阶段, 基于内外颜色特征的分类准确率相对较高, 只有个别样本被错分在相邻成熟阶段, 这可能由于番茄在Green和Red阶段, 内外颜色较为均一, 可见-近红外光谱区域对单一颜色的判别更为敏感, 识别率较高。 番茄由Green转变到Red的中间阶段, 颜色特征呈空间分布, 且由于光穿透深度影响, 对番茄中间四个成熟度阶段识别率相对较低, 表面颜色特征识别率在80%左右, 其中Pink阶段识别率最低; 内部颜色特征识别率在70%左右, 其中Breaker阶段识别率最低, 大部分样本被错分在Green与Turning阶段, 但Pink阶段识别率相对较好, 达到了90%。 相较于表面颜色特征识别较为稳定统一, 各成熟阶段识别率在80%以上, 内部颜色识别率差异性较大, 其中Green, Pink和Red阶段识别率均可达到90%以上, 而Breaker阶段几乎无法正确识别, 这可能由于Breaker阶段番茄红素开始逐渐由内而外扩散, 且红色和绿色空间分布变化较大, 这意味着微观结构和组织成分的变异性可能较大, 又受光穿透深度的影响, 导致对Breaker阶段内部颜色特征识别的不准确。
| 表2 μ a× μ 's番茄六成熟度测试集分类结果 Table 2 Classification accuracies for tomato of six maturity stages using μ a× μ 's in test set |
表3展示了μ a× μ 's在番茄三成熟度判别过程中, 预测集详细分类结果。 由表3可知, 不管是基于表面颜色还是内部颜色进行评估, 各成熟度的分类准确率均超过93%, 远远好于六成熟度分类结果, 这可能由于番茄相邻两成熟度阶段的微观结构和组分较为相似, 将其合并为一类进行模型训练, 可有效提高模型的分类能力。 基于表面颜色特征评估番茄Light Red/Red阶段可获得最优识别率95.8%, 而基于内部颜色特征在该阶段识别率相对较低, 为93.1%, 有5个样本被判错在Turning/Pink阶段。 在Green/Breaker和Turning/Pink阶段, 基于表面颜色特征所建模型有4个样本判错在相邻成熟度阶段, 识别率为93.8%; 而采用内部颜色特征建立的PLSDA模型分类效果稍好, 仅有3个样本判错, 识别率超过94%。
| 表3 μ a× μ 's番茄三成熟度测试集分类结果 Table 3 Classification accuracies for tomato of three maturity stages using μ a× μ 's in test set |
本文采用的μ a和μ 's以及它们组合对番茄六成熟度分类结果跟以往研究具有可比性, 三成熟分类效果甚至高于以往研究[14]。 Zhu等在500~950 nm光谱区间获得番茄的吸收和散射光谱, 并根据番茄表面颜色特征建立了PLSDA模型, 判别番茄六成熟度和三成熟度的分类效果, 总体分类准确率分别为86%和92%。 此外, 本研究基于内部颜色特征的番茄成熟度分类结果与不同光源-检测器距离的空间分辨光谱也具有可比性[1], 说明μ a和μ 's以及它们组合在评估番茄内部颜色特征仍具有一定潜力。
在番茄六成熟度分类结果, μ a和μ 's组合能够进一步提高单独μ a和μ 's光谱所建立模型的分类性能, 这可能由于随着番茄的成熟软化, 番茄组成成分(与μ a相关)与物理特性(与μ 's相关)也随着改变。 但在番茄三成熟度分类结果中, μ a和μ 's组合与单独μ a光谱所建模型分类结果一致, 这可能由于三种成熟度的番茄差异较大, μ a和μ 's组合获得的额外信息不足以改善分类模型的性能[14]。 此外, μ 's光谱评估番茄成熟度能力均低于μ a光谱, 这一发现也与前人采用光学特性对其他水果品质评估的结论相一致[4, 13]。 番茄在成熟过程经历细胞壁和果胶溶解变化, 可能导致番茄内壁和中隔及果胶不稳定, 影响番茄的散射特性(与物理结构和特性相关)。 另外, μ a光谱出现了更多特征峰, 其中可能包含更多样品的物理和化学信息, 而μ 's光谱单调递减, 特征较少, 这也可能是μ 's光谱与番茄成熟度相关性低的原因。
采用光学吸收和散射特性在550~1 300 nm光谱区间评估番茄的成熟度。 μ a和μ 's及它们组合分别建立基于表面和内部颜色特征的番茄成熟度PLSDA模型, 用于判别番茄的六成熟度和三成熟度等级。 μ a和μ 's及它们组合对基于表面颜色特征的番茄六成熟度识别优于内部颜色特征的识别率, μ a和μ 's组合能够进一步改善单独μ a和μ 's光谱建立的番茄六成熟度判别模型, 识别率达到85.5%。 当番茄被分为三成熟度等级, μ a和μ 's及它们组合建立的判别模型总体识别率有了显著提升, 且基于表面和内部颜色特征的番茄成熟度识别率相近, 均在94%左右。 结果表明, 光学吸收和约化散射系数在评估番茄成熟度方面具有很大潜力。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|



