作者简介: 叶嘉文, 1994年生, 长春理工大学化学与环境工程学院硕士研究生 e-mail: 1725619435@qq.com
在人体内部环境中, 碘是合成甲状腺激素的关键原料之一, 而甲状腺激素主要功能是促进人体生长发育以及调节新陈代谢, 因此碘对人体内部环境正常运转起到至关重要的作用。 碘在人体内主要以碘化氨基酸的形式存在于甲状腺中, 对其常用的检测手段有很多种。 而这些方法虽然具有较高精度以及灵敏度高, 但检测过程较为复杂且检测周期较长。 因此, 发展一种成本较低、 操作简单、 快速准确的I-检测方法具有应用意义。 研究设计一种简便且快速精准的I-检测方法, 利用荧光“Off-On”传感体系对溶液中I-进行定量检测。 以柠檬酸为碳源、 乙二胺为氮源, 通过水热法一步合成水溶性较好且具有良好荧光性质的碳点(CDs)。 利用荧光光谱仪以及紫外-可见光光谱仪对该CDs的光学性能进行表征。 通过分析CDs的光谱可知该CDs的激发波长为345 nm, 发射波长为470 nm。 另外, 通过傅里叶-红外光谱仪以及高分辨紫外光电子能谱对该CDs表面的官能团以及元素进行分析检测。 通过荧光光谱进行检测, 可以发现当CDs溶液中存在Hg2+时, CDs的荧光发生猝灭现象。 其原因是CDs与Hg2+的d轨道间非辐射电子转移或Hg2+与CDs表面的氨结合形成非荧光复合物, 导致CDs的荧光强度下降。 通过将最佳浓度的Hg2+与CDs溶液进行混合, 来制备Hg2+@CDs的荧光传感体系溶液。 分析Hg2+@CDs的荧光传感体系溶液的荧光光谱图可以发现, 当Hg2+@CDs的荧光传感体系溶液中存在I-时, 体系荧光强度随着I-浓度的上升而逐渐增强。 该原因可以归根于I-与Hg2+之间存在较强的相互作用可将Hg2+从CDs表面脱附, 使CDs的荧光重新恢复, 从而实现I-的荧光“Off-On”检测。 利用该方法来检测溶液中的I-, 其检测范围在5.0~75 μmol·L-1, 而检测限为0.25 μmol·L-1。 实验最后还利用荧光光谱仪对Hg2+@CDs的荧光传感体系的选择性以及抗干扰能力进行分析, 结果显示该荧光传感体系对I-具有较好的选择性以及良好的离子抗干扰性能。
In the human body, iodine is the key raw material for thyroid hormone. Moreover, thyroid hormone had a critical role in human growth and development and regulated metabolism, so iodine was played a vital role in the normal operation of the human body. The iodine was mainly in the form of iodinated amino acids presented in the thyroid gland. Furthermore, many methods were used to detect I- with high precision and accuracy. However, most of the approaches lie in complicated operations and high detection cost. Therefore, it is of great significance to develop a method for detecting I- with low cost, fast, accuracy and simple operation. In this study, a simple and convenient fluorescence “Off-On” detection method was used for I- testing in solution. The carbon nanodots (CDs) were synthesized by a simple hydrothermal method, which citric acid and ethane diamine were used as the carbon source and the nitrogen source. The optical properties of the CDs were characterized by a fluorescence spectrometer and an ultraviolet-visible spectrometer, which emitted bright blue light at an excitation wavelength of 350 nm. Additionally, the groups on the surface of the CDs were characterized by the Fourier-infrared spectroscopy and high resolution ultraviolet photoelectron spectroscopy. The fluorescence of the prepared CDs can be pre-quenched by Hg2+. And the fluorescence quenching may be due to the non-radiative electron-transfer from the excited states to the d orbital of Hg2+. Another possible explanation is attributed to the Hg2+ ions combine with a large amount of nitrogen on the surface of the CDs to form a non-fluorescent complex, which leads to fluorescence quenching of CDs. The optimal concentration condition of Hg2+ was selected by analyzing the fluorescence spectrum of CDs solution with different concentration Hg2+. Once they meet I- in the solution, Hg2+ on the surface of the CDs will be released due to the strong interaction between Hg2+ and I-, and the fluorescence of CDs can be restored. Thus, I- in the solution can be detectable by this fluorescent “Off-On” method, and the detection range is 5.0~75 μmol·L-1 with the detection limit of 0.25 μmol·L-1. Finally, the selectivity and anti-interference ability of Hg2+@CDs fluorescence sensing system were analyzed by fluorescence spectrum. And the results showed that the fluorescence sensing system had high selectivity to I- and good ion anti-interference performance.
在人体内, 碘是合成甲状腺激素的关键元素之一, 而甲状腺激素对人体的新陈代谢、 生长和发育十分重要。 因此碘对人体内部环境以及器官的正常生长发育起到至关重要的作用。 碘缺少或过量摄入同样会对人体带来一系列不良影响。
碳点(carbon nanodots, CDs)是一种三维尺寸都是纳米级别且能发明亮荧光的球形碳颗粒, 其化学结构由sp2和sp3的杂化碳构建形成。 2004年Xu课题组在电泳法纯化电弧放电产物的过程中发现了可以放出明亮荧光的CDs[1]。 由于CDs具有出众的发光特性, 易于功能化、 无毒以及良好的生物相容性等优势[2], 被广泛应用于众多的研究领域, 如生物成像[3], 药物诊断[4], 传感器[5]等。 CDs的合成方法较为简便且合成所需原料来源广泛。 目前, 合成CDs的方法有很多种, 如水热法[6], 微波合成法[7], 超声合成法[8]。 其中水热法合成CDs, 具有操作简便、 原料丰富的优势, 且所合成出来CDs点量子产率高。
本研究以柠檬酸和乙二胺为原料通过水热法一步合成具有良好荧光性质的CDs。 利用荧光光谱仪和紫外光谱仪对该CDs进行光学性能表征。 另外, 通过红外光谱仪以及用高分辨紫外光电子能谱对CDs的表面官能团以及相关元素进行分析。 实验中, 是将CDs溶液与已知浓度的Hg2+溶液混合制备Hg2+@CDs荧光传感体系(已荧光猝灭的混合体系)。 当体系中存在I-时, 由于I-与Hg2+之间存在较强的相互作用, 能使Hg2+从CDs表脱离, 最终导致CDs荧光恢复。 通过该方法来检测溶液中I-的含量, 实现了I-的荧光“ Off-On” 检测。 利用荧光光谱对该体系与不同浓度的I-溶液进行混合后的荧光强度进行检测。
LS-55荧光分光光度计(PerkinElmer, USA)。 UV-2550分光光度计(Shimadzu, Japan)。 Magna-IR560(Nicolet Co., USA) 傅里叶-变换红外光谱仪(FT-IR) 。 X射线(XPS)高分辨紫外光电子能谱(R3000/VUV5K/MX-650)。
柠檬酸, 乙二胺, 硝酸汞, 氯化钠, 碘化钾, 磷酸二氢钠, 磷酸钠, 硫酸钠, 碳酸钠, 碳酸氢钠, 柠檬酸钠, 氟化铵, 亚硫酸钠等。 上述所有化学品均购自北京化学试剂厂 (北京, 中国), 分析纯, 直接使用。
通过水热合成方法制备具有良好荧光性质的CDs, 合成的详细步骤: 常温下, 称取3.0 g柠檬酸溶解于10.0 mL去离子水中。 取2.0 mL乙二胺滴加到柠檬酸溶液中并搅拌均匀, 将该混合溶液倒入50 mL的水热反应釜内。 在200 ℃温度条件下反应5 h即可得到具有荧光性质的CDs溶液。 所得到的CDs溶液在室温条件下透析24 h。 透析袋的分子截流量为3 500, 每4 h更换一次水溶液。 透析结束后, 将透析袋内的CDs溶液转移至50 mL梨形瓶中进行真空旋蒸, 除去多余的水分。 将CDs浓缩液置于冻干机中进行低温低压干燥。 最终得到CDs的棕色粉末。
利用紫外吸收光谱, 荧光光谱以及红外光谱等对CDs溶液进行表征。
4.0 mL浓度为26.3 μ g· mL-1 的CDs溶液滴加7.5 μ L Hg2+溶液(Hg2+最终浓度为45 μ mol· L-1)。 向已制备好Hg2+@CDs溶液中滴加7.5 μ L不同浓度的I-溶液且I-最终浓度范围在5.0~75.0 μ mol· L-1之间。 利用荧光光谱仪对该混合体系溶液进行荧光检测, 激发波长为350 nm。 选择发射波长为450 nm处的荧光强度进行对比。
根据公式
式中, σ 为空白标准偏差, D为检测I-的线性曲线斜率。 对Hg2+@CDs荧光传感体系的检测限进行计算。
图1(a)为CDs紫外吸收光谱, 激发光谱以及发射光谱。 由该CDs的紫外吸收光谱可以知道, 在波长为346 nm处, CDs具有最强的吸收。 从CDs的激发光谱以及发射光谱可以知道, CDs对应的激发波长为345 nm, 发射波长为471 nm。 图1(b)显示了CDs的傅里叶变换红外光谱。 分析红外光谱图发现, 1 375 cm-1的吸收峰, 该峰归属于C— N的伸缩振动。 1 662 cm-1的峰归属于C=O伸缩振动。 另外, 在3 251 cm-1处形成的宽峰与O— H的弯曲振动有关, 而1 556 cm-1是由酰胺基(— C=O— NH— )的拉伸振动引起的。 在1 317 cm-1处的峰归因于C=N的典型拉伸振动模式。 因此CDs表面具有— NH2, — COOH以及— C=O— NH— 等基团。 综上所述, 由于紫外吸收光谱, 荧光光谱以及红外光谱的数据均与参考文献相近, 可判断为CDs已被合成[9]。
 | 图1 CDs的紫外-可见光谱图激发光谱图、 发射光谱图(a), CDs的红外光谱图(b)Fig.1 (a) The UV-Visible spectrum, excitation and emission spectrum of CDs; (b) The FT-IR spectrum of CDs |
CDs的XPS全谱图如图2所示, 在289.0 eV [C(1s)]、 403.5 eV [N(1s)]和533.5 eV [O(1s)]呈现有三个较强的峰。 由图2可以知道CDs中的氮含量, 碳含量和氧含量分别估计为16.2%, 49.4%和34.4%。
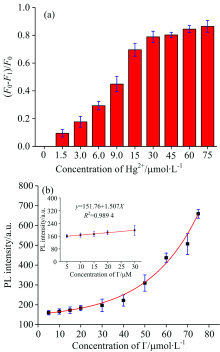
CDs与Hg2+混合后发生荧光猝灭可能是由于CDs激发态到Hg2+的d轨道的非辐射电子转移。 另一种解释是由于Hg2+的半径较大, 同时Hg2+与氮之间存在较强的亲和力, 使得Hg2+与CDs表面的氨基结合形成非荧光复合物, 导致CDs荧光变弱[10]。 图3(a)反映了一定浓度CDs溶液与不同浓度的Hg2+(0.0~75.0 μ mol· L-1)溶液混合后荧光强度变化情况。 选取发射在450 nm处的荧光强度做柱状图进行分析。 当Hg2+浓度在0.0~30.0 μ mol· L-1时, CDs的荧光强度随着Hg2+浓度的增加而不断减弱。 当Hg2+浓度超过30.0 μ mol· L-1之后, CDs的荧光降低的程度变弱, 逐渐趋于稳定状态。 由此, 选取Hg2+浓度为45.0 μ mol· L-1制备Hg2+@CDs荧光传感体系来对溶液中I-进行检测。 图3(b)为Hg2+@CDs体系与不同浓度的I-溶液混合后荧光变化情况。 其中(F0-F1)/F0为相对荧光强度, 其中F0为原CDs溶液荧光强度, F1为Hg2+@CDs混合溶液与一定浓度I-溶液混合后荧光强度。 当I-浓度达到75.0 μ mol· L-1时, 该体系的荧光已恢复到未加入Hg2+时的荧光强度。 这是由于当存在I-时, Hg2+与I-之间存在较强的相互作用, 使Hg2+从CDs表面脱离, 进而使CDs荧光恢复。 随I-浓度增加荧光强度在不断增强, 在I-的浓度为5.0~30.0 μ mol· L-1之间呈线性增加, 其线性拟合结果R2=0.989 4。
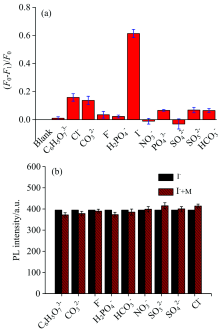
图4(a)中Hg2+@CDs荧光传感体系与一定浓度阴离子溶液混合, 通过荧光光谱仪对其进行检测, 在同一浓度条件下I-溶液与Hg2+@CDs荧光传感体系混合后荧光强度恢复程度最大, 表现出较高的选择性。 I-的变化率是其他离子的3.0倍以上。 图4(b)为一定浓度的I-溶液与已知浓度的不同种阴离子溶液进行混合后, 与Hg2+@CDs混合后的荧光光谱强度。 通过荧光光谱仪对其进行检测选择激发波长为350 nm, 发射波长为450 nm处的荧光强度作柱状图。 由此可知, Hg2+@CDs荧光混合体系对I-具有较强的选择性同时具有较好的离子抗干扰性。
通过水热法合成得到具有良好发光性质的CDs。 通过荧光光谱以及紫外光谱对CDs进行表征, 该CDs的紫外吸收光谱显示在346 nm处出现吸收带, 而CDs的荧光光谱图显示其激发波长为345 nm, 发射波长为371 nm。 另外, 使用红外光谱仪以及高分辨紫外光电子能谱对CDs的表面官能团以及元素进行表征。 红外光谱显示出柠檬酸以及乙二胺通过酰胺键的结合而形成具有荧光性质的CDs。 高分辨紫外光电子能谱则显示出, CDs中N, C和O的含量分别为16.2%, 49.4%和34.4%。 由于Hg2+与CDs之间混合后由于具有相互作用力, 使其相互结合导致CDs荧光发生猝灭。 通过分析Hg2+与CDs混合后的荧光光谱进行分析, 当Hg2+浓度为45 μ mol· L-1时对CDs的荧光猝灭效果最佳。 选择该浓度条件下的Hg2+溶液来制备Hg2+@CDs荧光传感体系。 由荧光光谱图可知道, 当该体系中存在I-时, CDs的荧光开始恢复。 随着I-浓度的上升, 混合溶液的荧光不断增强, 该体系对I-的检测范围为5.0~75.0 μ mol· L-1, 而检测限为0.25 μ mol· L-1。 另外, 通过分析Hg2+@CDs荧光传感体系与各种阴离子进行混合后的荧光光谱可知该混合体系对I-具有较好的选择性以及抗干扰性。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|