作者简介: 李梦瑶, 女, 1995年生, 中粮营养健康研究院营养健康与食品安全北京市重点实验室硕士研究生 e-mail: Mengyaolik@163.com
基于荧光光谱法原理, 结合免疫荧光法和荧光探针法, 建立了番茄蛋白酶类劣变因子荧光传感器阵列检测技术。 该研究合成了能被果胶酶、 过氧化氢酶和超氧化物歧化酶抗体识别的量子点荧光探针, 基于抗原抗体特异性识别原理建立了果胶酶、 过氧化氢酶和超氧化物歧化酶的免疫荧光光谱分析法, 并对其反应参数进行了优化, 在最优条件下, 通过研究其相应的荧光光谱变化规律, 发现果胶酶、 过氧化氢酶和超氧化物歧化酶的活性检测范围分别为0.05~500, 0.02~800和0.5~900 U·mL-1, 且其免疫荧光强度与果胶酶、 过氧化氢酶和超氧化物歧化酶的活性呈线性关系, 相关系数分别为0.989 4, 0.993 8和0.981 9, 最低检测限分别为5.0×10-3, 2.0×10-3和5.0×10-2 U·mL-1, 与现有的分析法相比, 该方法操作简单, 线性范围宽, 检测限低。 针对多酚氧化酶和羧酸酯酶的活性检测, 合成了能被羧酸酯酶和多酚氧化酶特异性识别的水溶性荧光探针, 并对其响应机制和反应参数进行探究。 在37 ℃ pH 7.4条件下通过研究其相应的荧光光谱变化规律, 发现羧酸酯酶和多酚氧化酶的存在可催化荧光团与探针中识别部分的价键裂解, 释放出近红外荧光团, 且荧光基团的释放量与羧酸酯酶(0.01~0.3 U·mL-1)及多酚氧化酶(10~70 U·mL-1)的活性呈线性相关, 其相关系数分别为0.991 0和0.997 2, 最低检测限分别为3.4×10-3和1.1×10-2 U·mL-1。 与现有的近红外荧光探针法相比, 合成的近红外荧光探针具有较好的水溶性, 且特异性较高。 基于荧光光谱法原理, 利用荧光免疫法和荧光探针法相结合的荧光分析方法, 通过荧光酶标仪可针对不同荧光物质设置相应的激发波长和发射波长, 实现多个样品中多种酶活性的同时可视化阵列检测。 通过样品加标回收实验, 结果表明回收率在90.0%~102.3%范围内, 变异系数<15%, 且具有较好的特异性, 说明所建立方法准确度好, 可应用于实际样品的检测。
Based on fluorescence spectroscopy, combined with immunofluorescence and fluorescence probe, a fluorescence sensor array detection technology of tomato protease deterioration factor was established. In this study, a quantum dot fluorescent probe capable of being recognized by pectinase, catalase and superoxide dismutase antibodies was synthesized by carbodiimide method. Immunofluorescence analysis of pectinase, catalase and superoxide dismutase was established based on the principle of antigen-antibody specific recognition, and the influence of its reaction parameters was investigated. Under the optimized reaction conditions (60-min reaction time at 37 ℃), the immunofluorescence intensity presented excellent linearity with the activities of pectinase, catalase and superoxide dismutase by studying the corresponding fluorescence spectrum changes. The detection range of activity was 0.05~500, 0.02~800 and 0.5~900 U·mL-1, respectively. The correlation coefficients were 0.989 4, 0.993 8, 0.981 9, and the detection limits were 5.0×10-3, 2.0×10-3, 5.0×10-2 U·mL-1, respectively. Compared with the existing analysis method, the method is simple in operation, low detection line and linear range. Based on the near-infrared fluorescent probe method, a novel hydrosoluble near-Infrared fluorescence off-on probe has been developed for detecting carboxylesterase and polyphenol oxidase activities. The probe was designed by introducing (4-acetoxybenzyl)oxy and 3-hydroxybenzyloxy respectively as quenching and recognizing moiety to the decomposed product of IR-783, which exhibits excellent near-infrared fluorescence feature and good water solubility. The responding mechanism of the novel probe to carboxylesterase and polyphenol oxidase was investigated. By studying the corresponding fluorescence spectrum changes at 37 ℃ pH 7.4, it was found that the presence of carboxylesterase and polyphenol oxidase will cut off the bonds that connect the fluorophore with a recognition moiety in the probe, resulting in the release of the fluorophore, which achieves the purpose of detecting carboxylesterase and polyphenol oxidase. Moreover, the release amount of the fluorophore is linearly related to the activity of carboxylesterase (0.01~0.3 U·mL-1) and polyphenol oxidase (10~70 U·mL-1). This behaviour leads to the development of a simple and sensitive fluorescent method for assaying carboxylesterase and polyphenol oxidase activity, with detection limits of 3.4×10-3 and 1.1×10-2 U·mL-1, respectively. The correlation coefficients were 0.997 2 and 0.991 0, respectively. Compared with the existing near-infrared fluorescent probe method, the near-infrared fluorescent probe synthesized in this study has better water solubility and higher specificity. The research realized the one-time and visual array detection of various enzyme activities in the sample, which is based on the multi-function fluorescent microplate reader to set the corresponding excitation wavelength and emission wavelength for different fluorescent substances. Through the sample spike recovery experiment, it is found that the recovery rate of the method is within the range of 90.0%~102.3%, the coefficient of variation is <15%, and it has good specificity, which indicated that the method established in this study has good accuracy and is expected to be applied.
过氧化氢酶(catalase, CAT)、 超氧化物歧化酶(superoxide dismutase, SOD)、 多酚氧化酶(polyphenol oxidase, PPO)、 果胶酶(pectinases, PE)和羧酸酯酶 (carboxylesterase, CXE) 等蛋白酶类的活性的变化是评判果蔬等农副产品劣变程度的一个重要指标。 CAT和SOD可以消除过氧化氢、 活性氧等细胞代谢的有害物质, PPO催化多酚物质形成醌类化合物形成, 具有提高植物光合作用、 增强植物防御能力和延缓衰老等作用[1, 2]。 PE分解果胶质, 其主要与果蔬的后熟、 果肉软化、 质地、 色泽及果汁的含量有关, 有研究表明果胶酶与果蔬贮藏期间劣变程度呈负相关, 其活性的高低可以间接反映农副产品新鲜程度。 CXE是一类广泛存在于动植物及微生物中具有α /β 折叠结构域的水解酶类, 能有效地催化酯类和酰胺类化合物水解, 与多种药物、 环境毒物及致癌物的解毒和代谢有关, 并参与脂质运输和代谢[3, 4]。 目前, 对CAT, SOD, PPO, PE和CXE等相关蛋白酶类的检测方法有很多, 如色谱法、 化学发光法、 比色法、 电化学分析法等[5, 6, 7, 8]。 通过实际应用, 发现其操作繁琐、 费时费力较难实现多酶同时检测。
免疫荧光法和荧光探针法因其具有简便性和较高的灵敏度等特点而得到了广泛的应用[9, 11]。 Zhou等[9]报道了一种新型溶酶体靶向荧光探针, 其发射波长为575 nm, 用于检测活细胞、 血清和组织中羧酸酯酶; Jin等[10]制备了一种新的近红外荧光探针, 用于检测活细胞和小鼠内源性羧酸酯酶; 免疫荧光分析技术已广泛地应用于微生物、 农兽药残留、 蛋白类毒素、 重金属残留等方面的检测[12, 13, 14]。 目前, 基于荧光光谱法, 结合荧光免疫法和荧光探针法以实现多种酶活性同时检测的研究较少。 本研究基于荧光光谱的检测原理, 针对不同酶类的特性, 合成了具有定向识别特异性的荧光探针, 结合荧光免疫法和荧光探针法, 开发了多酶同时检测荧光传感器阵列, 实现多个样品中多种酶活性的一次性、 可视化检测。
实验根据以荧光光谱信号的变化, 对不同类型的探针合成条件和检测条件进行了优化。 基于荧光光谱法, 结合免疫荧光法和荧光探针, 建立了番茄蛋白酶类劣变因子荧光传感器阵列检测技术, 实现了对多个样品中多种酶活性的同时快速检测。
IR-783碘化物、 间苯二酚、 4-(氯甲基)苯基乙酸酯、 CAT、 SOD、 PE、 PPO、 CXE购自Sigma-Aldrich公司; 抗体购自Agrisera公司; 量子点(CdSe/ZnS)购自上海昆道生物科技有限公司; 黑色96孔酶标板购自美国Corning公司。 实验中使用的水为Milli-Q超纯水, 0.05% PBS-T(pH 7.4 PBS添加0.05% Tween-20), 其他试剂均为分析纯。
紫外分光光度计, 日本Hitachi公司; 荧光分光光度计, 日本Hitachi公司; Synergy Mx荧光酶标仪, 美国Bio-Tek公司。
1.3.1 果胶酶、 过氧化氢酶和超氧化物歧化酶荧光探针的合成
量取100 μ L量子点至700 μ L 25 mmol· L-1 pH 6.0 PBS 缓冲液中, 加入100 μ L 3 mg· mL-1 NHS和100 μ L 2 mg· mL-1 EDC溶液, 超声分散均匀, 置于30 ℃ 250 r· min-1的恒温培养箱中反应30 min, 于8 000 r· min-1的离心机中常温离心10 min, 去掉上清液。 加入1 mL 500 U· mL-1 果胶酶(800 U· mL-1过氧化氢酶、 900 U· mL-1 超氧化物歧化酶)溶液复溶, 超声分散均匀, 置于37 ℃ 250 r· min-1恒温培养箱中反应1.5 h, 离心10 min, 去掉上清液。 加入1 mL pH 7.4的PBS-T溶液, 超声分散均匀, 在250 r· min-1, 37 ℃摇床震荡1 h, 于4 ℃储存备用[14]。
1.3.2 荧光免疫检测方法的建立
用pH 7.4, PBS缓冲液对果胶酶(过氧化氢酶/超氧化物歧化酶)抗体进行稀释, 100 μ L· 孔-1添加至酶标板微孔中, 置于4 ℃包被过夜; 用0.05% PBS-T洗板三次除去多余的抗体; 添加封闭液1% BSA 250 μ L· 孔-1, 于37 ℃条件下封闭空白位点1.5 h, 用0.05% PBS-T洗涤三次; 每孔加入50 μ L不同浓度的标准溶液(或样品溶液)和50 μ L荧光探针溶液(PBS 稀释), 在 37 ℃下持续反应1 h。 用PBS-T洗涤三次后每孔加入100 μ L PBS缓冲液, 用酶标仪测定其荧光光谱信号, 设定激发波长为375 nm, 测定570 nm(524 nm/622 nm)处的荧光光谱信号, 绘制不同活性的果胶酶(过氧化氢酶/超氧化物歧化酶)标准品溶液的发射光谱。
1.4.1 羧酸酯酶和多酚氧化酶荧光探针的合成
羧酸酯酶荧光探针: 将间苯二酚(110.0 mg, 1 mmol)和碳酸钾(138 mg, 1 mmol)溶解于乙腈(20 mL)中, 在室温及氮气保护下搅拌10 min, 然后将溶解于乙腈(1 mL)中的IR-783碘代物 (374.5 mg, 0.5 mmol)加入到体系中。 将反应混合物在50 ℃下反应5 h, 反应完毕, 减压蒸除溶剂, 得粗产品。 用硅胶柱层析纯化粗产品, 以二氯甲烷/甲醇(20:1, V/V)作洗脱剂, 得到产物为蓝绿色粉末。
将上述合成的蓝绿色粉末(375 mg, 0.5 mmol)和碳酸钾(103.5 mg, 0.75 mmol)溶解于乙腈(4 mL)中, 在室温及氮气保护下搅拌10 min, 然后将溶解于乙腈(1 mL)中的4-(氯甲基)苯基乙酸(180 mg, 1.0 mmol)加入到混合溶液中, 将反应混合物在50 ℃反应5 h。 反应完毕, 真空干燥除溶剂, 得粗产品。 用硅胶柱层析提纯粗产品, 二氯甲烷/甲醇=10:1, 得到产物为深蓝色固体, 即为羧酸酯酶荧光探针。
多酚氧化酶荧光探针: 合成步骤参考Zhang等[15]的研究。
1.4.2 近红外荧光探针检测方法的建立
首先, 配置探针储备液1 mmol· L-1, 在离心管中称取3.27 mg羧酸酯酶探针(3.06 mg多酚氧化酶探针), 加入5 mL二甲基亚砜(DMSO)。 其次, 在5 mL的具刻度管里, 加入4 mL的PBS缓冲溶液(10 mmol· L-1, pH 7.4)以及50 μ L的探针的储备溶液, 混合均匀后加入不同浓度的羧酸酯酶(多酚氧化酶)标准溶液, 用PBS将溶液定容至5 mL, 混合均匀。 在37 ℃下反应30 min(3 h)后, 将0.1 mL反应溶液转移到酶标板中, 在光谱仪上测量荧光强度F。 设定激发波长为670 nm, 测定705 nm(708 nm) 处的荧光强度, 绘制不同活性的羧酸酯酶(多酚氧化酶)标准品溶液的发射光谱。
1.5.1 特异性实验
果蔬等样品的粗提液基质较为复杂, 为了研究在最佳条件下其他物质是否会干扰酶的检测。 本实验通过在相同条件下, 对样本中各种可能存在的干扰物质, 例如NaCl、 KCl、 CaCl2、 抗坏血酸钠、 葡萄糖、 氨基酸(丝氨酸, 苏氨酸)进行了探究。
1.5.2 样品预处理和加标回收实验
取新鲜的番茄, 洗净晾干, 于搅拌机中打碎10 min, 在冰浴状态下用研钵研磨至泥状。 料液比按1: 2的比例称取一定量的番茄泥, 加入样品提取液(0.05 mol· L-1 PBS缓冲液)在4 ℃高速离心机中以5 000 r· min-1的转速进行离心30 min, 取上清液作为样本溶液。 进行超高温加热处理, 致使样本溶液中的酶失活, 待其冷却至室温。 添加一定量的标准品于样本溶液中, 采用建立的方法对样本溶液进行分析。
2.1.1 荧光免疫检测方法原理
如图1(a)所示, 通过1.3.1制备量子点荧光探针。 将抗体直接固定在酶标板的微孔中, 向微孔中同时加入荧光探针和不同浓度的标准酶溶液。 在此步骤中, 标准溶液中的酶将与荧光探针竞争结合包被在酶标板上的固相抗体, 形成荧光免疫复合物, 用荧光酶标仪激发并检测所形成的荧光免疫复合物的荧光光谱信号, 因此可将此性质用于果胶酶(过氧化氢酶、 超氧化物歧化酶)的活性检测; 荧光光谱信号的变化与酶的活性呈反比, 通过测定相关荧光光谱信号的变化可测定酶的活性。
2.1.2 近红外荧光探针法原理
如图1(b)所示, 通过引入羧酸酯酶特异性识别基团4-乙酰氧基苄, 合成了荧光探针即化合物1, 其本身的荧光强度较低, 羧酸酯酶可导致化合物1中的高水溶性苯基乙酸酯水解、 电子发生重排, 最终重新释放具有强荧光团的化合物2, 该化合物在706 nm处具有较强荧光信号, 因此可将此性质用于羧酸酯酶检测; 荧光光谱信号的变化与羧酸酯酶的活性呈正比, 通过测定相关荧光信号的变化可测定羧酸酯酶的活性。 基于此原理, 通过引入多酚氧化酶特异性识别基团3-羟基苄氧基, 合成了特异强、 检测限低的多酚氧化酶的识别近红外荧光探针。
2.1.3 同时检测原理
本研究基于荧光光谱阵列分析法的检测原理, 针对番茄中特征劣变蛋白酶的特性, 合成了具有定向特异性的荧光探针, 结合荧光免疫法和荧光探针法, 开发了多酶同时检测的荧光传感器阵列, 利用荧光酶标仪可针对不通荧光物质设置相应的激发波长和发射波长特点, 以及可以同时独立的检测多个样品的特性, 可实现多个样品中多种酶活性的同时快速可视化检测[图1(c)]。
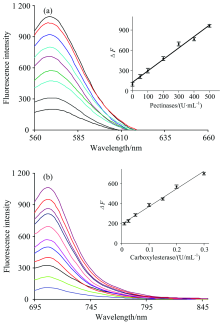
以果胶酶检测模型建立为例, 在最佳反应条件下(pH 7.4 PBS中37 ℃反应60 min), 考察了探针对不同浓度的果胶酶(0, 0.05, 1, 50, 100, 200, 300, 400和 500 U· mL-1)的荧光光谱信号的变化。 由图2(a)可知, 果胶酶的活性在0.05~500 U· mL-1范围内, 探针的荧光光谱信号呈现良好的线性关系, 线性回归方程Δ F=1.696 4c(U· mL-1)+351.57 (R2=0.989 4), 其中Δ F是探针在有无果胶酶存在的条件下其荧光光谱信号的变化, 其最低检测限为5.0× 10-3 U· mL-1。
基于相同原理和方法, 建立过氧化氢酶和超氧化物歧化酶的活性检测模型, 其中, 过氧化氢酶的线性范围为0.02~800 U· mL-1, 相关系数为0.993 8, 检测限2.0× 10-3 U· mL-1; 超氧化物歧化酶的线性范围为0.5~900 U· mL-1, 相关系数为0.981 9, 检测限5.0× 10-2 U· mL-1。
在最佳反应条件下(pH 7.4 PBS中37 ℃反应30 min), 考察了探针对不同浓度的羧酸酯酶(0, 0.01, 0.025, 0.05, 0.1, 0.15, 0.2, 0.3, 0.4, 0.6和1 U· mL-1)的荧光光谱信号的变化。 由图2(b)可知, 羧酸酯酶的活性在0.01~0.3 U· mL-1范围内, 探针的荧光光谱信号呈现良好的线性关系, 线性回归方程Δ F=1 985.9c(U· mL-1)+160.7 (R2=0.991 0), 其中Δ F是探针在有无羧酸酯酶存在的条件下其荧光信号的变化。 其最低检测限为3.4× 10-3 U· mL-1。 基于相同原理和方法, 建立了多酚氧化酶的活性检测模型, 线性范围为10~70 U· mL-1, 相关系数为0.997 2, 检测限1.1× 10-2 U· mL-1。
以果胶酶荧光探针的特异性试验为例。 本实验空白对照孔(50 μ L PBS)荧光强度F0, 含有不同种类干扰物质(30 μ mol· L-1的KCl、 CaCl2、 NaCl、 15 mmol· L-1的抗坏血酸钠、 葡萄糖、 丝氨酸、 苏氨酸)和100 U· mL-1果胶酶标准品溶液的荧光强度F, 以相对荧光强度Δ F(Δ F=F0-F)考察不同抗原对免疫检测荧光信号的影响。 如图3所示, 和其他干扰物的荧光信号值相比, 含有果胶酶的荧光响应信号值较高, 这表明该探针对果胶酶具有较好的选择性, 且在复杂的样本生物环境中具有很高的特异性。 基于相同的方法原理, 对其他4种酶的荧光探针的特异性进行了研究, 均表现出较好的选择性。
该实验按照1.5.2步骤制备番茄样品提取液, 并对五种酶进行三个梯度的加标回收, 分别对每种酶进行五组平行试验, 基于所开发的方法, 对72个样品进行同时检测。 实验结果如表1所示, 应用该方法检测得到的回收率在90.0%~102.3%之间, 变异系数< 15%, 说明所建立方法准确度好, 可应用于实际样品的检测。
| 表1 番茄样品添加回收实验(n=5) Table 1 Addition and recycling experiment of sample (n=5) |
基于荧光光谱法, 结合免疫荧光法和荧光探针, 建立了番茄蛋白酶类劣变因子荧光传感器阵列检测技术。 实验以荧光信号的变化为指标, 对荧光探针合成条件、 检测时间及免疫荧光分析检测条件等参数进行优化。 在最优条件下, 分别建立果胶酶、 过氧化氢酶、 超氧化物歧化酶、 羧酸酯酶和多酚氧化酶5种酶的检测模型, 其相关系数分别为0.989 4, 0.993 8, 0.981 9, 0.991 0和0.997 2, 最低检测限分别为5.0× 10-3, 2.0× 10-3, 5.0× 10-2, 3.4× 10-3和1.1× 10-2 U· mL-1。 基于多功能荧光酶标仪可针对不同荧光物质设置相应的激发波长和发射波长, 通过一次扫描检测实现5种酶的同时可视化阵列检测技术, 并对番茄样品进行加标回收试验, 结果表明该方法回收率高, 且具有较好的稳定性和特异性。 所建立的方法可以实现样品中多种酶的同时、 快速检测, 为实际检测节省了大量时间, 具有良好的应用前景。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|