作者简介: 相 缨, 女, 2000年生, 东北农业大学食品学院本科生 e-mail: harbinxying@163.com
以黑米花色苷为原料, 乙醛介导化学合成儿茶素-黑米花色苷复合物, 通过红外光谱法和热力学参数测定探究儿茶素-黑米花色苷复合物缩合反应机制。 试验结果表明, 儿茶素-黑米花色苷复合物在红外光谱特征区3650~3 200 cm-1 —OH伸缩振动区3 207.90和3 217.90 cm-1处具有宽且强的吸收峰; 在1 680~1 540 cm-1 C=C伸缩振动区1 604.92和1 605.65 cm-1处出现了苯环骨架振动吸收峰; 在1 300~1 000 cm-1 C—O伸缩振动区1 278.01, 1 138.34和1 018.19 cm-1处出现红外吸收峰。 由此可见, 儿茶素-黑米花色苷复合物与黑米花色苷结构框架基本相同主要以—OH, C=C和C—O取代基组成的芳环结构为主。 儿茶素-黑米花色苷复合物与黑米花色苷相比, 在C=C 伸缩振动区不仅在1 604.92和1 493.59 cm-1处出现了吸收峰, 而且还在1 454.78, 1 233.98和817.56 cm-1处出现了三个新的吸收峰。 通过吸收峰归属分析发现, 1 454.78 cm-1吸收峰属于—CH3反对称变形或—CH2变形振动波段, 该吸收峰出现证明了儿茶素-黑米花色苷复合物结构中“乙基桥”的存在, 证实了儿茶素和黑米花色苷之间确实发生了缩合反应。 817.56和1 233.98 cm-1两处吸收峰的出现意味着儿茶素和黑米花色苷缩合反应发生后产物结构中的部分基团的平面价键发生弯曲, 迫使其结构框架中C—O键极性增强。 此外, 热力学参数测定结果证实儿茶素和黑米花色苷之间的缩合反应为吸热、 非自发反应, 反应产物儿茶素-黑米花色复合物结构稳定。
Catechin-black rice anthocyanin complex was chemically synthesized by black rice anthocyanin using acetaldehyde-mediated. The reaction mechanism of catechin - black rice anthocyanin complex was determined by infrared spectrum and thermodynamic parameters. The results showed that the catechin-black rice anthocyanin complex had a wide and strong absorption peak of —OH stretching vibration region at 3 207.90 and 3 217.90 cm-1, and appeared the benzene ring skeleton vibration absorption peak at C=C stretching vibration region around 1 604.92 and 1 605.65 cm-1. The infrared absorption peaks appeared at 1 278.01, 1 138.34 and 1 018.19 cm-1 in the 1 300~1 000 cm-1 C=O telescopic vibration region. It can be concluded the catechin-black rice anthocyanin complex and black rice anthocyanin had basically same structure framework with the main structure of aromatic ring structure —OH, C=C and C=O substituted groups. Compared with black rice anthocyanin, of catechin-black rice anthocyanin complex had the absorption peak not only at 1 604.92 and 1 493.59 cm-1, but also at 1 454.78, 1 233.98 and 817.56 cm-1. Based on absorption peak assignment, it was found that the absorption peak at 1 454.78 cm-1 belonged to —CH3 antisymmetric deformation or —CH2 deformation vibration band, which proved the existence of “ethyl bridge” in catechin-black rice anthocyanin complex. It was confirmed that there was condensation reaction between catechin and black rice anthocyanin. The appearance of absorption peaks of 817.56 and 1 233.98 cm-1 indicated that the plane valence bonds of some groups bent after the condensation reaction between catechin and black rice anthocyanin, which increased the polarity of C=O bond. In addition, the results of thermodynamic parameters showed that the condensation reaction between catechin and black rice anthocyanin was endothermic and non-spontaneous, and the structure of catechin-the black beige complex was stable.
花色苷(anthocyanins)是由花青素通过糖苷键与一个或多个糖苷配体(主要包括葡萄糖苷、 半乳糖苷、 鼠李糖苷和阿拉伯糖苷等)结合而成的一类天然水溶性色素[1]。 由于花色苷的极性较强, 通常不会被细胞直接吸收而进入人体的循环系统。 已有的研究表明, 花色苷总摄入量的5%~10%是在小肠中被人体吸收的, 大部分的花色苷物质(占总摄入量的90%~95%)会积聚在大肠腔内, 与其他结合物一起被排泄到肠腔, 最终在结肠微生物菌群作用下被分解为一系列可吸收的低分子量花色苷代谢产物[2, 3]。 因此, 花色苷生物利用度的提高是花色苷生物活性发挥的重要条件。 花色苷的生物利用度与其结构的复杂程度和聚合形式是密切相关的, 通常低分子量(如单体和二聚体)或能以完整结构到达结肠的低聚物(如分子量在40 000 Da的缩合或可水解的单宁)都极易被人体所吸收[4]。
黄烷醇化合物是一类以无色矢车菊甙元、 无色天竺葵甙元或无色飞燕草甙元为主要结构框架的多酚类物质, 其在葡萄酒陈酿和贮藏期间易与花色苷发生反应形成二聚体结构, 而改善葡萄酒的涩感强弱和颜色稳定性[5]。 因此, 人工模拟葡萄酒陈酿时期环境, 亦即在微量乙醛存在的酸性条件下, 利用乙醛本身可作为“ 共聚剂” 的特性[6]促使黄烷醇化合物(儿茶素)和黑米中的花色苷发生缩合反应化学合成花色苷复合物(见图1)以期改善黑米花色苷的生物利用度。
 | 图1 乙醛介导儿茶素-花色苷复合物的合成途径Fig.1 Synthetic pathway of catechin-anthocyanin complex mediated by acetaldehyde |
红外光谱(FTIR)是利用有机物分子结构中不同的化学键和官能团吸收频率不同来获得分子特征官能团的结构信息进而实现对花色苷分子结构的鉴定[7]。 在儿茶素和黑米花色苷缩合反应合成的复合物结构中因“ 乙基桥” 的存在, 将会在红外光谱— CH3反对称变形和— CH2变形振动谱区[(1 460± 10) cm-1]出现新的吸收峰。 因此, 按照峰区指认各谱带的归属并结合指纹区的谱带特征, 可以实现对儿茶素-花色苷复合物这一花色苷二聚体结构的快速检测。
黑米购买于黑龙江省五谷信合生态农业开发有限公司, 产地为黑龙江省哈尔滨市通河县。 儿茶素(≥ 98%)购买于上海源叶生物科技有限公司。 AB-8大孔吸附树脂购买于天津海光化工有限公司。 所用试剂均为色谱纯或分析纯。
原料黑米经粉碎、 筛分后放于烧杯中, 按料液比1:10(W/V)的比例加入50%乙醇溶液, 于30 ℃条件下水浴搅拌提取2 h, 所得样液经抽滤、 旋转蒸发去除乙醇。 按100 mL黑米花色苷提取液加10 mg吸附剂的比例加入活化后的AB-8大孔树脂, 于室温在转速为100 r· min-1的条件下进行24 h吸附处理。 其后, 吸附了花色苷的大孔树脂经过滤、 去离子水洗涤2次后, 加入70%乙醇溶液(含有1%盐酸)进行24 h解析处理, 所得解析液经旋转蒸发、 浓缩、 冷冻干燥即为黑米花色苷样品。
黑米花色苷样品和儿茶素标准品配制成浓度为1 mg· mL-1的工作液, 乙醛溶液浓度调整至4.55× 10-2 mol· L-1。 其后, 在具塞三角瓶中分别加入同体积的上述工作液, 并用色谱级甲酸调整pH值至3.2。 同时, 以同浓度黑米花色苷溶液为试验空白对照组, 将其放于25 ℃的温度条件下震荡反应24 h。 所得样液经旋转蒸发、 浓缩、 冷冻干燥后, 待测。
将儿茶素-黑米花色苷复合物和黑米花色苷样品分别与溴化钾混合均匀后压片, 利用Spectrum GX型傅里叶变换红外光谱仪(美国PerkinElmer公司)进行红外光谱分析。 其光谱范围为4 000~500 cm-1, 分辨率2 cm-1, 扫描信号累加次数为32次, 扫描时扣除了水和二氧化碳的干扰。
1.5.1 样品的处理
将浓度为1 mg· mL-1儿茶素-黑米花色苷复合物溶液与等体积pH 3.5的柠檬酸-柠檬酸钠缓冲液混合均匀分装于具塞试管中, 其后将其分别放置于40, 50, 60, 70和80 ℃的水浴锅中加热4 h进行热处理, 并测定其于波长520 nm处的吸光度值。
1.5.2 热力学参数的计算
参考文献[10]的方法, 应用一级动力学模拟不同条件下儿茶素-黑米花色苷复合物的降解, 并根据动力学方程计算出不同温度下儿茶素-黑米花色苷复合物的焓变Δ H(kJ· mol-1)、 吉布斯自由能Δ G(kJ· mol-1)和熵Δ S[kJ· (mol· K)-1]。
每组实验进行3次平行, 利用统计学软件SPSS16.0对数据进行差异显著性分析, 利用Origin 8.6软件进行作图。
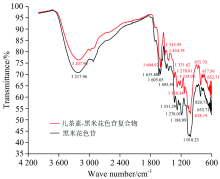
儿茶素-黑米花色苷复合物的红外光谱图如图1所示, 其吸收峰所对应的官能团谱带归属如表1所示。 从中我们可以看出, 儿茶素-黑米花色苷复合物和黑米花色苷在红外光谱特征区3 650~3 200 cm-1 -OH伸缩振动区3 207.90和3 217.90 cm-1处具有宽且强的吸收峰, 归属于酚类物质结构中的羟基, 由于羟基间氢键的形成致使该区间的红外吸收峰宽而深[13]; 在1 680~1 540 cm-1 C=C伸缩振动区1 604.92和1 605.65 cm-1处出现了苯环骨架振动吸收峰; 在1 300~1 000 cm-1 C— O伸缩振动区儿茶素-黑米花色苷复合物在1 278.01, 1 138.34和1 018.19 cm-1处, 黑米花色苷在1 278.01, 1 188.99和1 018.23 cm-1处均出现红外吸收峰。 由此可见, 儿茶素-黑米花色苷复合物与黑米花色苷结构框架相同仍主要以— OH, C=C, C— O三种类型取代基组成的芳环结构为主。 但是, 当将儿茶素-黑米花色苷复合物和黑米花色苷的红外光谱进行比较发现, 黑米花色苷在C=C伸缩振动区有三个吸收峰, 分别位于1 635.88, 1 605.65和1 493.59 cm-1处, 而儿茶素-黑米花色苷复合物仅在1 604.92和1 493.59 cm-1处出现了两个吸收峰。 此外, 儿茶素-黑米花色苷复合物在1 454.78, 1 233.98和817.56 cm-1处出现了三个新的吸收峰。 对这些吸收峰的归属分析发现, 1 454.78 cm-1处吸收峰归属于— CH3反对称变形或— CH2变形振动波段, 该吸收峰的出现证明了儿茶素和黑米花色苷复合物结构中— CH3或— CH2基团的存在, 证实了儿茶素和黑米花色苷之间确实发生了缩合反应。 而817.56和1 233.98 cm-1两处吸收峰的出现, 意味着儿茶素和黑米花色苷之间“ 乙基桥” 的存在, 促使其平面价键发生弯曲振动, 迫使复合物结构框架中C— O键极性增强。 通过红外光谱特征峰反映出的官能团和成键信息分析, 证实了乙醛介导、 经缩合反应合成的儿茶素-黑米花色苷复合物以乙基键相连的合成机制。
儿茶素-黑米花色苷复合物热力学参数测定结果如表2所示。 Δ H代表反应物化学键的强弱程度, Δ H越小, 其能量势垒越低而利于活化复合物的形成[14]。 儿茶素-黑米花色苷复合物在不同温度下的Δ H均为正值, 表明儿茶素和黑米花色苷之间的缩合反应为吸热反应。 Δ G代表反应物的能量和活化状态之间的差异, 通常被当作反应过程是否为自发的判定标准[15]。 儿茶素-黑米花色苷复合物的Δ G为正值, 表明儿茶素和黑米花色苷之间的结合过程为非自发的反应。 Δ S代表反应体系中分子混乱程度, 亦即反映反应系统到其自身热力学平衡的距离。 Δ S较低意味着物质刚刚通过了初始结构的某种物理或化学重排, 使其处于了接近其自身热力学平衡的状态。 表2中Δ S均为负值, 表明活化复合物的结构自由度低于反应物, 其初始系统和热力学平衡之间的距离缩短了, 儿茶素和黑米花色苷缩合所形成的儿茶素-黑米花色苷复合物结构趋于稳定。
| 表2 儿茶素-黑米花色苷复合物的热力学参数 Table 2 Thermodynamic parameters of Catechin-black rice anthocyanin complex |
利用红外光谱法对儿茶素-黑米花色苷复合物缩合反应机制进行解析时, 根据复合物结构中出现的新官能团乙基(— CH2CH3)的特征吸收峰, 按照峰区指认各谱带的归属并结合指纹区的有关谱带, 即可构建出儿茶素-黑米花色苷复合物特征结构。 同时, 结合热力学参数的测定结果, 确定儿茶素和黑米花色苷之间的缩合反应为吸热、 非自发反应, 其缩合反应产物儿茶素-黑米花色复合物具有较低的自由度和稳定的结构。 由此可见, 红外光谱法结合热力学参数的评价模式可以对具有特定官能团的花色苷聚合物进行快速、 准确、 有效的评价。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|