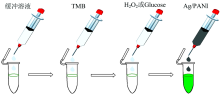
作者简介: 张 垒, 1995年生, 上海工程技术大学材料工程学院硕士研究生 e-mail: 248307531@qq.com
表面增强拉曼散射(SERS)是利用金属或金属纳米颗粒作为检测基底的一种分析测试技术, 可用于表征分子振动的信息, 具有良好的再现性和稳定性。 纳米酶是一种具有催化功能的纳米材料, 近年来, 纳米材料模拟酶催化活性的研究发展迅速, 引起了生物学、 医学等学科的广泛研究兴趣。 与天然酶不同的是纳米酶能够避免生物酶易失活的弱点, 在水或缓冲溶液中表现出较高的稳定性和良好的催化性能, 可调催化活性和制备方法简单的特点, 使其在分析催化化学和酶动力学领域具有广泛的应用前景。 目前SERS技术与模拟生物酶催化活性相结合的研究十分有限, 大部分纳米酶的研究采用紫外可见吸收光谱对纳米酶催化性能进行分析, 检测手法比较单一。 通过一步自组装氧化还原聚合法制备聚苯胺(PANI)基体中的Ag纳米颗粒, 在苯胺的聚合过程中, 利用AgNO3和3-氨丙基三乙氧基硅烷(APTES)作为氧化剂和结构诱导剂, 在还原AgNO3的同时进行苯胺的氧化聚合, 制备出了具有SERS增强性能, 且具有模拟过氧化物酶和葡萄糖氧化酶两种模拟酶活性的Ag/PANI纳米复合材料。 经过研究发现, 这种纳米复合材料不仅可以作为单独的过氧化物酶或者葡萄糖氧化酶实现催化功能, 还可以作为串联酶, 直接通过氧化3,3',5,5'-四甲基联苯胺(TMB)反映葡萄糖的浓度。 因此将SERS技术和模拟酶催化研究相结合, 利用SERS技术实现了对过氧化氢、 葡萄糖以及TMB更加快速有效地检测。
Surface-Enhanced Raman Scattering (SERS) is an analytical test technique that uses metal or metal nanoparticles as a detection substrate. It can be used to characterize molecular vibration information with good reproducibility and stability. Nanozymes are nanomaterials with catalytic functions. In recent years, the research on the catalytic activity of nanozymes has developed rapidly, which has aroused extensive research interest in biology and medicine. Nanozymes can avoid the characteristics of easy inactivation of biological enzymes, exhibits high stability and good catalytic performance in water or buffer solution. It has broad application prospects in the field of catalysis and enzyme kinetics due to its catalytic activity and simple preparation method. However, the research on the combination of SERS technology and the simulation of the catalytic activity of biological enzymes is limited. Most of the studies use UV-visible absorption spectroscopy to analyze the catalytic performance of nanozymes. In this paper, Ag nanoparticles in the PANI matrix were prepared by one-step self-assembly redox polymerization. In the polymerization of aniline, a composite of AgNO3-(3-aminopropyl) triethoxysilane (APTES) acts as oxidants and structure inducers; then the reduction of AgNO3 is accompanied by the oxidation of aniline, resulting in the formation of Ag nanoparticles within a PANI matrix. It can be found that nanocomposite can function as not only peroxidase and glucose oxidase, but also tandem enzyme, which directly reflect glucose concentration by oxidizing TMB. Therefore, SERS technology and simulated enzyme catalysis research are combined in this paper, and SERS technology is used to detect H2O2, glucose and TMB more quickly and effectively.
纳米酶是一类既有纳米材料的独特性能, 又有催化功能的模拟酶, 具有催化效率高、 稳定、 经济和可规模化制备的特点[1, 2, 3, 4] 。 2007年Gao等[5]发现Fe3O4纳米颗粒(NPs)具有过氧化物酶催化活性后, 其他很多具有模拟酶活性的纳米材料相继被发现, 如Au NPs、 CeO2 NPs、 Co3O4 NPs和碳基纳米材料等[6, 7]。 天然蛋白酶通常工作在各种生物基质相关的系统中, 限制了天然酶的应用。 与天然蛋白酶不同, 纳米酶可以在水或缓冲溶液中, 且表现出良好的催化性能, 大多数纳米酶包含过渡金属原子或离子甚至不同的碳纳米材料, 而这些金属或碳纳米材料的活性可能是影响纳米酶催化活性的重要因素[8]。 合理调节纳米酶的某些外部可控因素, 能够使纳米酶更接近于它的天然对应物, 甚至优于其天然对应物。
导电高分子聚合物具有优异的导电性能, 因此作为一种先进的材料受到人们的广泛关注。 在各种导电高分子聚合物中, 聚苯胺PANI因其导电性可调、 合成方便、 成本低等优点得到了广泛的应用[9, 10]。 由于具有丰富的胺和亚胺基团, 聚苯胺(PANI)也被认为是无机纳米粒子的理想载体, 特别是由PANI和功能性无机纳米颗粒组成的杂化产物, 往往由于其协同效应, 比独立组分表现出新的或更优越的性质。 例如, 研究学者将金纳米颗粒作为载体直接还原沉积在预合成的PANI纳米纤维表面, 制备了具有纳米纤维形态的Au/PANI纳米复合材料[11]。
通过使用简单方便的一步自组装氧化还原聚合法制备了Ag/PANI纳米复合材料, 使用SERS作为主要的检测手段, 研究了Ag/PANI纳米复合材料作为串联酶(模拟过氧化物酶和模拟葡萄糖氧化酶)的催化性能。
采用日立高新S-4800冷场发射扫描电子显微镜对纳米复合材料进行微观形貌分析, 并进行能谱扫描, 检测纳米复合材料的成分。 采用日本岛津公司的紫外可见分光光度计(UV-Vis)对其进行吸光度研究。 采用HORIBA集团生产的拉曼光谱仪(HR Evolution)对纳米复合材料样品进行SERS分析, 激发光波长选择633 nm。 制备纳米材料所有试剂见表1。
| 表1 化学试剂详细信息 Table 1 Type of chemical reagent |
通过一步自组装氧化还原聚合法制备Ag/PANI纳米颗粒[12], 将10 μ L的3-氨丙基三乙氧基硅烷(APTES)和4.6 mL的水分别滴入到50 mL的烧杯中, 磁力搅拌5 min后, 加入0.5 mL AgNO3水溶液(8.63 mg· mL-1), 继续磁力搅拌5 min。 向上述溶液中加入10 μ L的苯胺单体, 保持磁力搅拌反应4 h, 完成苯胺的聚合和AgNO3的还原过程。 最后将得到的产物用水和乙醇分别洗涤2次, 移除上清液后将样品在空气中干燥24小时, 然后将干燥好的纳米复合材料粉末配置成水悬浮溶液(3 mg· mL-1)。 为了进行对比实验, 用同样的方法 (0.5 mL 20 mg· mL-1 HAuCl4)制备了Au/PANI纳米复合材料。
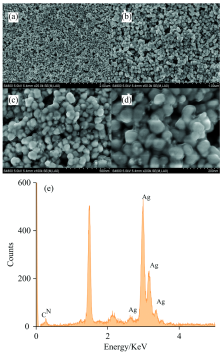
使用扫描电子显微镜(SEM)对纳米复合材料的微观形貌进行表征。 图2显示了Ag/PANI在不同放大倍数下的SEM图像, 放大倍数为25× 103和50× 103时[如图2(a)和(b)所示], 可以看出纳米颗粒基本呈现球型, 且大小均一, 分散性良好, 类似蜂巢状分布。 当放大倍数进一步增大时如图2(c, d)所示, 可以看出纳米颗粒大小在50 nm左右, 分布均匀, 呈现石榴状。 相比之下Au/PANI纳米复合材料颗粒较大, 大多呈现棒状, 少量呈现椭圆状, 大小约在2 μ m左右。 此外, 本文通过EDS能谱扫描进一步验证了纳米颗粒是PANI和Ag的复合材料, 如图2(e)能谱图所示, 纳米颗粒是由C, N和Ag元素组成。
模拟过氧化物酶可以在H2O2存在下将显色底物3, 3’ , 5, 5’ -四甲基联苯胺(TMB)催化氧化成oxTMB, 从而使溶液颜色发生变化, 因此可以通过TMB的显色反应直观检测过氧化物酶的活性, 其原理如图3所示。 目前大量的模拟酶活性研究以及微量检测中最常用的是通过TMB被氧化生成oxTMB时在650 nm处的紫外吸收峰值检测过氧化物酶的活性[13], 本文使用的Ag/PANI可以作为具有增强效果的SERS基底, 因此采用毛细管吸取液体直接进行SERS检测, 通过检测oxTMB的拉曼峰值检测纳米复合材料的模拟酶活性。 相比于常见的紫外-可见吸收光谱测试纳米酶活性, 本文直接吸取液体进行SERS检测, 更快速、 精准、 灵敏的拉曼特征峰, 该测试技巧可以通过便携式拉曼光谱仪随时随地、 更加方便快捷地实现检测。
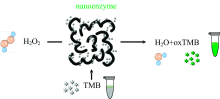 | 图3 纳米颗粒作为过氧化物酶与H2O2反应氧化TMB的原理示意图Fig.3 Schematic diagram of TMB oxidation by nanoparticles as peroxidase reacting with H2O2 |
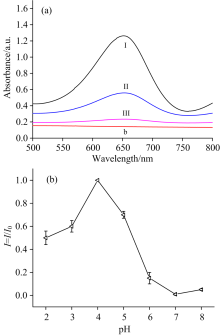
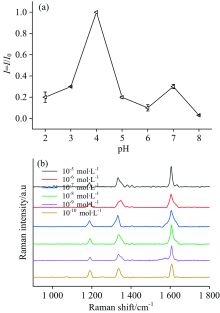
为了研究所制备的Ag/PANI的过氧化物酶活性, 在实验过程中, 通过控制变量法进行了对比试验, 如表2所示, 只有一定量的TMB和30%的过氧化氢, 与适量的纳米颗粒震荡反应10 s后, 溶液的颜色才有明显变化, 随后离心、 取上清液加入微量比色皿中进行紫外吸收光谱测试, 结果表明650 nm处有明显的吸收峰[图4(a)]。 图4(b)为纳米复合材料作为模拟过氧化物酶在不同pH的缓冲溶液中活性的研究, 在pH不同的缓冲溶液下, 对反应体系进行拉曼光谱测试(探针分子为oxTMB), 并选取1 611 cm-1处的拉曼峰值为I, 缓冲溶液pH 4.0 时1 611 cm-1 处的SERS强度作为标准值I0。 可以看出纳米复合材料在pH 4.0时, 过氧化物酶活性最高(后续试验均选取pH 4.0的缓冲溶液)。
| 表2 不同反应体系的成分以及对应的视觉照片 Table 2 The components of different reaction systems and corresponding visual photographs |
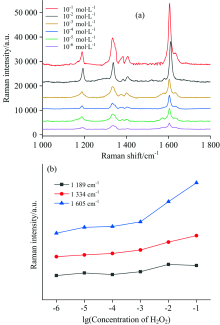
为了进一步检测Ag/PANI作为过氧化物酶催化氧化TMB的活性, 选取浓度更低的H2O2(10-1~10-6 mol· L-1)与TMB反应, 并进行拉曼光谱测试, 结果如图5(a)所示, 可以看出oxTMB的拉曼峰仍然清晰, 且没有发生光谱干扰等现象, 通过1 189, 1 334和1 611 cm-1处oxTMB的拉曼峰强度折线图可以看出在很大范围内, 呈现良好的线性关系如图5(b)所示, 特别是1 334 cm-1处拉曼峰的强度。 为了进一步验证Ag/PANI的活性优于Au/PANI, 对两种纳米颗粒与不同浓度的H2O2进行TMB显色反应, 并进行拉曼光谱测试, 取1 611 cm-1处的拉曼峰值进行拟合。 结果表明, Ag/PANI比Au/PANI具有更优异的催化活性, 这可能是由于在一步氧化还原聚合法中, 金纳米颗粒与PANI发生络合作用导致的纳米颗粒较大, 从而影响了纳米颗粒的催化效果。
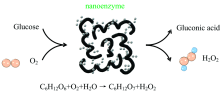
葡萄糖氧化酶(glucose oxidase, GOD)是食品工业中一种重要的工业用酶, 广泛用于食品快速检测及生物传感器。 葡萄糖氧化酶氧化1 mol葡萄糖需要消耗1 mol氧气并生成1 mol H2O2: C6H12O6+O2+H2O→ C6H12O7+H2O2, 因此, 葡萄糖和葡萄糖氧化酶的催化反应可以作为H2O2的来源, 当纳米颗粒具有葡萄糖氧化酶活性时, 便可以代替GOD进行葡萄糖氧化反应(原理图如图6所示)。
当纳米材料同时具有葡萄糖氧化酶活性和过氧化物酶活性时, 在TMB的显色反应中, 该纳米颗粒可以作为串联酶, 实现对葡萄糖的检测[14]。 在整个反应过程中, 首先作为葡萄糖氧化酶与葡萄糖反应, 生成H2O2, 同时作为过氧化物酶在第一步提供了H2O2的条件下, 与TMB发生显色反应。 原理如图7所示, 其中图7(a)部分是纳米复合材料作为葡萄糖氧化酶氧化葡萄糖的反应, 为TMB的显色反应提供了H2O2, 图7(b)部分是纳米颗粒作为过氧化物酶与H2O2反应催化氧化TMB。
通过对不同pH值的缓冲溶液形成的反应体系进行拉曼光谱测试, 检测oxTMB在1611 cm-1的峰值, 并进行拟合处理, 研究了反应体系的pH值对Ag/PANI作为串联酶活性的影响[图8(a)], 可以看出当反应体系的pH值为4.0时, 酶活性最高。 在上述最优条件下, 通过降低葡萄糖水溶液的浓度, 研究了Ag/PANI作为串联酶的酶活性, 如图8(b)所示, 当与串联酶反应的葡萄糖浓度低至10-10 mol· L-1时依然可以进行催化氧化TMB的反应, 生成oxTMB, 且拉曼信号清晰可见。
采用一步自组装氧化还原聚合法, 成功制备了具有SERS增强效果的Ag/PANI纳米复合材料, 研究了纳米复合材料的模拟酶活性。 结果表明, 这种Ag/PANI纳米复合材料不仅具有模拟过氧化物酶活性, 还具有葡萄糖氧化酶的活性, 且pH 4.0时酶活性最高。 在最优条件下, 研究了纳米颗粒作为串联酶的活性, 通过直接氧化葡萄糖自提供H2O2, 继而反应氧化TMB, 实现间接检测葡萄糖, 检测极限可达10-10 mol· L-1。 在检测方法上, 与SERS技术相结合, 避免了紫外-可见吸收光谱制样中离心等步骤带来的影响。 此外, 随着便携式拉曼光谱仪的迅速发展, SERS检测可以在更多场合下实现对葡萄糖更加方便快捷、 精准灵敏的检测。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|