作者简介: 张微微, 1984年生, 滁州学院生物与食品工程学院讲师 e-mail: 249541998@qq.com
目前传统氧化稳定性评价方法无法提供油脂氧化历程和不同产物变化动态信息等特点, 因而不能成为理想评价方法。 同步荧光光谱技术具有一定灵敏度和准确度, 且适合较长时间的固定检测。 以不同工艺花生油作为研究对象, 采用OXITEST油脂氧化稳定性仪进行加速氧化试验, 获取氧化诱导曲线, 同时采集氧化期间油脂三维同步荧光光谱数据与理化指标, 通过同步荧光光谱结合平行因子法(PARAFAC)和人工神经网络(ANN)等化学计量学快速分析油脂氧化进程。 结果表明, 以诱导期作为油脂稳定性评价指标, 冷榨花生油氧化稳定性较热榨花生油差, 主要原因在于热榨方式的高温焙炒, 使得其具有抗氧化物质, 进而提高了油脂的氧化稳定性。 氧化曲线清晰地表明氧化进程存在诱导期(IP)、 氧化期和静止期三个阶段, 结合三维荧光光谱图, 明显得出在氧化过程中花生油原油激发波长在300~400 nm的荧光峰强度在进入诱导期后, 荧光强度减弱, 荧光波长出现红移现象; 进入氧化期后, 在400~450 nm之间有新的荧光峰生成, 然后荧光峰强度呈现增强状态, 直至静止期。 现象的产生主要是由于油脂氧化过程中生成的小分子氧化产物, 致使荧光光谱产生斯托克位移(Stocks shift)。 运用PARAFAC法对同步荧光光谱数据进行降维处理, 显示当组分数为6, Δ λ为70 nm时载荷值最大, 不同样品间差异最显著。 选定该波段二维荧光光谱数据作为ANN模型输入值, 分别以酸价和过氧化值作为模型输出值, 对不同工艺花生油的氧化过程数据进行建模训练。 结果显示训练集、 测试集模型相关系数R均接近1.0, 均方根误差均较小, 说明该模型能较好地反映油脂氧化过程状态。 本研究结果表明同步荧光光谱结合化学计量学能快速实时监控食用油在氧气影响下贮藏过程中的氧化历程, 为油质控制提供理论依据。
At present, the tradition way to detect the oxidative stability could not provide information about a variety of chemical species and simultaneously in real time, and so on. Synchronous fluorescence spectroscopy is considered to be an ideal method, because it is sensitive and reproducible, and should be amenable to longer periods. Combined methods of synchronous fluorescence spectrometer with chemometrics were to monitor the oxidation of peanut oil, which were stored under OXITEST oil oxidation stabilizer to carry out accelerated oxidation test. There was the oxidation induction curve in the accelerated oxidation test, and meanwhile, the 3D synchronous fluorescence spectral data and physical and chemical indexes were collected. The results showed that the Induction Period (IP) of cold pressed peanut oil was worse than that of hot-pressed peanut oil. The hot-pressed peanut oil was roasted at high temperature, which made antioxidant substances to improve the oxidation stability. It was clearly showed induction period, oxidation period and the static period from the oxidation curve. The fluorescence peak of Ex shifted from 300~400 to 400~450 nm. With the increment of oxidation time, the fluorescence peak changed significantly, and the red shift appeared in the fluorescence wavelength. Data multidimensional was reduced by the parallel factor analysis (PARAFAC) method. It was used to select an optimized Δ λ of 70 nm on 6 components with the adequate loading score. Then the artificial neural network (ANN) was used to build a regression model for both synchronous fluorescence and the acid value and peroxide value respectively to evaluate the degree of the oil oxidation. The peanut oil exhibited a high regression coefficient ( R=0.99) between fluorescence intensity and acid value in the training and the testing. The overall results suggested that synchronous fluorescence spectroscopy combined with chemometrics was useful for rapidly monitoring oil oxidation process in time, and could provide a theoretical basis for the formation of oxidation products and evolution of fluorescence spectra.
花生油营养丰富, 气味芬芳, 深受人们喜爱[1]。 花生油在储藏与使用过程中的品质优劣与食品工业的发展和人们的健康息息相关。 油脂中不饱和脂肪酸的氧化是引起油脂酸败的主要原因。 油脂氧化产物除了影响食用油风味、 色泽等, 还会缩短货架期、 降低油脂品质[2]。 氧化稳定性是衡量油脂品质的重要质量指标[3, 4]。 目前油脂氧化稳定性的研究主要有烘箱法和Rancimat法(氧化酸败法)。 烘箱法主要通过化学滴定、 高效液相色谱法或气相色谱法测定常规化学组分, 例如过氧化值、 酸值、 对苯胺值等代谢挥发性化合物[4]; Rancimat法直接通过在线测量食用油氧化稳定性而被用于评价油质[5]。 然而, 由于这些方法的低灵敏度、 样品的预处理复杂、 耗时长与获取信息的单一性使得测定方法受到限制。
荧光光谱技术是一种具有高灵敏度和快速高效分析的技术。 食用油中存在的荧光物质使得荧光技术在油脂氧化程度监控和鉴别应用方面得到迅速发展[6, 7]。 与常规荧光技术相比, 同步荧光光谱技术在激发与发射波长之间保持波长间距(Δ λ )条件下同时进行扫描, 获取涵盖更多有效信息的三维荧光光谱[8], 更有利于多组分混合物的定性分析和物质鉴别。 Sikorska等利用同步荧光光谱技术量化了食用蔬菜籽油中的生育酚物质[9]。 数学统计研究发现荧光强度与脂质氧化产物存在高度相关性, 因此化学计量学结合光谱技术快速评价油脂品质效果显著[10]。 平行因子分析法(PARAFAC)、 人工神经网络分析法(ANN)、 主成分分析法(PCA)等是光谱数据处理与相关化学指标间关系最常用的计量学工具, 并被广泛应用在油脂领域[4, 11]。
本研究目的是结合化学计量工具与同步荧光法建立模型, 获取一种简捷的油脂氧化过程检测方法, 实时监控食用油在氧气影响下贮藏过程中的氧化历程, 为油质控制提供理论依据。
OXITEST油脂氧化稳定性测定仪: 意大利VELP公司; Cary Eclipse荧光分光光度计(美国瓦里安有限公司); ZJ-609型冷热双用榨油机(东莞市房太电器有限公司)。
冷榨花生油: 红皮花生(购自本地超市)不经过炒制, 采用微波处理后直接螺旋压榨制取; 热榨花生油: 直接购自市场粮油店; 乙醚、 三氯甲烷、 冰乙酸: 国药集团化学试剂有限公司; 超纯水: 实验室超纯水机制取(UP300-E UAF, 上海和泰仪器有限公司)。
1.2.1 花生油加速氧化试验
通过OXITEST油脂氧化测定仪测定花生油90 ℃下氧化曲线。 称取5.0 g样品置于托盘中, 空气流量为 6 bar, 达到设定温度后开始测定。 设定加热温度90 ℃, 测定氧化诱导期(induction period, IP), 采集不同氧化时间点的样本三维同步荧光光谱信息和理化指标。
1.2.2 花生油品质指标测定
酸价测定参照GB 5009.229— 2016, 过氧化值测定参照GB 5009.227— 2016。
1.2.3 同步荧光光谱采集
利用荧光分光光度计采集同步荧光光谱数据。 将油样品放置在1 cm的石英比色皿中, 激发和发射狭缝宽度5 nm。 激发波长200~800 nm, Δ λ 10~180 nm, 间隔10 nm, 同步扫射, 绘制荧光强度、 Δ λ 、 激发波长三维图谱显示氧化程度。
1.2.4 数据分析
所有试验重复3次。 三维荧光光谱数据利用平行因子法对数据进行降维信息解析, 对物质组分以及组分类型进行有效识别。 为避免一些缺点, PARAFAC模型组分数N的选择通过残差平方和来进行[4, 11]。 二维荧光光谱数据和氧化指标(过氧化物或酸值)分别作为输入数据和输出数据, 分别按照比例被设计成测试数据, 剩余数据选择作为训练数据, 通过人工神经网络(ANN)建立回归模型。 PARAFAC和ANN方法由Matlab R2010(MathWork, Inc., Natick, MA, USA)软件运行分析。
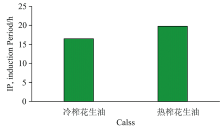
通过测定油脂样品氧化诱导期能快速表明油脂样品的氧化稳定性。 同一环境条件下氧化诱导时间越长说明该油脂氧化稳定性越好, 反之, 油脂样品氧化稳定性越差。 通过VELP型油脂氧化稳定性测定仪器测定90 ℃下花生油氧化诱导期, 结果见图1。 由图1可知, 冷榨花生油的氧化诱导期低于热榨花生油, 表明冷榨花生油对温度较为敏感, 氧化稳定性较热榨花生油差, 更容易被氧化, 主要原因在于热榨花生油中VE含量较高, 而且花生热榨时由于梅拉德反应分解产物产生抗氧化作用, 进一步提高了其氧化稳定性[12, 13]。 热榨方式中花生经过高温焙炒, 可以有效提高油脂的氧化稳定性, 延长货架期[14]。
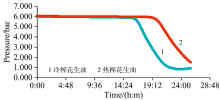
食用油氧化要经过一个诱导期, 该过程反应缓慢, 之后进入反应比较迅速的氧化期, 随后曲线平缓即进入氧化静止期[15]。 OXITEST油脂氧化分析仪主要一般给予样品较高的温度和压力进行加速试验, 曲线平滑的区段称之为诱导期, 是该仪器表征油脂或含油食品最主要的参数。 OXITEST法所配备的软件能够自动处理数据得到诱导期, 图2是不同工艺花生油氧化诱导曲线。 由图2可知, 在自然氧化过程中, 不同工艺花生油在氧气充足条件下氧化初期经历时期较长, 一旦到达诱导期(冷榨花生油为16.5 h, 热榨花生油为19.8 h)后, 快速进入氧化期直至静止期, 油脂彻底变质, 氧化状态趋于稳定。 而随着时间的延长, 冷榨花生油进入氧化期早于热榨花生油, 主要原因在于本实验室冷榨花生油原料红皮花生本身品质和微波处理。 油脂氧化过程理想评价方法是能够提供油脂氧化历程和不同产物变化动态信息, 并具备一定灵敏度和准确度, 且适合于较长时间的固定检测。 由此, 氧化过程中需要同时获取光谱及相关氧化指标, 以便更好地了解氧化过程。
图3主要显示不同工艺下制取花生油的不同氧化历程在激发波长为200~800 nm, Δ λ 为10~180 nm的三维荧光光谱图。 图3表明两种花生油在氧化过程中, 激发波长300~400 nm处的强荧光峰位置红移。 冷榨花生油该处荧光峰在氧化诱导期变弱, 之后逐渐增强, 而热榨花生油该处强荧光峰在氧化诱导期峰宽增加, 之后强荧光区域荧光强度减弱, 峰宽变窄, 且600~700 nm处荧光峰消失。 从图3可知, 冷榨和热榨花生油原油三维荧光图谱存在显著差异。 冷榨花生油原油只有一个荧光峰, 波峰波长在344 nm附近, 该区域主要表征蛋白质、 氨基酸类物质; 而热榨花生油原油有3个荧光峰, 其波峰位置分别在400, 600和670 nm附近, 对应区域分别是生育酚、 色素等具有荧光基团物质和叶绿素a和b。 两者光谱的差异主要是由于原料样品处理及不同工艺引起[16, 17, 18]。 在氧化诱导期, 冷榨花生油波峰位置向长波方向移动, 其荧光强度明显减弱。 热榨花生油在氧化诱导期峰宽变宽, 强度减弱, 而进入氧化期后, 600~700 nm荧光峰消失, 峰位置在420 nm附近, 峰变窄; 进入静止期后, 峰位置不变, 荧光强度增强。 随着氧化时间增长, 油脂营养物质被分解产生共轭双烯、 醛等小分子氧化产物, 致使荧光光谱产生斯托克位移(Stocks shift), 而且氧化程度越深, 其荧光基团物质含量随之急剧增加, 荧光强度增强[19], 直至进入静止期, 氧化彻底, 油脂彻底腐败, 该结论与图3后期两者光谱图呈现一致性相统一。
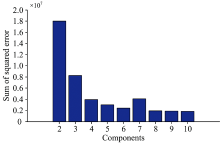
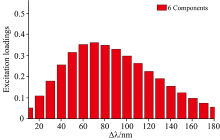
图4为应用平行因子法分析获取不同组分数的残差平方和。 从图4中清晰发现组分数6残差平方和(2.41× 106)比组分数5(3.0× 106)和7(4.06× 106)的残差平方和都要小。 而组分数8, 9和10残差平方和(分别为1.92× 106, 1.85× 106, 1.8× 106)都比组分数6小, 但是通常情况下, 相对较小的组分数比较适合用来作为平行因子分析中成分数的选择。 图5是6组分不同Δ λ 激发波长载荷得分。 从图5中明显看出在Δ λ 为70 nm下载荷得分最高, 因此Δ λ 为70 nm可以作为花生油荧光光谱特征波长。 根据前人的研究证明, 载荷得分与样品浓度相符合, 因此需要降维进行更进一步的分析[20]。
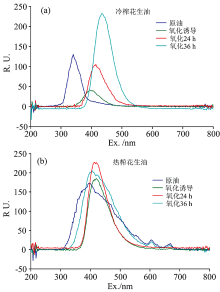
图6(a)和(b)是Δ λ 为70 nm的不同工艺花生油二维荧光光谱图。 不同区域的光谱代表不同的物质组分。 从图6中不难发现, 两种不同工艺下的花生油其荧光物质呈现显著差异。 冷榨花生油仅有一个荧光峰, 在氧化期间荧光光谱区域红移, 氧化时间越长, 现象越明显, 其峰位置分别在340, 394, 416和434 nm附近处, 荧光强度先变弱再逐渐增强; 热榨花生油在氧化初期呈现三个荧光峰, 主荧光峰(300~400 nm处)位置分别在406, 400和420 nm处, 峰宽先增大再减小, 荧光强度先变弱再增强, 而次荧光峰(600~700 nm)在氧化期消失, 与三维荧光光谱图结果相一致。 表明该平行因子模型降维效果很好地反应了油脂不同氧化历程的差异。
通过PARAFAC法获取Δ λ 为70 nm的荧光光谱作为ANN模型输入层, 以氧化过程化学指标酸价或过氧化值作为输出层建立氧化阶段预测模型。 模型相关系数r均接近1.0, 均方根误差均较小, 说明该模型能较好反映油脂氧化过程状态。 本研究结果表明同步荧光光谱结合化学计量学能快速反映花生油氧化进程, 进一步丰富油脂氧化理论, 为形成完整的油脂氧化理论体系提供理论基础, 同时为不同氧化阶段具体物质深入研究提供支持。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|