作者简介: 吴 伟, 1994年生, 浙江海洋大学海洋与渔业研究所硕士研究生 e-mail: 2314311055@qq.com
利用三维荧光光谱法研究了不同pH(3~11)下水溶态(10 μg·L-1)的芘及1-羟基芘、 1-氨基芘、 1-甲基芘、 1-芘甲酸、 1-溴芘和1-硝基芘等6种含取代基多环芳烃(S-PAHs)的荧光光谱特性, 探讨了取代基及溶液pH对7种PAHs的荧光光谱特征的影响规律。 结果表明: 取代基结构对芘环荧光峰及荧光信号存在不同影响, —OH, —NH2, —CH3, —COOH及—Br均可导致芘环激发波长和发射波长产生不同程度红移。 与此同时, 1-羟基芘和1-氨基芘的荧光强度高于芘, 其原因是给电子基团—OH, —CH3可增加芘环上共轭π电子云密度, 进而降低分子基态激发能, 增加分子的荧光效率; 1-硝基芘和1-溴芘上的吸电子基团—NO2及重原子取代基—Br具有强的诱导效应(-I), 致芘环共轭体系中电子云密度降低, 削弱分子的荧光效率; 给电子基团—NH2对芘环荧光强度影响并不明显, 而吸电子基团—COOH小幅度增加芘环荧光效率。 该实验条件下, pH对芘、 1-甲基芘及1-溴芘的荧光峰位置及其荧光强度无显著影响; 1-羟基芘最大荧光峰在pH=11时相比于pH≤9时发生红移, 且荧光强度显著下降。 pH对1-氨基芘和1-芘甲酸荧光光谱特性存在一定的影响, 在pH=3时, —NH2和—COOH发生质子化作用, 使得1-氨基芘和1-芘甲酸荧光峰位置分别较pH≥5时发生蓝移和红移; 1-氨基芘荧光强度在pH=3时略高于pH≥5, 而1-芘甲酸荧光强度在pH=3时则略低于pH≥5。 以上结果对水环境中S-PAHs荧光方法的建立及其原位测定有重要的意义。
In the range of pH at 3~11, the fluorescence spectra of water-soluble (10 μg·L-1) pyrene and substituted polycyclic aromatic hydrocarbons (S-PAHs) including 1-hydroxypyrene, 1-aminopyrene, 1-methylpyrene, 1-pyrenecarboxylic acid, 1-bromopyrene and 1-nitropyrene were measured by three-dimensional fluorescence spectroscopy. The influences of various substituents and solution pH on the fluorescence properties of seven kinds of PAHs were explored. The results showed that the fluorescence peak and fluorescence intensity of the pyrene ring were dependent on the substituent structure. The substituents of —OH, —NH2, —CH3, —COOH, and —Br can cause varying degrees of red shift in the excitation wavelength and emission wavelength of the pyrene ring. Meanwhile, the fluorescence intensities of 1-hydroxypyrene and 1-aminopyrene were higher than those of pyrene, which is mainly because the electron-donating group —OH, —CH3 can increase the conjugated π electron cloud density on the pyrene ring, and then reduce the ground state excitation energy and increase the fluorescence efficiency of the fluorescence molecule. The electron-withdrawing group —NO2 and heavy atom substituent —Br have a strong inductive effect, leading to decrease the electron cloud density on the pyrene ring conjugation system and reduce the fluorescence efficiency of the fluorescence molecule. The electron-donating group —NH2 has no obvious effect on the fluorescence intensity of the pyrene ring, while the electron-withdrawing group —COOH could sluggishly increase the fluorescence efficiency of the pyrene ring. Under this experimental condition, there were no significant effects of pH on the fluorescence peak position and fluorescence intensity of pyrene, 1-methylyrene and 1-bromopyrene. Compared with pH≤9, the maximum fluorescence peak of 1-hydroxypyrene was redshifted at pH=11, and the fluorescence intensity decreases significantly. In addition, the effects of pH on the fluorescence properties of 1-aminopyrene and 1-pyrenecarboxylic acid were also observed clearly. The fluorescence peaks of 1-aminopyrene and 1-pyrenecarboxylic acid were blueshifted and redshifted respectively, owing to the protonation effect at pH=3. The fluorescence intensity of 1-aminopyrene at pH=3 was slightly greater than that of pH≥5, while the fluorescence intensity of 1-pyrenecarboxylic acid at pH=3 was slightly lower than that of pH≥5. These studies are of great significance to the establishment of S-PAHs fluorescence analysis method and in situ determination of S-PAHs in the water environment.
多环芳烃(polycyclic aromatic hydrocarbons, PAHs)是一类典型的持久性有机污染物(persistent organic pollutants, POPs), 因其具有“ 三致” 效应而倍受关注[1]。 含取代基PAHs(substituted PAHs, S-PAHs)是水环境中PAHs重要组成部分, 且S-PAHs较母环PAHs种类更多、 组成更为复杂[2]。 此外, 由于取代基的存在S-PAHs性质不同于其母环PAHs, 并展现出各异的环境行为及毒性效应[3, 4], 通常S-PAHs毒性效应(如致突变性和致癌性)强于其母环PAH[5]。 近来, 水环境中S-PAHs环境行为及生态效应已越来越为科研工作者所关注, 因此与之密切相关的水溶态部分浓度的测定至关重要。
目前, 水环境中S-PAHs分析方法主要以气相色谱-质谱[6]、 液相色谱-质谱[7]为主, 但该法前处理过程繁琐、 耗时、 所需萃取剂易对环境产生二次污染, 且萃取过程破坏了目标化合物在水环境中的原始赋存状态。 荧光法因其快速、 灵敏及非破坏性而被广泛用于水体中母环PAHs的测定[8]。 结合S-PAHs分子中共轭π 键结构可产生荧光的特性, 基于荧光检测S-PAHs的分析方法已开始被重视[9]。 建立适合分析水环境中S-PAHs的荧光法的前提需了解水溶态S-PAHs荧光光谱特性。 然而, 有关不同取代基对PAHs荧光光谱特性的影响研究鲜见报道。 此外, 水环境因素(pH、 温度等)可对荧光峰位置和荧光强度造成干扰, 因此有必要考察水溶液条件对S-PAHs荧光光谱特性的影响。
芘及含取代基的芘衍生物在水环境中常被检出[4, 7, 10], 因此本研究以芘为母环PAHs代表, 以1-氨基芘、 1-硝基芘、 1-甲基芘、 1-羟基芘、 1-溴芘及1-芘甲酸为S-PAHs代表。 利用三维荧光光谱法研究不同pH条件下水溶态PAHs的荧光特性, 分析了各PAHs荧光性质与其分子结构及pH的关系, 以期为水环境中S-PAHs测定和解析提供技术支持。
芘、 1-羟基芘、 1-氨基芘、 1-甲基芘、 1-芘甲酸、 1-溴芘及1-硝基芘均购置Sigma-Aldrich公司, 纯度均大于96%, 使用前未提纯, 由ECOSAR v1.11计算得到7种PAHs的溶解度分别为0.135, 4.045, 2.411, 0.058 38, 0.149, 0.013 38及0.011 8 mg· L-1。 由ACDLAB软件计算得到1-羟基芘、 1-氨基芘及1-芘甲酸的pKa值分别9.4, 3.937及3.676。 乙醇、 NaOH及HCl购置国药, 均为分析纯试剂。
称取适量固体PAHs, 分别配制成50.0 mg· L-1的乙醇储备液, 于4 ℃冰箱中避光保存、 待用。 分别取4 μ L PAHs储备液至含20 mL背景溶液(0.01 mol· L-1 NaCl, pH=3~11)的棕色玻璃瓶中, 摇匀, 静置20 min后进行检测(乙醇加入量为0.02%, 助溶剂效应可忽略)。
利用Cary Eclipse荧光分光光度计(Agilent, 美国)测定PAHs三维荧光光谱。 激发波长(λ ex)范围为220~450 nm, 发射波长(λ em)范围为350~500 nm; 激发、 发射狭缝宽度分别为5和10 nm; 激发、 发射步距均为1 nm; 扫描速度为2 400 nm· min-1; 1-溴芘及1-硝基芘测量PMT电压为800 V, 其余PAHs为600 V。 以Milli-Q水为空白。 样品荧光光谱减去Milli-Q水的荧光光谱以消除拉曼散射的影响, 荧光强度用Raman单位(R.U.)表示。
2.1.1 取代基对荧光峰分布影响规律
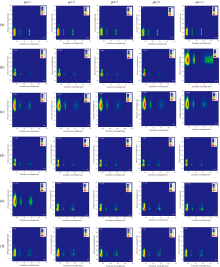
图1(a)— (f)分别展示了芘、 1-羟基芘、 1-氨基芘、 1-甲基芘、 1-芘甲酸和1-溴芘在不同pH条件下三维荧光光谱(1-硝基芘无明显荧光峰, 故未给出荧光谱图)。 可知, 相同pH条件下芘及5种含取代基芘衍生物的荧光峰位置存在相似性, 整体呈现出荧光峰的荧光激发波长位置相近, 这主要由于6种PAHs均具有芘环所致。 同时, 6种PAHs荧光光谱又有显著不同之处, 表明芘环上取代基的结构对其荧光峰位置有不同影响。 如在pH=7时, 芘、 1-羟基芘、 1-氨基芘、 1-甲基芘、 1-芘甲酸和1-溴芘最大荧光峰位置依次分别为λ ex/λ em=238/374 nm, λ ex/λ em=240/386 nm, λ ex/λ em=241/442 nm, λ ex/λ em=240/376 nm, λ ex/λ em=241/381 nm和λ ex/λ em=240/379 nm, 表明— OH, — NH2, — CH3, — COOH及— Br均可导致芘环激发和发射波长产生不同程度红移, 其中激发波长红移2~3 nm, 发射波长红移2~68 nm。 王碧等[11]研究结果显示苯酚、 苯胺、 甲苯、 氯苯同样均较苯的荧光光谱发生红移。 这主要是助色团(— OH, — NH2, — CH3, — Br)和生色团(— COOH)增加了芘环的生色能力, 使其吸收波长向长波方向移动, 进而导致荧光光谱红移。 此外, 1-氨基芘仅有一个发射峰, 与其他5种PAHs荧光峰存在显著差异。
2.1.2 pH对荧光峰分布影响规律
溶液pH可影响具有弱酸或弱碱性的荧光物质的电荷状态, 进而改变荧光物质的基态与激发态之间的能级间隔, 从而导致荧光光谱性质发生变化。 由图1可知, 不同pH下芘、 1-甲基芘及1-溴芘的荧光峰位置无显著变化, 表明pH对这3种PAHs的荧光峰位置无干扰。 1-羟基芘荧光光谱峰位置在pH≤ 9与pH=11时明显不同, 其在pH≤ 9与pH=11时最大荧光峰位置分别为λ ex/λ em=240/386 nm和λ ex/λ em=242/450 nm, 即荧光光谱在pH=11较pH≤ 9时发生明显红移, 且发射峰位置由二个变为一个[图1(b)]。 这主要是由于1-羟基芘负离子与其分子态相比, 增加了未成键电子, 更有利环上π 电子共轭, 因而在pH=11时光谱发生红移。 1-氨基芘在pH=3时, 其最大激发波长比其在pH≥ 5时短3 nm, 表明— NH2的质子化作用, 导致光谱发生蓝移。 1-芘甲酸荧光光谱峰位置在pH=3和pH≥ 5时存在显著差异, 其在pH=3和pH≥ 5时最大荧光峰位置分别为λ ex/λ em=241/413 nm和λ ex/λ em=241/381 nm, 即荧光光谱在pH≥ 5较pH=3时发生明显蓝移, 且发射峰位置由一个变为二个[图1(e)], 这主要是由于羧基的质子离解作用, 引起光谱向短波方向移动。
2.2.1 取代基对荧光峰强度影响规律
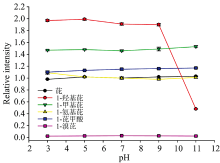
图2展示了6种PAHs(10 μ g· L-1)在不同pH下荧光强度变化趋势(以芘在pH=7时荧光强度做归一化处理)。 由图2可知, 取代基对PAHs荧光强度存在显著影响。 当pH=7时, 1-羟基芘、 1-甲基芘荧光信号强于芘, 与苯酚和甲苯的荧光信号高于苯的变化一致, 这主要是由于— OH和— CH3为给电子基团, 可增加芘环上共轭π 电子云密度, 进而降低分子基态激发能, 增加分子的荧光效率[11]。 此外, 对1-羟基芘而言, 水作为氢键受体溶剂[图3(a)], 有利于— OH上的非键孤对电子与芘环间的激发态电荷转移作用, 导致荧光光谱向长波方向移动。 — NH2为强给电子基团, 但1-氨基芘荧光强度与芘相近, 可归因于1-氨基芘与水形成氢键, 且水作为氢键供体[图3(b)], 抑制了— NH2上非键孤对电子与芘环间的激发态电荷转移作用, 进而未能增强其荧光强度。 — NO2属于吸电子基团, 由于吸电子基的诱导效应(-I), 致芘环共轭体系中电子云密度降低, 削弱分子的荧光效率, 因此在本实验条件下1-硝基芘无明显荧光信号。 王碧等[11]发现硝基苯在10 mg· L-1浓度范围内未有明显的荧光峰, 其认为— NO2可降低苯环的荧光特性是由于硝基苯的n→
 | 图2 PAHs在不同pH条件下相对荧光强度Fig.2 The relative fluorescence intensity of PAHs under different pH conditions |
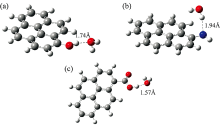 | 图3 (a)1-羟基芘、 (b)1-氨基芘和(c)1-芘甲酸与水结合的复合物结构Fig.3 The complex structure of (a) 1-Hydroxypyrene, (b) 1-Aminopyrene and (c) 1-Pyrenecarboxylic acid with water |
1-羟基芘、 1-氨基芘和1-芘甲酸与水之间的氢键的几何优化、 振动频率和单点能均由密度泛函理论(density functional theory, DFT)计算获得。 其中, 几何优化和振动分析在M06-2X/def2-SVP水平下进行, 并通过SMD溶剂化模型考虑水的溶剂化作用; 单点能计算在M06-2X/def2-TZVP下完成[12, 13, 14]。 DFT计算用Gaussian9.0软件完成。 1-羟基芘、 1-氨基芘和1-芘甲酸与水之间的氢键键长分别为1.74, 1.94和1.57 Å , 键能分别为-8.8, -5.2和-5.4 kcal· mol-1。
2.2.2 pH对荧光峰强度影响规律
由图2可知, 相同浓度下芘及1-甲基芘的荧光强度在pH为3~11时波动较小, 表明pH对两者的荧光强度无显著影响。 1-羟基芘在pH为3~9时, 荧光强度高且稳定; 而在pH为11时, 其荧光信号急剧下降, 与pH对苯酚荧光强度的影响一致, 这主要由于在该pH条件下1-羟基芘分子发生了离解反应形成了离子态, 表明— OH的结构形态是影响1-羟基芘和苯酚荧光特性的重要因素。 1-氨基芘荧光信号在 pH为5~11时略低于pH=3时, 而1-芘甲酸在pH为5~11时略高于其在pH为3时的荧光信号。 此外, 已有研究表明苯胺在pH< 4时, 几乎无荧光; 在pH为6~8时, 有较强荧光信号; 当pH> 8时, 其荧光强度逐渐减小[15]。 综上, pH对含不同取代基荧光物质荧光特性的影响不仅与取代基有关, 还与其母体结构有关。
水溶态芘衍生物荧光光谱特性与其取代基结构及溶液pH有关。 — OH, — CH3, — NH2, — COOH及— Br均使得芘环荧光峰位置发生不同程度的红移; 给电子基团— OH, — CH3可增强芘环分子的荧光效率, 但给电子基团— NH2对芘环荧光强度影响并不明显; 吸电子基团— NO2及与重原子取代基— Br可降低芘环分子的荧光效率, 但吸电子基团— COOH可小幅度增加芘环分子的荧光效率。 pH在3~11范围内其对芘、 1-甲基芘及1-溴芘的荧光峰位置及荧光强度无显著影响; 在pH=11时, 1-羟基芘分子发生离解反应形成了离子态, 使得其荧光峰红移, 且荧光强度显著下降。 1-氨基芘和1-芘甲酸上的— NH2和— COOH在pH=3条件下发生质子化作用, 使得1-氨基芘和1-芘甲酸荧光峰分别较pH≥ 5时发生蓝移和红移; 1-氨基芘荧光强度在pH=3时略高于pH≥ 5, 而1-芘甲酸荧光强度在pH=3时略低于pH≥ 5。 未来工作中, 我们还需关注取代基对不同母环PAHs荧光光谱特性影响规律, 可为PAHs原位荧光检测方法的建立提供重要基础依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|