作者简介: 李 庆, 1980年生, 成都中医药大学、 食品药品检验研究院在读博士研究生 e-mail: liqqin2001@outlook.com
利用云端-互联便携式近红外技术结合化学计量学对名贵药材西红花与其常见伪品(红花、 玉米须、 莲须、 菊花、 纸浆)和掺伪品进行现场快速真伪鉴别及掺伪量的定量预测。 用移动手机控制的PV500R-I便携式近红外仪采集西红花与其伪品和掺伪品光谱数据。 对原始光谱数据进行一阶导, 二阶导, 三阶导, 标准正态变量转换和光散射校正前处理。 采用偏最小二乘判别分析分步建立西红花与其伪品、 西红花与其掺伪品鉴别模型。 结果表明, 一个最优模型可将西红花与其五类伪品彼此完全区分; 两个最优模型分步区分西红花与其五类掺伪品, 外部预测准确率最低为93%, 西红花掺入红花、 玉米须、 莲须、 菊花和纸浆的识别水平分别为0.5%, 0.5%, 4.0%, 0.5%和0.5%。 采用偏最小二乘回归对五类西红花掺伪品的掺伪量建立定量预测模型, 五个最优模型的外部预测相关系数范围为0.920~0.999, RMSEP范围为0.005~0.044, 当西红花掺入红花、 菊花、 莲须、 纸浆和玉米须的掺伪量大于8%时, 其外部预测相对误差分别低于8%, 8%, 3%, 10%和5%, 表明最终模型能较好地预测西红花掺伪品的掺伪量。 基于云端-互联便携式近红外光谱技术所建立的西红花真伪鉴别方法和掺伪品掺伪量预测方法快速准确, 经济环保, 能满足西红花现场快速无损伤真伪鉴别要求。
The use of cloud-connected infrared spectroscopy technology combined with chemometrics to identify the rarest saffron and its commonly encountered adulterants (carthami flos, corn silk, nelumbinis stamen, chrysanthemi flos, pulp) and adulterated saffron, and quantitative determination of adulterant in saffron. Near-infrared spectra of saffron, adulterants, and adulterated saffron were collected by using the PV500R-I portable near-infrared instrument controlled by mobile phone. The first derivative, second derivative, third derivative, standard normal variable transformation and multiplicative scatter correction are used to preprocess the original spectral data. Partial Least Squares Discrimination Analysis was used to establish the identification model of saffron and its adulterant, and saffron and adulterated saffron. The results show that an optimal recognition model can distinguish saffron and its five kinds of adulterant from each other completely; the lowest 93% external prediction accuracy of saffron and five kinds of samples of adulterated saffron can be achieved step-by-step by two optimal recognition models, and the adulteration recognition level of saffron mixed with carthami flos, corn silk, nelumbinis stamen, chrysanthemi flos and pulp are 0.5%, 0.5%, 4.0%, 0.5% and 0.5%, respectively. Partial least squares regression was used to establish quantitative prediction models for the five kinds adulterant in saffron. The external prediction correlation coefficient range of the final model was 0.920~0.999, and RMSEP range was 0.005~0.044, and when the saffron mixed with carthami flos, chrysanthemi flos, nelumbinis stamen, pulp and corn silk are more than 8%, its external prediction relative error is less than 8%, 8%, 3%, 10% and 5% respectively, which indicated that the quantitative prediction model could be used to predict the amount of adulterant in saffron. To sum up, the identification method based on cloud connected portable near-infrared spectroscopy and the prediction method of the amount of adulterant is fast and accurate, economic and environmental protection, and can meet the requirements of quick and non-destructive identification of saffron on site.
西红花为鸢尾科植物番红花Crocus sativus L.的干燥柱头, 具有活血化瘀、 凉血解毒、 解郁安神的功效[1]。 西红花是一种名贵中药材, 近年来, 存在较多的易混淆品和相似物染色后掺入西红花或冒充西红花销售[2, 3, 4], 国内常见的西红花伪品主要有红花、 菊花、 莲须、 玉米须、 线状纸浆[2]。 目前其真伪鉴别方法主要包括显色反应[5]、 薄层色谱法[5]、 紫外分光光度法[6]、 高效液相色谱法[5, 7]、 质谱法[6]和分子标记技术[8]。 现有的真伪鉴别方法存在前处理繁杂、 使用有机溶剂、 破坏样品、 不能现场检验、 检验成本高等弊端。 急需开发一种经济、 环保、 无损伤样品的现场快检方法。
利用近红外光谱技术对西红花与其伪品进行鉴别的研究文献少见, 目前仅见Eman Shawky等利用台式近红外仪分析西红花与其国外常见伪品的报道[3], 尚未见利用该技术分析国内常见西红花伪品菊花、 玉米须、 莲须、 线状纸浆的报道。 云端-互联的便携式近红外技术是通过手机蓝牙将可随身携带的便携式近红外光谱仪与云端大数据相关联, 与台式近红外技术相比, 操作更加简单快速, 可用于现场快检, 因此研究中尝试利用该技术构建西红花与其国内常见伪品的定性鉴别和掺伪量的定量测定方法, 以期为西红花提供一种新的不损伤样品的现场快检方法。
共收集60份西红花样品, 其详细信息见表1, 所有样品经成都中医药大学严铸云教授鉴定西红花Croci stigma为正品; 红花、 菊花、 莲须、 玉米须和线状纸浆样品详细信息同样见附录表1。 西红花和常见染色伪品见附录图1。
| 表1 西红花及其伪品的来源和数量信息 Table 1 The source and number information of saffron and its adulterants |
 | 图1 云端-互联PV500R-I便携式近红外仪主要工作示意图Fig.1 Main work diagram of cloud connected PV500R-I portable near infrared spectrometer |
掺伪品制作: 在西红花中按质量比掺入伪品, 掺入百分比范围为: 0.5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 20%, 30%, 40%和50%, 共15份, 平行制备两份, 一份为训练集, 一份为测试集。
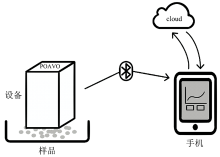
云端-互联便携式近红外光谱系统主要由三部分构成: (1) 无线PV500R-I便携式近红外仪(长虹科技有限公司, 中国), 性能参数: 长宽高为110 mm× 70 mm× 70 mm; 重量为400 g; 光谱分辨率: 20 nm; 波长重复性为± 2 nm; 超大光斑70 mm× 70 mm。 (2) 移动手机。 (3) 云端数据库。 其工作示意图见图1, 便携式近红外光谱仪通过蓝牙与移动手机连接, 将扫描的样品光谱数据经移动手机上传至云端, 在云端通过已建立的预测模型快速计算未知样本类别或含量, 并将结果迅速反馈至手机端。
便携式近红外光谱仪经校正后, 将仪器直接贴于样品表面, 在1 350~1 850 nm波长范围内采集光谱图。 每个样品重复测定6次, 求平均光谱用于建模。
为使模型稳健, Kennard-Stone selection algorithm[9]用于选择训练集(三分之二的样本量)和预测集(三分之一的样本量)。 由于各类别样本量有一定差异, 为避免产生更大的不平衡样本, 先对每类样本选择训练集和预测集, 后将所有类别样本的训练集和预测集各自相加, 得到最后的训练集和预测集。
标准正态变量转换(standard normal variable transformation, SNV)和光散射校正(multiplicative scatter correction, MSC)是散射校正前处理技术, 常用于消除颗粒分布不均匀和粒径散射造成的影响, 同时也可消除光谱扫描时样品引起的光谱平移和随机噪声的影响, 从而提高模型预测能力[10]。 采用一、 二、 三阶导数滤波器提高光谱分辨率, 消除原始红外光谱中的基线漂移和背景[11]。
在全波段(1 350~1 850 nm)条件下, 利用偏最小二乘判别分析(PLS-DA)建立西红花与其常见伪品的真伪鉴别模型。 用7折交叉验证的交叉验证均方根误差(RMSECV)的最小值确定最适隐变量数(LVs)。 最优模型选取原则: R2X, R2Y, Q2[12], 内部预测准确率和外部预测准确率的值越大, 模型性能越好。 使用Simca(version 13.0, Umetrics, Sweden)软件完成PLS-DA模型的建立。
在全波段条件下, 建立五种西红花掺伪品掺入量的偏最小二乘回归(PLSR)定量预测模型。 根据变量与模型性能相关的回归系数大小, 选择最适回归系数及相应的重要波段对模型性能进行改进。 模型评价指标包括: 决定系数(R2), 均方根误差(RMSE), RMSECV, 预测均方根误差(RMSEP), R2越大, RMSE, RMSECV和RMSEP越小, 同时RMSECV与RMSEP之间差异越小, 表明模型性能越好。 使用Unscrambler (version 7.5, CAMO ASA, Norway)软件完成PLSR模型的建立。
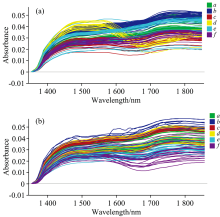
图2(a)和(b)分别是西红花与其伪品, 西红花与其掺伪品在1 350~1 850 nm范围内的原始光谱图。 该光谱范围为C— H, O— H, N— H等基团伸缩振动的一级倍频区域[13]。 直观上看, 西红花与其伪品之间的光谱存在一定交叉, 但各自有集中分布范围, 由上至下依次为红花、 莲须、 西红花、 菊花或玉米须, 表明西红花与伪品之间的原始光谱之间彼此存在一定差异, 这主要是由于各自的成分组成不一致导致。 比较特殊的是纸浆的近红外光谱图(黄色曲线), 其光谱曲线在1 560~1 660 nm范围有一个突降的过程, 产生原因可能是由于纸浆为工业产品, 其成分与其他植物源样品差异明显。 西红花与其伪品的光谱特点为西红花鉴别和定量分析提供了光谱基础。 西红花与其掺伪品在光谱图上同样存在各自的集中区域, 由上至下依次为红花、 玉米须或西红花或纸浆、 莲须、 菊花的近红外光谱, 但由于西红花在掺伪品中占比较大, 各类间的光谱曲线彼此重叠更加严重。
建模过程中发现同时有效区分西红花与其伪品和掺伪品十分困难, 因此, 分步为西红花与其伪品, 西红花与其掺伪品建立2个以上的识别模型。
2.2.1 西红花与其伪品识别模型
在全波段条件下, 用西红花与其伪品的原始数据和经五种数据处理方法(一阶导, 二阶导, 三阶导, MSC, SNV)处理后的数据建立六个PLS-DA模型, 其结果见表2, 图3, 附录表1和附录表2。 由附录表1和表2可知, 原始数据所建立的模型性能最优(R2X=1, R2Y=0.841, Q2=0.733, LV=13), 其对训练集和测试集的预测准确率均为100%, 而数据经前处理后所建立的模型并未改善, 这可能是光谱预处理时虽然降低了噪音, 提高了信噪比, 但也丢失了更为重要的信息。 附录表2为最优模型外部预测误分类表, 可知六类样本彼此间均能100%区分。 图3(a)为主成分1和2绘制的二维得分图, 可知主成分1对西红花、 纸浆、 红花彼此之间的准确区分起主要作用, 且纸浆与其他五类样本均能明显区分, 而主成分2对红花与玉米须, 红花与菊花之间的准确区分起主要作用。 同样, 由图3(a), (c)和(d)可知, 莲须与西红花、 玉米须与菊花、 红花与莲须均能有效区分。 图3(e)为模型的置换检验结果(R2=0.105, Q2=-0.341), 可知所有的蓝色Q2值均处于绿色R2值的下方, 表明模型可靠[3]。
| 表2 在全波段条件下, 西红花与其伪品, 西红花与其掺伪品, 三类西红花掺伪品的最优PLS-DA模型结果, 详细结果见附录表1 Table 2 The best PLS-DA model results of saffron and its adulterants, saffron and its adulterated saffron, three kinds of adulterated saffron under the condition of full-spectra. Detailed results can be seen in table 1 of Supplementary Material |
2.2.2 西红花与其掺伪品识别模型
用上述同样方法建立西红花与其掺伪品的六个PLS-DA模型, 结果见表2、 附录图2、 附录表1和附录表2。 附录表1和表录2表明原始数据所建立的识别模型最优(R2X=1, R2Y=0.739, Q2=0.527, LV=17), 其对训练集和测试集的预测准确率为分别为91%和89%。 置换检验结果(R2=0.237, Q2=-0.663)[见附录图2(d)]表明模型可靠。 分析附录表2可知, 除莲须掺伪品外, 模型能同时将其他四类掺伪品与西红花完全区分, 附录图2(a)表明主成分1与主成分2可将西红花与玉米须和纸浆完全区分, 附录图2(c)表明主成分1和主成分4可将西红花与菊花和红花完全区分, 表明四种西红花掺伪品的掺伪量识别水平可低至0.5%, 低于文献掺伪量识别最低水平(1%或5%)[3, 4]。 莲须有四个掺伪量低的样品误判为西红花[见附录图2(c)和附录表3], 其识别水平为4%。 附录图2(b)和附表2表明玉米须与纸浆之间可完全区分, 玉米须和纸浆掺伪品两者识别率高于93%, 且其他三类掺伪品未与两者相混淆, 表明特异性高。 但红花和莲须掺伪品之间互有误判, 两者的识别率分别为80%和60%。 另外, 尽管菊花掺伪品的识别率为100%, 但有三个其他掺伪品误判为菊花, 在五类掺伪品中, 除莲须外, 菊花的特异性最差。
进一步为菊花、 红花和莲须三类西红花掺伪品建立识别模型。 结果见表2、 附录图3、 附录表1和附录表2。 由附录表1和表2可知, 原始数据建立的模型最优(R2X=1, R2Y=0.632, Q2=0.554, LV=5), 其对训练集和测试集的预测准确率分别为98%和96%, 错误分类表(见附录表2)表明3类掺伪品的识别率均在93%以上。 附录图3(a)表明菊花掺伪品能与红花和莲须完全区分, 附录图3(b)表明有一个莲须掺伪品误判为红花, 与附录表2中的结果一致。置换检验结果(R2=0.116, Q2=-0.302)[见附录图3(c)]表明模型可靠。
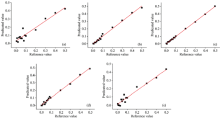
在全波段条件下, 对红花、 菊花、 莲须、 玉米须和纸浆五种西红花掺伪品掺伪量的原始数据和经五种数据前处理方法处理后的数据各建立六个PLSR定量预测模型, 其结果见表3、 图4和附录表3。 由附录表3和表3可知, 仅红花的最优模型为原始光谱数据提供, 其预测集R2为0.920, RMSEP为0.044。 其他四类掺伪品掺伪量的最优定量模型均由一阶导或二阶导提供, 其预测集R2均高于0.924, RMSEP低于0.041, 表明原始光谱数据经一阶导或二阶导前处理后, 更易获得最优模型。 同时, 模型的RMSECV值与RMSEP值之间差异较小, 表明五个模型可靠, 不存在过拟合。 图4表明五类西红花掺伪品外部预测集的掺伪量参考值和预测值所对应的点均匀分布于外部预测曲线两侧, 但当掺伪量范围低于9%时, 红花、 纸浆、 菊花、 玉米须和莲须的预测值与真实值相对误差分别高达372%, 203%, 61%, 42%和23%, 表明模型不适合预测掺伪量低的掺伪品; 当掺伪品掺伪量大于8%时, 红花、 菊花、 莲须、 纸浆和玉米须的相对误差分别低于8%, 8%, 3%, 10%和5%, 表明模型对五类掺伪品掺伪量能较好或很好的预测。
| 表3 在全波段条件下, 红花、 菊花、 莲须、 纸浆、 玉米须五类西红花掺伪品的掺伪量的最优PLSR定量预测模型结果, 详细结果见附录表3 Table 3 The best PLSR quantitative prediction model results of five kinds of adulterated saffron, i.e. carthami flos, chrysanthemi flos, nelumbinis stamen, pulp, corn silk, under the condition of full-spectra. Detailed results can be seen in table 3 of Supplementary Material |
从全波段中选取重要变量建模通常能改善模型性能, 但仅红花掺伪品掺伪量的最优定量模型通过筛选重要变量, 其模型性能稍有改善, 其他四类的定量模型经变量筛选后所得模型性能反而变差, 原因可能是: (1)筛选的重要变量缺乏代表性, 一些次要变量在建模过程中同样不可或缺; (2)样品成分复杂, 导致一些重要特征变量被掩盖; (3)便携式近红外仪波段较窄(1 350~1 850 nm), 缺失了其他特征区, 如组合频区。 附录图4(a)为红花的变量与模型性能之间的回归系数图, 可知以± 0.01为界, 其重要变量为1 350~1 057, 1 383~1 398, 1 653~1 749和1 797~1 850 nm, 其模型性能(RMSECV=0.043, RMSEP=0.043)较原始模型(RMSECV=0.045, RMSEP=0.044)略有改善。
应用云端-互联PV500R-I便携式近红外光谱技术结合化学计量学, 建立一个最优PLS-DA模型能将西红花与其伪品完全区分; 两个最优PLS-DA模型可使西红花与其掺伪品预测准确率高于93%, 掺伪量识别水平低至0.5%~4%; 为五类掺伪品掺伪量建立的五个最优PLSR定量预测模型, 其外部预测相关系数范围为0.920~0.999, RMSEP范围为0.005~0.044, 当掺伪量大于8%时, 定量预测模型能较好或很好地预测掺伪品掺伪量。 基于云端-互联便携式近红外光谱技术建立的西红花真伪鉴别和掺伪量定量预测方法具有较好的准确性和可靠性, 与常用的台式近红外技术相比, 该技术将云端(大数据)-移动手机-便携式近红外仪一体化, 可使样品测试和数据分析接近同步完成, 操作更加智能化, 且可用于现场快检, 这也为其他名贵中药材的快速无损伤检验提供参考。
| 表1 在全波段条件下, 使用原始数据和经5种不同的数据前处理所得数据建立的西红花与其伪品, 西红花与其掺伪品, 3类西红花掺伪品的真伪鉴别PLS-DA模型结果, 黑体字表示最优模型 Table 1 PLS-DA model results of saffron and its adulterants, saffron and its adulterated saffron, three kinds of adulterated saffron developed using original data and datas obtained by five different data preprocessing under the condition of full-spectra. Bold characters represent the optimal model |
| 表2 西红花与其伪品, 西红花与其掺伪品, 三类西红花掺伪品的最优PLS-DA模型的误分类表 Table 2 The misclassfication table of best PLS-DA model results of saffron and its adulterants, saffron and its adulterated saffron, three kinds of adulterated saffron |
| 表3 在全波段条件下, 使用原始数据和经5种不同的数据前处理所得数据建立的红花、菊花、莲须、纸浆、玉米须五类西红花掺伪品的掺伪量的PLSR定量预测模型结果, 黑体字表示最优模型 Table 3 The PLSR quantitative prediction model results of five kinds of adulterated saffron, i.e. carthami flos, chrysanthemi flos, nelumbinis stamen, pulp, corn silk, were developed using original data and datas obtained by five different data preprocessing under the condition of full-spectra. Bold characters represent the optimal model |
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|