作者简介: 盛振扉, 1994年生, 福建师范大学光电与信息工程学院硕士研究生 e-mail: 908527886@qq.com
TeO2非共线声光可调滤波器(AOTF)是一种优良的电调谐分光器件, 具有体积小巧、 稳定性高、 调谐快速、 可实现便携等优点, 在超光谱成像领域具有很高的应用价值。 通过非共线AOTF与光学倒置显微镜有机结合, 建立了声光滤波超光谱显微成像系统; 在可见光范围内, 开展了人体皮肤鳞状细胞癌组织的超光谱显微成像实验研究, 获得了一系列不同衍射光中心波长下的皮肤鳞状细胞癌组织的光谱和对应的显微图像。 系统性能检测实验结果显示, 在超声频率为110~180 MHz范围内的衍射光带宽仅为1.28~2.84 nm, 表明本研究中的AOTF具有很高的光谱分辨率, 达到102个光谱通道量级, 完全可以满足超光谱显微成像对生物组织结构进行精确识别的需要。 本系统采用高质量的TeO2晶体、 双胶合透镜以及优化的射频驱动源, 有效地抑制了衍射光光谱的旁瓣。 分析了超声频率与衍射光中心波长的调谐关系, 以及超声频率与对应衍射光谱带宽的关系曲线, 实验结果与理论计算结果有着较好的一致性。 系统实验获得的皮肤鳞状细胞癌组织显微图像随光波长漂移不显著, 表明超光谱成像系统的图像稳定性高。 通过对比, 分析了不同中心衍射光下的皮肤鳞状细胞癌组织显微图像的清晰度随光波长的变化规律, 在522.52 nm时, 皮肤鳞状细胞癌组织内部各精细结构区分明显, 图像最为清晰。 通过定义透射差异系数, 分析了图像整体亮度曲线和透射差异系数随光波长变化曲线, 其变化规律与直观观察结果相符合; 对皮肤鳞状细胞癌组织图像进行了边缘提取分析, 得出在497.87~551.29 nm内, 可在整体视野较为明亮的情况下对皮肤鳞状细胞癌组织进行观察和研究, 在509.69~527.59 nm范围内, 组织边缘明亮清晰且完整, 是进行皮肤鳞状细胞癌组织结构精确识别与分析的最佳窗口。 该研究为人体皮肤鳞状细胞癌组织结构简便、 灵活、 快速地检测与识别提供了一种新方法。
Noncollinear acousto-optic tunable filter (AOTF) based on TeO2 is a type of good light splitting device with the electric tuning. Because of its advantages of compact size, high stability, fast tuning, and being easy to carry out, it has high practical application value in hyperspectral imaging field. In this study, a hyperspectral microscopic imaging system was built by combining noncollinear AOTF with optical inverted microscope. In the range of visible light, the hyperspectral imaging of cutaneous squamous cell carcinoma was studied, and the spectra and the corresponding microscopic images at a series of optical central wavelengths were got. The performance of the hyperspectral imaging system was tested. The results shown that the bandwidth of the diffracted light in the range of 110~180 MHz was only 1.28~2.84 nm, which indicated that the AOTF in this study had a high spectral resolution with more than 102 spectral channels, and it could meet the needs of hyperspectral microscopic imaging and accurate identification of biological tissue structure. The system used higher quality TeO2 crystal, higher quality double balsaming lens and optimized RF driver to effectively depress the sidelobe of the diffraction spectrum. The tuning relationship between the acoustic frequency and the diffracted optical wavelength, and the relationship between the spectral bandwidth and the acoustic frequency were analyzed. The experimental results were in good agreement with the related the theoretical calculation. The experimental results shown the high image quality of the system because no obvious image shift with the optical wavelength was observed. By comparing the microscopic images of the cutaneous squamous cell carcinoma with different diffraction central wavelengths, the images were also the clearest at 522.52 nm, and the details of the cutaneous squamous cell carcinoma could be distinguished obviously. The difference of the whole brightness and the transmission difference coefficient with the optical wavelength were studied, and the regulations were agreed with the intuitive observation. Through the analysis of the image edge extraction, the results shown that 497.87~551.29 nm can be used to observe and study the cutaneous squamous cell carcinoma with a bright whole field of vision, meanwhile, the results also shown that 509.69~527.59 nm was the best window for accurate identification and analysis of cutaneous squamous cell carcinoma. This study provided a new method for the simple, flexible and rapid detection and diagnosis of human cutaneous squamous cell carcinoma.
声光可调谐滤波器(AOTF)作为一种新型的分光器件, 相较传统的分光器件具有体积小、 全固态构造、 稳定性高、 调谐范围宽、 调谐速度快、 再现性好、 光谱分辨率高等一系列优点。 AOTF的工作原理主要是基于各向异性双折射晶体的反常Bragg衍射效应[1]; AOTF主要由声光晶体及键合在其上的压电换能器构成, 加载到压电换能器上的电信号被转换成相同频率的超声波, 并在晶体中与入射光产生非线性效应; 在满足Bragg衍射条件时, 入射光发生Bragg衍射, 衍射光中心波长与驱动电信号频率为一一对应关系, 故通过改变驱动电信号频率即可实现衍射光中心波长的改变, 达到可调谐滤波的目的。
光谱成像是一种同时具备光谱分辨和空间分辨能力的图像采集与分析技术, 可实现在不同领域对不同对象进行全面且细致的研究。 生物医学作为光谱成像技术的重要应用领域之一, 依托于AOTF较高的光谱分辨率, 可实现对生物组织的声光滤波超光谱显微成像, 快速、 无损地进行基于组织内部成分的光谱分析与图像分析, 对于辅助检测生物组织的生理、 病理状态具有重要科学意义[1, 2, 3, 4, 5]。
皮肤鳞状细胞癌是一种常见的非黑色素瘤皮肤癌, 其发病率日益升高, 逐渐引起医学家及学者们的关注; 随着环境恶化导致的地表紫外线辐射量升高, 使得皮肤鳞状细胞癌的发病率陡然增长, 故进一步研究该疾病的快速无损检测及分析等技术显得尤为关键。
本研究利用非共线AOTF与光学倒置显微镜搭建超光谱显微成像系统, 在可见光波段内大量采集了对非染色皮肤鳞状细胞癌切片进行声光滤波后的准单色光谱及对应显微成像信息, 本研究旨在为皮肤鳞状细胞癌的快速光学检测与诊断提供一种有力的技术手段。
TeO2是一种典型的反常声光器件所使用的声光晶体, 在其内部, 沿[110]方向传播的超声波是纯切变波, 声速非常慢, 仅为0.613× 103 m· s-1; 评价声光相互作用工作模式优良与否的声光优值与声速的三次方成反比, 故TeO2声光优值相当大, 衍射效率也较高[3]。
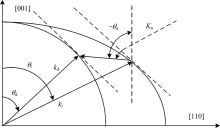
在非共线的情况下, 声光相互作用发生在晶体[1
在式(1)中, 超声波波速为Va, ni-nd是由声光晶体双折射特性引起的折射率差(ni和nd分别为材料对应入射和衍射光波的折射率), θ i为入射光极角。 从式(1)不难看出, 通过改变超声波频率可以实现对调谐衍射光波长的目的[4, 7]。
将非共线AOTF与光学倒置显微镜相结合, 建立了一套超光谱显微成像系统。 系统的主要器件及光路如图2所示。
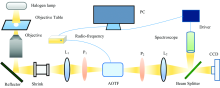 | 图2 基于AOTF的超光谱显微成像系统Fig.2 Experimental setup of the AOTF based microscopic hyperspectral imaging system |
尼康光学倒置显微镜(TE2000-U)顶部的卤素灯作为宽带白光光源, 光线经由载有实验组织切片的载物台, 通过其下方的显微物镜继续向下传播, 而后由底部的反射镜将光线从倒置显微镜中输出; 此时, 通过连续多倍可变透镜将光线进行缩束, 使其通过并由透镜双胶合透镜L1会聚, 后方的偏振片P1其偏振方向与主平面平行, 使得线偏振方向与主平面平行的部分光线得以通过; 光线入射到AOTF并在其中发生反常Bragg衍射, 出射的两条光线中一条为衍射光, 另一条为零级光; 位于AOTF后方的偏振片P2其偏振方向与主平面垂直, 故线偏振方向与主平面平行的零级光被阻挡, 而线偏振方向与主平面垂直的衍射光继续向后传播, 由双胶合透镜L2会聚后, 分束镜BS将其分成两部分, 一部分由Nikon CCD承接进行图像采集, 另一部分则由Avaspec-Mini-VIS光谱仪接收, 以采集实验对象的光谱信息[8, 9]。
为了测试所搭建的超光谱显微成像系统的性能, 在110~180 MHz的超声频率区间内以一定频率间隔对衍射光谱信息进行采集。 当超声频率为120, 130, 140, 150, 160和170 MHz时, 其对应的衍射光光谱如图3所示。 可以看到, 衍射光光谱带宽很窄, 达到了nm级别; 超声频率为170 MHz时, 对应衍射光中心波长为467.11 nm, 其光谱带宽仅为1.48 nm, 这体现出AOTF具有很高的光谱分辨率。 同时, 本系统采用更高质量的TeO2晶体、 高质量的双胶合透镜、 以及优化的射频驱动源, 有效地抑制了衍射光光谱的旁瓣, 进而大幅度减小旁瓣对光谱成像所造成的不利影响, 为实现生物组织结构超光谱显微成像提供有利条件。
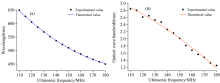
图4给出了在超声频率110~180 MHz区间内的声光滤波超光谱显微成像系统性能曲线。 图4中, 黑色圆点为采集点处的实测数据, 彩色曲线为理论数据生成的调谐关系曲线。 图4(a)为超声频率调谐关系, 实测的超声频率及其对应的衍射光中心波长能够很好地与理论调谐曲线契合。 图4(b)给出了不同超声频率下测得的衍射光谱带宽, 实测数据仍能够较好地符合理论预期; 在110~180 MHz内, 测得的光谱带宽范围为1.28~2.84 nm, 充分反映了该超光谱成像系统良好的光谱分辨性能。 实验发现, 在可见光范围内, 系统可达到102个光谱通道量级, 能够满足对生物组织结构进行精确的识别与成像的需要。
图5(a)— (h)分别给出了非染色皮肤鳞状细胞癌切片的未滤波显微图像以及中心光波长为626.08, 586.25, 551.29, 522.52, 497.87, 476.62和458.26 nm超光谱显微图像(对应的超声频率为115, 125, 135, 145, 155, 165和175 MHz)。 从图5中可以看出, 在不同中心光波长下, 病变部位内部的组织结构清晰可辨, 表明该系统可用于皮肤鳞状细胞癌病变部位结构的细致研究。 此外, 在实验中所采集的超光谱显微图像几乎没有明显的漂移现象, 这表明建立的超光谱显微成像系统具有优异的图像稳定性。
在图5(a)未经过滤波的图像中, 圈定了A作为观察标记区域, B, C, D, E为四个参考区域; 其中, A区域为皮肤鳞状细胞癌已成型合胞体样中的一部分, B区域与E区域均为与A区域毗邻的皮肤鳞状细胞癌已成型癌变胞团, C区域与D区域均为与A区域毗邻的非癌变胞团组织区域。 在图5(b)中, 超声频率为115 MHz, 对应衍射光中心波长为626.08 nm, 各标记区域亮度较高, 但其四周的边界并不明显, 此时仅凭肉眼很难清晰的辨别出各区域的具体形态, 随着超声频率的增加, 对应衍射光中心波长不断减小, 各标记区域的边界开始变得逐渐清晰, 当其超声频率调至145 MHz, 对应衍射光中心波长为522.52 nm时, 如图5(e)所示, 此时各标记区域视野清晰, 可直接凭肉眼观察到其具体的形态。
图6(a)给出了整体观察区域透射光强变化曲线, 可以看出波长在509.69~527.59 nm时, 成像透射光强均处于较强的水平, 且在光波长为522.52 nm附近达到最大值(对应超声频率为145 MHz), 与肉眼观察结果基本吻合, 这表明在522.52 nm中心波长处更有利于对皮肤鳞状细胞癌的整体微观结构形态及样貌进行深入细致的研究。
为了对皮肤鳞状细胞癌在不同衍射光中心波长下的成像结果进行进一步地比对和研究, 分析了标记区域A以及其周围的四个参考区域B, C, D和E的透射强度, 并定义了透射差异系数, 用以分别描述在不同中心波长衍射光下, 四个参考区域相对于相邻标记区域A的透射光强差异大小; 透射差异系数为标记区域A的透射光强与四个参考区域透射光强的差值除以标记区域透射光强数值所得, 具体的透射强度差异系数曲线如图6(b)所示。 从图6(b)中可以看出, B和E区域的透射差异系数整体较低, 且曲线的整体走向趋势较为平缓, 说明B和E区域的透射光强与A区域的透射光强差异较小, 即在同一中心波长衍射光下的成像亮度较为相近。 对于C和D区域, 其透射差异系数整体偏高, 说明C和D区域的透射光强与A区域相比差异较大, C和D区域的透射差异系数曲线分别在512.18和514.71 nm处出现极值, 其位于整体透射光强较高的光波长区间内, 但C和D区域透射光强相对较低; 这说明在整体观察区域亮度较高的情况下, 仍然不易较为准确的界定出C和D组织结构的形态边缘。
图像边缘提取可以更直观地对比非染色皮肤鳞状细胞癌切片在不同中心光波下的显微成像差异, 处理结果如图7(a)— (h)所示。 图7(e)中C和D两个区域在整体视野较为明亮的衍射光波长下, 仍然不能观察到完整的组织图像边缘, 且亮度较低; 图7(h)中, 在整体视野较暗的衍射波长下也几乎很难观察到C和D两区域组织图像的边缘。 图7(e)对应的衍射光中心波长为522.52 nm, 从该图中可以明显的观察到A, B和E三个区域较为明亮的组织图像边缘, 且组织图像的边缘较为完整。 图7(d)和(f)中也可明显地观察到A, B和E三个区域较为完整的组织图像边缘, 但其亮度相对较弱; 除上述三幅图, 在其余的图7(a), (b), (c), (g)和(h)中, A, B和E三个区域均难以观察到完整的组织边缘。 综合图像边缘提取与图像亮度变化分析的结果表明, 衍射光中心波长在497.87~551.29 nm内, 可在整体视野较为明亮的情况下对皮肤鳞状细胞癌进行观察和研究; 在衍射光中心波长为522.52 nm时, 更便于对皮肤鳞状细胞癌的组织结构进行精细观察以及深入识别。
基于优良的分光元器件非共线AOTF建立了一套声光滤波超光谱显微成像系统, 并对非染色皮肤鳞状细胞癌组织切片进行了显微光谱成像研究, 得出如下结论: 自主搭建的声光滤波超光谱显微成像系统具备很高的光谱分辨率和图像稳定性, 能够很好地满足生物组织超光谱显微成像需要; 在实验中获得了超声波频率与衍射光中心波长的调谐关系, 光谱带宽与光波长的关系曲线, 实验结果均与理论预期符合较好。 通过调谐超声波频率, 得到了不同衍射光中心波长下人体皮肤鳞状细胞癌组织的图像, 在各波段范围内图像清晰度较高, 图像稳定; 定义的透射差异系数能够很好地表达人体皮肤鳞状细胞癌组织在不同组织结构上透射光强的差异, 透射差异系数曲线的整体走势与经图像边缘提取分析结果具有良好的一致性; 在497.87~551.29 nm光波长范围内, 可在整体视野较为明亮的情况下对皮肤鳞状细胞癌开展高质量地观察研究; 在522.52 nm, 更便于对皮肤鳞状细胞癌的组织精细结构进行辨别与深入研究。 综上所述, 基于AOTF的声光滤波超光谱显微成像技术可为皮肤鳞状细胞癌及相关疾病的无损快速光学检测与诊断提供一种有效的技术手段。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|