作者简介: 周 琳, 女, 1994年生, 西南科技大学材料科学与工程学院硕士研究生 e-mail: 504326775@qq.com
以暹罗芽孢杆菌为研究对象, 它具有较高的表面积/体积比, 吸附性能良好。 前人关于暹罗芽孢杆菌的研究多集中在它降解纤维素淀粉或抗菌方面, 关于暹罗芽孢杆菌与放射性核素的作用及机制基本未涉及。 利用等离子发射光谱和等离子发射光谱-质谱研究溶液初始pH值、 铀初始浓度、 菌体用量等因素对暹罗芽孢杆菌去除铀的影响及作用过程中菌体释放的生物磷与铀去除的关系; 利用红外光谱和扫描电镜对与铀作用前后的暹罗芽孢杆菌形貌及基团变化进行表征; 利用X射线光电子能谱和扫描电镜能谱分析菌体表面元素分布情况和元素价态, 进而探讨暹罗芽孢杆菌对铀的去除机制。 结果表明, 由于不同pH条件下暹罗芽孢杆菌生长活性、 铀存在形态和磷元素释放量的不同, 其对铀的去除差异很大。 在pH 5.0时, 暹罗芽孢杆菌对铀的去除效果最好。 菌体用量增加有利于暹罗芽孢杆菌对铀的去除。 对实验结果进行Langmuir和Freundlich等温吸附拟合后发现: 暹罗芽孢杆菌对铀的去除行为符合Langmuir等温吸附模型; 铀浓度实验获得的最大吸附量高于理论计算的最大吸附量, 说明暹罗芽孢杆菌对铀的去除可能是物理和化学行为的共同作用。 暹罗芽孢杆菌能够有效去除水体中的铀, 实验获得的最大去除率为96.5%, 最高吸附量为450.3 mg·g-1, 高于大部分已报道的用于吸附铀的芽孢杆菌。 对反应前后菌体的扫描电镜测试发现, 与铀作用后暹罗芽孢杆菌表面出现鳞片状沉淀, X射线光电子能谱和扫描电镜能谱分析表明该沉淀为含磷铀物质。 结合红外光谱分析, 推测暹罗芽孢杆菌去除铀的机制为: 首先, 通过静电作用铀被快速吸引到暹罗芽孢杆菌表面, 随后以配位的形式被菌体上的磷酸基团、 氨基、 羟基、 羧基等活性基团吸附, 同时与菌体释放的含磷酸盐类物质相互作用, 形成含磷铀沉淀而被固定至细菌表面。 在此过程中, 少部分六价铀被菌体释放的胞内物质还原成四价铀而发生沉降。 推测菌体表面沉淀可能为铀的磷酸盐沉淀和含磷化合物与铀的络合物形成的混合物。
In this experiment, Bacillus Siamensis ( B. siamensis) was taken as research object, and B. siamensis had a high ratio of surface area to volume, indicating that B. siamensis has a great performance on adsorbing heavy metals. However, the studies of previous experts and scholars on B. siamensis mostly focused on degradation of starch or cellulose and antifungal activity. And the mechanism of the interaction between B. siamensis and heavy metals or radionuclides was to tally not researched. Therefore, the purposes of this experiment were to use ICP-OES and ICP-MS to study the effects of pH value of solution, initial uranium concentration and biomass on removal of uranium by B. siamensis and the relationship between biological phosphorus released by cells and removal of uranium during the process, FTIR and SEM to characterize the morphology and group changes of B. siamensis before and after interaction with uranium, XPS and EDS to analyze the distribution and valence of elements on the surface of B. siamensis, and then the removal mechanism of uranium by B. siamensis was discussed. The results showed that the removal of uranium by B. siamensis under different pH varied greatly due to the difference of growth activities of B. siamensis, the existence forms of uranium and the amount of phosphorus element released by cells in the process under different pH values conditions. The removal effect was the best at pH=5.0. Increasing the biomass was beneficial to the removal of uranium by B. siamensis. The Langmuir and Freundlich adsorption isotherm models were used to fit the experimental data, and the fitting results showed that the removal behavior of uranium by B. siamensis conformed to the Langmuir isotherm adsorption model. And the maximum adsorption capacity obtained from the initial uranium concentration experiment was higher than the theoretical maximum adsorption capacity calculated from the Langmuir isotherm adsorption model, indicating that the removal of uranium by B. siamensis could be a combination of physical and chemical behavior. B. siamensis could effectively remove uranium from water. The maximum removal rate obtained in this experiment was 96.5% and the maximum adsorption capacity was 450.3 mg·g-1, which were higher than those of most of the Bacillus strains used to adsorb uranium. SEM test of B. siamensis before and after the reaction showed that scale-like precipitate appeared on the surface of the cells after the reaction. XPS and EDS showed that the precipitate was a phosphorus-containing uranium substance. Combined with FTIR analysis, it was presumed that the removal mechanism of uranium by B. siamensis is as follows: Firstly, uranium was rapidly attracted to the surface of B. siamensis through electrostatic action, then adsorbed by phosphate groups, amino groups, hydroxyl groups and carboxyl groups on the bacteria in coordination form, and at the same time interacting with phosphate-containing substances released by the bacteria to form phosphorus-containing precipitation of uranium and then immobilized on the surface of the bacteria. During this process, a part of the hexavalent uranium was reduced to tetravalent uranium by intracellular substances released by the B. siamensis and then settled. It was speculated that the precipitation on the surface of the cell might be the mixture of the phosphate precipitation of uranium and the complexes of phosphorus-containing compounds and uranium complexes.
从20世纪40年代开始, 世界各国就开始着力于核武器和核能发电的研究与开发。 随之而来的是大量核废料的产生, 对环境造成了不可估量的损害, 其化学毒性和放射性严重危害到了人体健康。 铀作为典型的放射性元素和重要的核燃料, 在各种放射性废物中大量存在, 因此, 对它的治理研究具有重要意义。
铀在自然界中主要有四价和六价两种价态。 四价铀一般以矿物的形式在自然界中稳定存在, 六价铀则一般以具有水溶性的铀酰离子形式存在, 具有易迁移性[1]。 因此, 铀对环境的污染主要表现在铀污染水体上。 对含铀废水的传统处理方法有化学沉淀法、 离子交换法、 蒸发浓缩法、 膜分离法和电化学方法等[2, 3], 但这些方法存在成本高、 工艺复杂、 去除效率低和易造成二次污染等问题。 因此, 研究者们将目光投向耗能少且高效的微生物处理方法[4, 5, 6, 7, 8]。
作为自然条件下普遍存在的成分, 高表面积/体积比的微生物可以直接将铀固定在细胞内外, 或者通过改变其周围的微环境如释放磷酸盐物质来间接影响铀的化学行为[9]。 暹罗芽孢杆菌(Bacillus siamensis)为芽孢杆菌属, 是革兰氏阳性菌, 兼性厌氧, 呈棒状; 最适生长温度为37 ℃, 最适pH为6~7[10]。 该菌宽为0.3~0.6 μ m, 长为1.5~3.5 μ m, 有较高的表面积/体积比, 说明其吸附性能良好。 前人对暹罗芽孢杆菌的研究多集中在其降解纤维素淀粉或抗菌方面, 关于暹罗芽孢杆菌与重金属和放射性核素的作用及机制研究基本未涉及。
因此, 选取暹罗芽孢杆菌作为研究对象, 利用ICP-OES和ICP-MS检测分析不同环境条件(初始pH值、 铀初始浓度、 菌体用量)对暹罗芽孢杆菌去除铀的影响及作用过程中菌体释放的生物磷与铀去除的关系; 结合FT-IR, SEM-EDS和XPS技术, 探讨生物磷参与的暹罗芽孢杆菌对铀的去除机制。 本研究将有助于深入理解微生物与铀的相互作用过程及其去除机制, 以期为微生物原位修复铀污染水体的应用提供基础实验数据。
傅里叶变换红外光谱仪(Spectrum One, 美国PE仪器公司)、 电感耦合等离子体发射光谱仪(iCAP6500, 美国Thermo Fisher公司)、 电感耦合等离子体发射光谱仪-质谱仪(Agilent7700x, 美国安捷伦公司)、 X-射线光电子能谱仪(K-ALPHA+, 美国Thermo Fisher公司)、 场发射扫描电子显微镜(Ultra55, 德国蔡司仪器公司)、 振荡培养箱(DQHZ-2001B, 太仓市华美生化仪器厂)、 真空冷冻干燥机器(FreeZone® , 美国Labonco公司)、 精密pH计(PHS-3C, 上海精密科学仪器有限公司)、 电子天平(TP-114, 北京丹佛仪器有限公司)。
暹罗芽孢杆菌, 由西南科技大学生命科学与工程学院陈晓明课题组提供, 硝酸铀酰为分析纯。
称取1.655 5 g的硝酸铀酰加入少量超纯水溶解后, 加入10 mL浓HNO3, 转移至1 000 mL容量瓶中, 用水稀释至刻度线定容即得1 000 mg· L-1的铀储备液, 根据实验需要的浓度进行稀释。 将培养了7 h后一定量的活体暹罗芽孢杆菌加入到装有40 mL铀溶液浓度为c0的锥形瓶中, 放置在恒温振荡培养箱(30 ℃, 150 r· min-1)中反应一定时间后, 离心(8 000 r· min-1, 15 ℃)10 min, 取上清液用ICP-MS测试溶液中的剩余铀浓度; 离心得到的菌体沉淀在-47 ℃下冷冻干燥至恒重, 分别进行FTIR, XPS和XRD测试; 吸取反应前后不同时间段的菌悬液滴于盖玻片上, 自然风干后, 用2.5%的戊二醛固定12 h, 再用乙醇梯度(30%, 50%, 70%, 90%和100%)脱水, 自然晾干后作为SEM试样。
暹罗芽孢杆菌对铀的去除率R(%)和吸附量Q(mg· g-1)可采用式(1)、 式(2)计算, 即
式中, c0为溶液中铀初始浓度(mg· L-1); ct为反应t时刻溶液中铀浓度(mg· L-1); M为暹罗芽孢杆菌用量(g· L-1)。
2.1.1 pH值对暹罗芽孢杆菌去除铀的影响
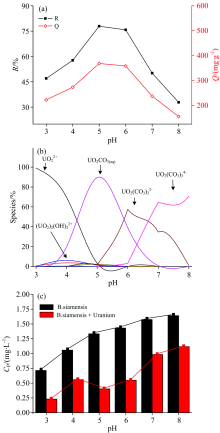
图1(a)给出了不同pH条件下暹罗芽孢杆菌对铀的去除情况。 可以看出, 在pH 3.0~5.0时, 暹罗芽孢杆菌对铀的去除率和吸附量逐渐升高; pH> 5.0后, 去除率和吸附量呈现下降趋势。 在pH 5.0时, 去除率和吸附量均达到最大值, 分别为77.9%和368.2 mg· L-1。
有研究表明, 微生物对铀的去除分为两步[11]。 首先, 微生物通过吸附的形式将铀吸附在菌体表面, 然后再与溶液中的阴离子结合而发生沉降。 因此, 吸附作为去除作用中一个重要的过程值得被深入探究。 利用Visual MINTEQ软件对铀在不同pH条件下的存在形态进行模拟计算, 结果见图1(b)。 在pH 3.0~5.0时, 铀主要以带正电或不带电的形式[U
暹罗芽孢杆菌与铀作用结束后, 离心取上清液, 用ICP-OES测试溶液中磷的含量, 以暹罗芽孢杆菌与超纯水作用作为空白对照。 反应后溶液中磷含量的变化如图1(c)所示。 从图中可以看出, 与对照组相比, 与铀作用后溶液中的磷含量均显著下降, 这可能是由于磷参与了暹罗芽孢杆菌对铀的去除被消耗造成的。 对比作用前后各组磷含量的差值发现, 在pH 5.0时, 磷的消耗量最大; 随着pH值的升高, 磷的消耗量呈现减弱的趋势。 这与前面研究得到的pH 5.0时铀的去除率最大、 pH> 5.0时铀的去除率逐步降低的趋势相匹配。 推测生物体释放的磷参与了铀的去除过程, 这一研究结果与文献报道的铀酰离子能与磷酸盐结合形成沉淀的结论[12, 13]相吻合。
2.1.2 菌体用量对暹罗芽孢杆菌去除铀的影响
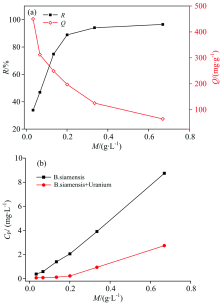
图2(a)给出了菌体用量对暹罗芽孢杆菌去除铀的情况。 从图中可以看出, 随着菌体用量从0.03 g· L-1增大到0.67 g· L-1, 暹罗芽孢杆菌对铀的去除率逐渐升高(从33.8%升高至96.5%), 吸附量则逐渐降低(从450.3 mg· g-1降低至64.2mg· g-1)。 这是因为随着菌体用量增加, 菌体所提供的活性位点数目亦随之增加, 去除率随之增大。 但由于溶液中铀总量恒定, 单位质量的菌体能够结合到的铀离子数目减少, 从而导致吸附量下降。 在菌体用量为0.03 g· L-1时, 暹罗芽孢杆菌对铀的吸附量高达450.3 mg· g-1, 为本实验获得的最大吸附量。 前人研究报道了一些常用于铀处理的芽孢杆菌属细菌, 如胶质芽孢杆菌, 其对铀的吸附量为180.0 mg·
观察作用后溶液中磷浓度的变化[图2(b)]发现, 随着菌体用量的增高, 生物磷的消耗量也随之增加。 这与菌体对铀的去除率变化趋势相符合, 说明随着生物量的增加, 菌体释放的含磷物质增多, 生物磷与铀的作用增强, 使得铀的去除率升高。
2.1.3 等温吸附分析
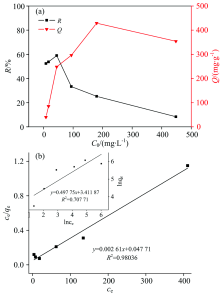
对不同铀初始浓度条件下暹罗芽孢杆菌对铀的去除进行研究[图3(a)], 结果表明: 随着铀初始浓度的增加, 暹罗芽孢杆菌对铀的去除率先小幅上升后下降, 吸附量则先增高而后出现轻微下降。 由于在低浓度铀环境中, 菌体对铀具有抗吸附能力, 因此在铀初始浓度8.1 mg· L-1时, 暹罗芽孢杆菌对铀的去除率和吸附量均较低。 随着铀浓度从8.1 mg· L-1升高至44.5 mg· L-1, 吸附抗性逐渐被打破, 去除率和吸附量菌升高。 之后随着铀浓度的增加, 吸附量随之增大, 当铀浓度达到179.8 mg· L-1时, 吸附容量达到最大值(429.1 mg· g-1)。 但由于溶液中菌体总量一定, 所提供的活性位点数目保持不变, 随着铀浓度的增大, 单位体积内未被结合的铀大幅度增加, 导致去除率显著下降。
采用Langmuir和Freundlich吸附等温模型对实验数据进行拟合[图3(b)], 探究暹罗芽孢杆菌对铀的等温吸附过程。 由图可看出, 单分子层吸附模型Langmuir方程的拟合程度(R2=0.980 36)高于Freundlich方程的拟合系数(R2=0.707 71), 说明暹罗芽孢杆菌对铀的吸附在铀浓度为8.1~448.0 mg· L-1范围内主要以单分子层吸附为主。 Langmuir方程拟合得出的qmax=383.1 mg· g-1, 低于实验中最大吸附量
暹罗芽孢杆菌与不同浓度铀溶液作用前后的红外光谱如图4所示, 由图可看出, 与铀作用前后, 暹罗芽孢杆菌红外光谱特征峰发生了不同程度的变化。
按文献[11, 12, 13, 14, 15]对主要吸收谱带归属后分析如下: 较宽的3 398.0 cm-1谱带是缔合的O— H伸展振动和蛋白质酰胺A带N— H伸展振动峰; 2 962.1和2 928.2 cm-1处的吸收峰为蛋白质和脂类的— CH3和— CH2— 的对称和反对称伸缩振动峰, 反映了脂肪酸和细胞壁组分上的亲水脂分子的信息, 这两处峰在与铀作用后并未发生明显变化。 蛋白质是细胞壁的主要成分之一, 对蛋白质部分特征峰进行归属。 1 656.6 cm-1处为蛋白质上酰胺Ⅰ 带的C=O键伸缩振动峰, 与铀作用后, 峰位未出现明显变化。 1 535.4 cm-1处吸收峰是酰胺Ⅱ 带, 是由仲酰胺的N— H键弯曲振动和C— N键伸缩振动引起的。 与铀作用后酰胺Ⅱ 带出现蓝移(由1 535.4 cm-1蓝移至1 540.3 cm-1), 蓝移程度随铀浓度的增加而增大, 说明在铀存在的条件下, 蛋白质肽链上的N— H可能和铀的络阴离子发生了配位作用, 并且铀浓度越高配位效果越明显。 在1 388.5 cm-1处的特征峰为肽链侧链的氨基酸残基离子化羧基(— COO— )的C(=O)2对称伸缩振动带。 当菌体与铀作用后, 羧基的C(=O)2伸缩振动峰位移, 峰强随着铀浓度的增大明显锐化, 这可能是羧酸盐阴离子上的氧原子与铀发生了配位作用, 并且这种配位作用随着铀浓度增大而增强。
值得注意的是, 当暹罗芽孢杆菌与铀作用后, 磷酸二酯键基团(P=O)的反对称伸缩振动峰由1 228.5 cm-1蓝移至1 233.6 cm-1, 说明磷酸酯键残基上氧原子可能和铀发生了配位作用。 磷酸盐(— P
综上所述推断, 蛋白质和脂类的特征吸收峰存在, 说明与铀作用后暹罗芽孢杆菌细胞壁的主要成分和结构仍保持完整。 磷酸基团和氨基、 羟基、 羧基活性基团是暹罗芽孢杆菌与铀作用的主要基团, 这些活性基团以配位的方式结合铀。
暹罗芽孢杆菌与铀作用前后的扫描电镜图如图5所示。 对照组中暹罗芽孢杆菌呈长杆状, 菌体表面光滑无杂质。 与铀作用后, 暹罗芽孢杆菌菌体表面失去原有光滑度, 菌体表面附着有鳞片状沉淀, 且附着的片状沉淀与反应的溶液初始pH密切相关。 在pH 5.0时, 菌体表面的鳞片状沉淀较pH 3.0和7.0明显增多, 这一结果和前述溶液初始pH对暹罗芽孢杆菌去除铀的影响结果吻合。 结合前面的红外分析, 推测鳞片状沉淀可能是铀与菌体表面活性基团相互作用后聚集堆积, 或部分细胞破损后外泄的胞内物质与铀结合形成。
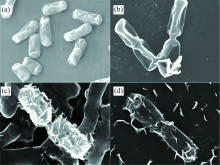 | 图5 与铀作用前后暹罗芽孢杆菌的SEM图 (a): 对照; (b): pH 3; (c): pH 5; (d): pH 7Fig.5 SEM of B.siamensis after reaction (a): Control; (b): pH 3; (c): pH 5; (d): pH 7 |
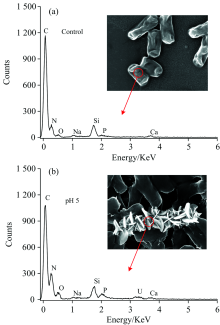
EDS能谱[图6(a和b)]分析显示, 暹罗芽孢杆菌与铀作用后, 在结合能3.0~3.5 keV附近出现明显铀的特征峰, 其含量占质量分数的19.71%, 摩尔比的1.78%, 说明细胞表面的鳞片状物质为含铀的沉淀。 同时发现, 作用后磷的峰强明显增加, 推测有较多的含磷物质与铀作用后被固定至菌体表面。 这些磷可能是微生物通过ATP水解、 多聚磷酸、 有机磷酸盐释放的结果。 综合上述的分析, 推测暹罗芽孢杆菌表面的鳞片状沉淀可能为含磷铀的物质。
为了进一步探索暹罗芽孢杆菌与铀的相互作用机制, 利用XPS对作用前后的菌体进行分析。 图7(a)是对照组和在pH 5.0条件下铀作用样品的XPS扫描全谱。 从图7(a)中可看出反应后出现明显的U4f特征峰, 说明暹罗芽孢杆菌在与铀的作用过程中可将铀固定至菌体表面。 在XPS Peak中对P2p峰和U4f峰进行拟合, 拟合参数见表1。 在暹罗芽孢杆菌与铀作用后, 磷的结合能从133.8 eV位移至133.2 eV, 这可能是含磷化合物与铀相互作用的结果[15]。 同时磷的峰面积增大, 说明与铀作用后样品中磷含量增加。 对U4f峰进行拟合, 结果如图7(b)所示, 380.0和391.0 eV处为四价铀的特征峰, 381.9和392.6 eV为六价铀的特征峰, 说明暹罗芽孢杆菌能将六价铀还原为四价铀, 推测可能是暹罗芽孢杆菌自身新陈代谢释放的物质将部分六价铀还原为四价铀。 对比六价铀与四价铀峰面积可知, 六价铀的含量更高, 说明被固定在暹罗芽孢杆菌表面的铀主要为六价铀, 推测暹罗芽孢杆菌表面的含磷铀沉淀可能以铀的磷酸盐形式存在。
 | 图7 暹罗芽孢杆菌与铀作用前后的(a)XPS扫描全谱和(b)P2p光谱及负载铀后的U4f光谱Fig.7 (a) Full scan of B.siamensis and (b) P2p spectra before and after treatment at pH 5.0 and (c) U4fspectra of U(VI)-load B.siamensis |
| 表1 暹罗芽孢杆菌与铀作用前后的XPS光谱参数 Table 1 Parameters for XPS spectra of B.siamensis before and after U(VI) treatment |
对反应前后菌体沉淀进行XRD测试分析后, 发现XRD谱图并无明显的晶体特征峰出现(并未将XRD图片放入本文), 推测铀可能以无定形形态赋存在菌体表面, 或沉淀中形成磷铀矿晶体的含量太少, XRD分析难以检出。
(1)通过ICP-OES, ICP-MS, FTIR, SEM-EDS和XPS等光谱学分析发现, 暹罗芽孢杆菌能够有效去除水体中的铀, 菌体通过ATP水解、 多聚磷酸、 有机磷酸盐释放的生物磷参与了其对铀的去除。
(2)暹罗芽孢杆菌对铀的去除在溶液初始pH 5.0 时去除效果最好。 菌体用量增加有利于暹罗芽孢杆菌对铀的去除。 暹罗芽孢杆菌对铀的去除行为符合Langmuir等温吸附模型, 等温吸附实验获得的最大吸附量(429.1 mg· g-1)高于理论计算的最大吸附量(383.1 mg· g-1), 说明暹罗芽孢杆菌对铀的去除可能是物理和化学行为的共同作用。 本实验中暹罗芽孢杆菌对铀的最大去除率为96.5%, 最高吸附量为450.3 mg· g-1, 高于大部分已报道的用于吸附铀的芽孢杆菌。
(3)结合FTIR, SEM, EDS和XPS等光谱学测试表征结果, 推测暹罗芽孢杆菌对铀的去除机制为: 首先, 通过静电作用铀被快速吸引到暹罗芽孢杆菌表面, 随后以配位的形式被菌体上的磷酸基团、 氨基、 羟基、 羧基等活性基团吸附, 同时与菌体释放的含磷酸盐类物质相互作用, 形成含磷铀沉淀而被固定至细菌表面。 在此过程中, 少部分六价铀被菌体释放的胞内物质还原成四价铀而发生沉降。 推测菌体表面沉淀可能为铀的磷酸盐沉淀和含磷化合物与铀的络合物形成的混合物。 本研究对利用微生物的生物矿化作用处理铀废水有所启示, 有助于开发微生物原位修复技术。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|