作者简介: 陈怡雪, 女, 1997年生, 郑州大学公共卫生学院硕士研究生 e-mail: CYXZZU@outlook.com
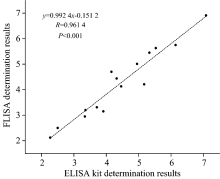
DNA甲基转移酶1(DNA methyltransferases1, DNMT1)负责维持DNA甲基化遗传稳定性, 其表达量与多种肿瘤的发生发展密切相关, 是一种重要的肿瘤分子标志物。 DNA甲基化转移酶(DNA methyltransferases, DNMTs)的现有检测方法大多基于原核生物酶建立, 且局限于实验室研究, 因此建立一种高灵敏、 高通量测定人血清中DNMT1含量的荧光免疫分析方法(FLISA), 以期为癌症早期筛查及临床应用提供新思路。 以Fe3O4磁珠为固相载体, 采用碳二亚胺/N-羟基硫代琥珀酰亚胺(EDC/Sulfo-NHS)键合法分别制备磁性免疫捕获探针Fe3O4@DNMT1小鼠单克隆抗体(Fe3O4@McAbDNMT1)及荧光免疫检测探针5-羧基四甲基罗丹明@DNMT1兔多克隆抗体(5-TAMRA@PcAbDNMT1)。 用红外光谱、 紫外-可见(UV-Vis)光谱、 Zeta电位、 免疫活性分别表征偶联产物的结构与活性。 在此基础上, 采用双抗体夹心法, 检测黑色96微孔板中反应产物的荧光强度, 根据荧光强度与DNMT1浓度的关系进行定量分析, 并进行方法学评价与比较。 实验结果显示, 双探针偶联成功, 并保持了原抗体的免疫活性。 该方法的线性方程 y=222.046+48.323 x, 线性范围0.05~80 ng·mL-1, 相关系数为0.991 4, 检出限为0.005 ng·mL-1, 板内、 板间的RSD分别为4.7%~8.8%, 1.6%~10.0%( n=6); 板内、 板间的回收率分别为91.3%~102.4%, 88.0%~98.8%( n=6); 方法特异性良好。 与酶联免疫吸附法(ELISA)和磁酶免疫吸附法(MELISA)相比, FLISA法的检出限最低, 灵敏度最高, 所需分析时间最短; FLISA法与商品化ELISA试剂盒对15例人血清样品进行分析, 差异无统计学意义( p>0.05)。 表明本研究所建立的FLISA方法灵敏快速, 适用于大批量人血清样品中DNMT1的快速测定, 在临床诊断方面具有重要的应用价值和广阔的应用前景。
DNA methyltransferases1 (DNMT1), a dominant enzyme responsible for maintaining the genetic stability of DNA methylation, is closely related to the occurrence and development of a variety of tumors. However, till now, most of the studies on DNA methyltransferases (DNMTs) detection have focused on prokaryote methyltransferases and been limited to laboratory studies. Therefore, a fluorescence immunoassay (FLISA) for the high sensitivity and high throughput detection of DNMT1 level in human serum samples was established to provide new ideas for early cancer diagnosis and clinical cancer therapy. The functional carboxyl Fe3O4 magnetic beads were used as solid phase carriers. 1-chloride-3-dimethylamino-propyl-3-ethylcarbodiimide hydrochloric acid (EDC) and sulfo-N-hydroxysuccinimide (Sulfo-NHS) were used as coupling agents to prepare immune-magnetic capture probe Fe3O4@McAbDNMT1 (monoclonal antibody DNMT1). After that, the immune-fluorescent detective probe 5-TAMRA@PcAbDNMT1(5-carboxytetramethylrhodamine@polyclonal antibody DNMT1)was also made. Their structure and activity were characterized by infrared absorption, UV-Vis spectra, Zeta potential and immunocompetence. Then, the content of DNMT1 in human serum samples was detected based on the double-anti-sandwich method by FLISA with high sensitivity. Finally, methodology evaluation and comparison were conducted. The results showed that the probes conjugated successfully and maintained the immunocompetence of the original antibody. The linear equation was y=222.046+48.323 x, the linear range was 0.05~80 ng·mL-1, and the correlation coefficient was 0.991 4, the detection limit was 0.005 ng·mL-1, the intra-and inter-panel RSD was 4.7%~8.8% and 1.6%~10.0% ( n=6), respectively, intra- and inter-panel recoveries were 91.3%~102.4% and 88.0%~98.8% ( n=6), respectively. The cross-reactivity rates with other two DNA methyltransferase 3a/3b were lower, and the specificity of FLISA was well. Compared with ELISA and MELISA, FLISA has the lowest detection limit and shortest analysis time. Compared with ELISA kits, the result displayed a high correlation between two methods, and the difference of them was not statistically significant ( p>0.05). The result suggests that the FLISA system would be used to detect multiple samples at the same time for the rapid analysis of DNMT1 in human serum samples.
DNMT1是人体内含量最多、 最重要的甲基转移酶, 它是以病灶为靶点负责将亲代DNA甲基化信息遗传至子代细胞, 是维持DNA甲基化遗传稳定性的关键酶[1]。 研究表明, 其表达水平和活性变化与胃肠癌、 肺癌、 食管癌等多种肿瘤的发病机制密切相关, 是癌症发生发展重要的分子标志[2, 3, 4]。 目前, DNMTs的检测方法有很多, 如比色法[5], 高效液相色谱法[6], 化学发光分析法[7]及电化学分析法[8]等。 但这些方法大多是以原核细胞的甲基化转移酶如DNA adenine methylation (Dam) MTase, M.SssI为测量对象, 只有少数着眼于人类基因的DNMT1, 并局限于实验室研究, 未应用于实际样品的检测。 因此, 建立一种快速、 灵敏度高的DNMT1定量新方法具有重要的癌症早筛及临床应用价值。
荧光免疫分析法具备荧光法灵敏度高、 线性范围宽、 选择性良好等优点的同时, 还具备免疫法的高特异性, 在许多领域中应用广泛。 磁性Fe3O4纳米颗粒是将高分子材料与无机Fe3O4粒子结合起来的一种复合微球, 比表面积大, 能够提供更多空间使抗原抗体充分结合, 同时兼具良好的生物相容性与磁分离性能, 通常在生物样品混合物的分离中被用作载体。
本研究用Fe3O4磁性纳米球代替聚苯乙烯板作为固相载体, 负载DNMT1单克隆抗体作为捕获探针, 捕获并富集复杂基质中的目标物。 磁分离具有分离速度快、 不影响待测物的活性, 能够简化操作流程并减少复杂样品中基质对测定的干扰[9]。 在此基础上, 捕获探针与抗原及荧光检测探针形成“ 三明治” 夹心结构, 建立荧光免疫分析法, 并将其用于血清样品中DNMT1含量的高灵敏检测。
DNMT1抗原(OriGene公司); DNMT1小鼠单克隆抗体(McAbDNMT1, abcam公司); DNMT1兔多克隆抗体(PcAbDNMT1, abcam公司); 5-羧基四甲基罗丹明琥珀酰亚胺酯荧光染料(5-TAMRA, 淄博昀辉生物化工技术有限公司); DNMT1商品化ELISA试剂盒(武汉云克隆科技有限公司); 羧基化磁性Fe3O4纳米球(50 mg· mL-1, 百运纳米科技有限公司); N-羟基硫代琥珀酰亚胺钠盐(Sulfo-NHS, 分析纯, 阿拉丁公司); 碳二亚胺盐酸盐(EDC, 分析纯, 阿拉丁公司); Millipore超纯水(18.2 MΩ · cm); PBS磷酸盐缓冲液(0.01 mol· L-1, pH 7.4); PBST缓冲液(0.05%Tween20)。
纳米粒度及Zeta电位分析仪(Zetasizer Nano-zs 90, 英国Malvern), 红外光谱仪(PE-1710, 德国PE), 荧光分光光度计(F-4500, 日本日立), 紫外-可见分光光度计(UV-1601, 日本岛津), 磁分离板(百运纳米科技有限公司)。
取100 μ L Fe3O4溶液, 磁分离, 用PBS清洗3次; 加入100 μ L McAbDNMT1(0.1 mg· mL-1)混匀, 分别加入100 μ L Sulfo-NHS和EDC, 涡旋20 min, 于25 ℃偶联2 h; 磁分离, 取上清用于计算偶联效率, 用PBS清洗2次。 加入300 μ L PBS(含0.5%BSA)震荡30 min封闭未活化基团, 分散于300 μ L PBS中, 4 ℃保存。
取100 μ L PcAbDNMT1(0.25 mg· mL-1)于装有1.0 mL PBS的离心管中, 混匀后加入5.0 μ L 5-TAMRA稀释液(27.4 nmol), 涡旋3 h偶联。 取400 μ L偶联物于预冷的超滤管(30KDa)中离心, 最后将超滤管倒置于离心管中, 离心回收检测探针。
在黑色96孔板中加入300 μ L封闭液, 37 ℃温育90 min后用PBST洗板3次; 每孔加入Fe3O4@McAbDNMT1稀释液100 μ L(1:40), 磁分离后PBST洗3次。 加入100 μ L 0.05, 0.1, 0.25, 0.5, 1, 5, 10, 20, 40和80 ng· mL-1 DNMT1抗原, 37 ℃温育90 min, PBST洗板3次。 加入100 μ L 稀释20倍的5-TAMRA@PcAbDNMT1溶液, 37 ℃温育90 min, PBST洗板5次。 加入200 μ L PBST, 测定96孔板中各孔的相对荧光强度(RFU), 以浓度为横坐标, 检测信号为纵坐标, 绘制标准曲线。
在参考文献[10]的基础上分别建立检测DNMT1的ELISA方法和MELISA方法。
检出限: 配制5个低于线性范围的DNMT1试样以及6个DNMT1空白样, 用FLISA检测, 求出
精密度: 取一块96孔板, 分别配制低、 中、 高浓度的样品, 每个水平平行6份, 按照1.4节的方法进行实验, 根据测定结果计算板内精密度; 同上, 取不同的96孔板, 计算板间精密度。
准确度: 配制三个浓度的DNMT1标准品, 按照1.4节中步骤进行测定, 将所得结果与加标浓度进行比较, 计算方法准确度。
特异性: 选取与DNMT1性质相似的DNA甲基转移酶DNMT3a和DNMT3b为检测对象, 在与测DNMT1相同的条件下测定RFU, 考察方法的特异性。
方法学比较: 用所建立的FLISA检测DNMT1含量, 并与MELISA和ELISA进行比较。
血清样本来自郑州大学第一附属医院呼吸与重症科室。 取15例肺癌患者的血清样品, 用FLISA方法检测DNMT1含量, 并将检测结果与商品化ELISA试剂盒进行比较。
FLISA测定DNMT1的原理见图1。 采用EDC/Sulfo-NHS键合法, 羧基功能化的Fe3O4磁珠为固相载体, 与McAbDNMT1偶联制备免疫捕获探针, 加入DNMT1标准品或待测样品, 待测目标物被探针捕获并富集, 磁分离后加入标记有荧光检测探针5-TAMRA@PcAbDNMT1, 此时形成双抗体夹心的“ 三明治” 结构, 磁分离。 用200 μ L PBST对磁性复合物进行悬浮, 于555 nm激发光照射下检测580 nm处的荧光强度, 根据荧光强度和目标物浓度的关系进行定量分析。
2.2.1 Fe3O4@McAbDNMT1的红外光谱
按照1.2节中实验方法测定偶联效率, Fe3O4和McAbDNMT1的偶联效率为76.3%。
图2为Fe3O4@McAbDNMT1的红外图谱, 由图2可知: 与Fe3O4相比, Fe3O4@McAbDNMT1在546 cm-1处有Fe— O的特征吸收峰, 1 620 cm-1是C=O的伸缩振动吸收峰, 3 360 cm-1左右处是O— H和N— H的伸缩振动吸收峰, 1 000和1 650 cm-1之间具有肽链的特征吸收谱带, 由此判断Fe3O4和McAbDNMT1偶联成功。
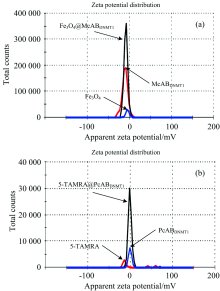
2.2.2 Fe3O4@McAbDNMT1的Zeta电位
捕获探针的Zeta电位分析结果见图3(a)。 从图3(a)数据可以看出, 羧基化的Fe3O4的Zeta电位-10.8 mV, Fe3O4@McAbDNMT1的Zeta电位-8.45 mV, McA
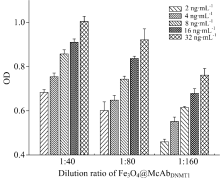
2.2.3 Fe3O4@McAbDNMT1免疫活性
用ELISA检测Fe3O4@McAbDNMT1的免疫活性的实验结果见图4。 图中显示Fe3O4@McAbDNMT1稀释比相同的情况下, 随着抗原浓度的增加吸光度逐渐增大; 在抗原浓度相同的情况下, 随着Fe3O4@McAbDNMT1稀释比的增大吸光度逐渐减小, 表明在羧基化Fe3O4表面成功修饰了McAbDNMT1, 并保持了抗体的活性。
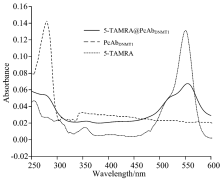
2.3.1 5-TAMRA@PcAbDNMT1的紫外-可见吸收光谱
分别绘制5-TAMRA, PcAbDNMT1及5-TAMRA@PcAbDNMT1的紫外-可见吸收光谱, 如图5所示。 从图5中可以看出, 5-TAMRA的最大吸收峰为551 nm, PcAbDNMT1在280 nm处有最大吸收峰, 5-TAMRA@PcAbDNMT1在280 nm处和在555 nm均有吸收峰, 表明偶联成功。
2.3.2 5-TAMRA@PcAbDNMT1的Zeta电位
检测探针的Zeta电位测量结果见图3(b)。 从图3(b)可以看出, 5-TAMRA, PcAbDNMT1和5-TAMRA@PcAbDNMT1的Zeta电位分别为-1.950, 1.320和-0.968 mV。 5-TAMRA与抗体偶联后形成了偶联物导致Zeta电位发生变化, 提示PcAbDNMT1与5-TAMRA偶联成功。
2.3.3 5-TAMRA@PcAbDNMT1的激发光谱与发射光谱
5-TAMRA@PcAbDNMT1的激发光谱与发射光谱分别见图6(a)和(b)。 由图6(a)可知, 5-TAMRA及其偶联物的最大激发波长为555 nm。 由于5-TAMRA在偶联的过程中有损失, 所以偶联物的荧光强度与5-TAMRA相比有所减弱。 由图6(b)可知, 5-TAMRA的最大发射波长是575 nm, 而偶联物的最大发射波长为580 nm, 发生了红移, 表明5-TAMRA与PcAbDNMT1生成了新的偶联产物。
 | 图6 (a) 5-TAMRA@PcAbDNMT1的激发光谱; (b) 5-TAMRA@PcAbDNMT1的发射光谱Fig.6 (a) The excitation spectra of 5-TAMRA@PcAbDNMT1; (b) The emission spectra of 5-TAMRA@PcAbDNMT1 |
2.3.4 5-TAMRA@PcAbDNMT1的免疫活性
利用抗原抗体的特异性结合进行免疫活性分析, 结果见图7, 随着抗原浓度的逐渐增加, 荧光强度随之增大, 表明5-TAMRA与PcAbDNMT1形成了偶联物, 并保持了抗体的免疫活性。
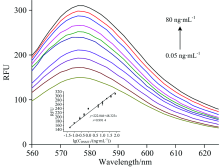
2.4.1 FLISA标准曲线
方法的标准曲线如图8所示。
2.4.2 FLISA检出限、 精密度、 准确度及方法学比较
FLISA, MELISA和ELISA检测DNMT1的方法学见表1、 所需时间见表2。 从表1数据可以看出, FLISA方法的检出限最低, 板内与板间精密度好、 准确度符合要求。 表2数据显示, 不同分析方法所需分析时间从短到长的顺序为: FLISA< MELISA< ELISA。
| 表1 三种分析方法的线性范围、 相关系数和检出限 Table 1 Linear range, correlation coefficient and detection limit of the three analysis methods |
| 表2 三种分析方法的反应时间 Table 2 Reaction time of the three analysis methods |
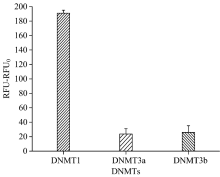
2.4.3 特异性评价
特异性分析结果见图9。 图9显示: 在DNMT1, DNMT3a和DNMT 3b浓度相同时, 测定DNMT3b的信号值约为DNMT1的1/7, DNMT3a的信号值更低, 方法的特异性良好。
以比表面积大的Fe3O4 纳米颗粒为固相载体固定DNMT1单克隆抗体, 克服了常规ELISA分析中包被的抗原(或抗体)易脱落, 固液接触面积小, 反应速度慢, 分析时间长等不足; 结合纳米技术、 磁分离技术以及免疫分析技术, 建立基于免疫磁性纳米颗粒的荧光免疫分析(FLISA)法, 用于人血清中DNMT1含量分析。 与ELISA和MELISA法比较, FLISA法检出限低, 灵敏度高, 特异性强, 操作简单, 有望应用于高通量、 大样本的检测, 可考虑进一步制成试剂盒, 提高检测效率。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|