作者简介: 王晓辉, 1976年生, 上海海洋大学食品学院讲师 e-mail: xhwang@shou.edu.cn
酸性橙Ⅱ作为一种偶氮类化工染料, 具有致癌致畸性, 因此, 禁止添加于食品中。 但由于酸性橙Ⅱ色泽鲜艳、 着色力强、 价格低廉, 不法商家出于利益考虑非法添加于食品中用于着色, 严重威胁到食品安全和消费者健康。 酸性橙Ⅱ传统检测方法主要是利用仪器分析技术进行分析, 但存在前处理复杂、 耗时费力等缺点, 不能满足快速检测识别的目的。 表面增强拉曼光谱(SERS)技术作为一种快速、 灵敏的新兴指纹光谱分析技术, 在食品安全检测领域的应用受到广泛关注, 因此, 本文采用SERS光谱结合不同纳米材料增强基底, 探索酸性橙Ⅱ的快速检测方法。 首先实验室自制了金纳米颗粒溶胶, 金纳米棒溶胶基底, 并对其结构性能进行了表征, 纳米溶胶基底尺度均匀、 分散性良好。 基于金纳米颗粒溶胶对两种拉曼激发光源(波长为633和780 nm)对酸性橙Ⅱ分析的影响进行了研究, 结果表明基于633 nm激发光源酸性橙Ⅱ的SERS响应信号更强。 在此基础上, 对比了KlariteTM商业化固体基底、 实验室自制金纳米颗粒溶胶和金纳米棒溶胶基底的增强性能, 不同粒径金纳米颗粒溶胶对酸性橙Ⅱ的SERS分析有明显差异, 粒径为(18.0±2.0) nm金纳米溶胶展现出较好的增强性能。 利用增强性能差异不大的三种纳米材料基底(KlariteTM固体基底, 粒径为(18.0±2.0) nm的金纳米颗粒基底, 横纵比为1.8的金纳米棒基底)对系列浓度的酸性橙Ⅱ进行了SERS检测, 结果表明SERS结合三种基底对酸性橙Ⅱ的最低检出浓度分别为0.2, 0.1和0.1 mg·L-1。 SERS强度随着酸性橙Ⅱ浓度的增加而增强, 因此探索建立了酸性橙Ⅱ的定量分析模型。 研究选取1 184, 1 385和1 597 cm-1三个特征主峰, 确定其不同浓度酸性橙Ⅱ所对应的特征峰强度, 建立酸性橙Ⅱ标准溶液浓度与单个SERS特征峰强度之间的线性回归模型, 决定系数 R2的范围为0.861~0.938, RMSE为0.88~1.15 mg·L-1, RPD为2.5~4.0, 其中, 1 597 cm-1特征峰强度与浓度之间的线性回归模型最佳( R2=0.933, RMSE=0.88 mg·L-1, RPD=4.0), 具有良好的线性相关性。 研究表明采用SERS光谱技术可对酸性橙Ⅱ进行定性定量分析, 可作为一种简单、 快速、 高灵敏的检测方法用于色素类污染物检测。
Acid Orange Ⅱ, as an azo chemical dye, displays strong carcinogenesis and teratogenicity. Therefore, it is prohibited to use it in food industry. However, due to the bright color, good dyeing force and low price of Acid Orange Ⅱ, unscrupulous merchants illegally added Acid Orange Ⅱ to food for coloring, which seriously threatens food safety and consumer health. Acid Orange Ⅱ can be detected by traditional instrumental analysis methods. These methods have their own limitation such as complicated preprocessing, being time-consuming, and could not match the purpose of rapid detection and identification. Surface-enhanced Raman spectroscopy (SERS), as a fast, sensitive and novel fingerprint spectral analysis technology, has received extensive attention in the field of food safety detection. Therefore, this study aims to apply SERS spectroscopy technique combined with different nanosubstrates to explore the rapid detection method of Acid Orange Ⅱ. Firstly, gold nanoparticles (AuNPs), gold nanorods (AuNRs) substrate were synthesized in our laboratory, and we characterized its structure and properties using transmission electron microscipy (TEM). The results indicated that the nanosubstrates have the uniform scale and good dispersion. Then, the effect of two different Raman excitation sources was analyzed, which included the wavelengths of 633 and 780 nm. The results showed that the SERS response signal of Acid Orange Ⅱ is stronger based on the 633 nm excitation source. On this basis, three different substrates (KlariteTM commercial solid substrate, AuNPs, and AuNRs) were compared and the substrate enhancement performance was studied. The SERS signal of Acid Orange Ⅱ was significantly different based on different gold nanoparticle sizes. It exhibited better reinforcing properties for (18±2) AuNPs. Acid Orange Ⅱ standard solutions with a series of concentrations were detected using SERS combined with three nanosubstrates (KlariteTM, AuNPs with the diameter of (18±2) nm and AuNRs with an aspect ratio of 1.8), which showed almost similar enhancement for SERS signal of Acid Orange Ⅱ. The results demonstrated that the lowest detection concentrations of Acid Orange Ⅱ were 0.2, 0.1, and 0.1 mg·L-1 based on KlariteTM, AuNPs w and AuNRs substrates, respectively. As the SERS intensity increased with the increase of the concentration, the quantitative analysis models of Acid Orange Ⅱ were established. The Raman intensities of the selected peaks at 1 184, 1 385 and 1597 cm-1 were in linear relationship with the concentrations of Acid Orange Ⅱ. The linear determination coefficient R2 ranges were from 0.861 to 0.938, the RMSE is 0.88~1.15 mg·L-1, and the RPD is 2.5~4.0. The linear regression model between 1 597 cm-1 peak intensity and concentration ( R2=0.933, RMSE=0.88 mg·L-1, RPD=4.0) showed the best linear correlation. The results showed SERS spectroscopy could be used for qualitative and quantitative analysis of Acid Orange Ⅱ. The proposed method, as a simple, rapid and highly sensitive approach, could be applied for detection colorants.
酸性橙Ⅱ (2-萘酚偶氮对苯磺酸钠)属于化工染料, 工业上主要用羊毛、 皮革、 蚕丝、 纸张的染色, 医学上常用于组织切片的染色。 由于其具有致癌致畸性, 酸性橙Ⅱ 被禁止添加于食品中。 因其色泽鲜艳、 着色力强、 价格低廉, 仍有商家为降低成本将其用于辣椒粉、 腐竹、 卤肉或者烤鸭的着色, 引起人体中毒[1]。 目前, 检测酸性橙等色素类物质的方法主要有高效液相色谱法[2, 3]、 薄层色谱扫描法[4]、 紫外吸收光谱法[5]和酶联免疫吸附法[6]等, 这些方法存在前处理复杂、 分析时间较长、 灵敏度不高等缺点。 表面增强拉曼光谱(surface enhanced Raman spectroscopy, SERS)作为一种新兴的分子光谱技术, 具有快速、 灵敏、 指纹识别等特点, 该技术在细胞检测[7]、 医学诊断[8]、 微生物识别[9]、 痕量化学物质检测[10, 11]等领域已被广泛应用并展现出广阔的前景。
SERS信号的增强很大程度上取决于拉曼基底的性能, 与其结构、 尺寸、 形貌、 粗糙程度等因素有关, 常见的SERS增强基底主要有固体Q-SERS基底[12]、 KlariteTM基底[13]、 不同形状金属纳米溶胶基底、 各向异性纳米粒子基底和化学自组装基底[14]。 纳米增强基底因其形状、 结构、 材料等差异, 对不同目标分析物其增强性能也有差异。 固体基底因其结构稳定, 基底本身具有较好的一致性, 因此其重复性较好。 核壳结构复合基底充分利用“ 热点效应” 提高其增强性能。 金纳米棒是最近研究热门的SERS基底之一, 由于避雷针等电磁增强效应, 能使分析物SERS信号增强, 从而提高分析方法的灵敏度。 本研究基于SERS光谱结合不同纳米材料增强基底对酸性橙Ⅱ 进行了检测研究。 对比了不同激光激发光源的影响, 分析了不同纳米材料基底增强性能差异, 并基于不同基底对酸性橙Ⅱ 标准溶液系列浓度进行了检测, 建立了定量分析模型。
标准品酸性橙(纯度≥ 98%)购置于Sigma-Aldrich公司。 纳米材料制备所需试剂包括十六烷基三甲基溴化铵(CTAB)(纯度99%)、 氯金酸(纯度99.99%)、 L-抗坏血酸(纯度> 99.9%)、 硼氢化钠(纯度≥ 99%)、 硝酸银(纯度> 99%)等购置于Sigma-Aldrich和百灵威科技有限公司。 使用Nicolet DXR显微共聚焦拉曼光谱仪(美国Thermo Fisher Scientific公司)获取样品光谱, 采用JEM-2100F型场发射透射电子显微镜(日本JEOL公司)对纳米材料进行表征。
1.2.1 金纳米材料的制备
(1)金纳米颗粒溶胶
根据Frens方法[15], 取50 mL氯金酸(2× 10-4 mol· L-1)溶液置于100 mL圆底烧瓶中, 油浴中搅拌加热至沸腾, 加入0.74 mL柠檬酸钠(1% W/W), 搅拌加热至酒红色, 制备出粒径约为(18.0± 2.0) nm的金纳米溶胶, 自然冷却至室温保存备用。 通过调整柠檬酸钠的用量可制备不同粒径的金纳米颗粒溶胶。
(2)金纳米棒溶胶
参照文献[16]硝酸银辅助种子生长法制备。 首先, 金种制备过程: 在10 mL 0.1 mol· L-1 CTAB溶液中加入2.5× 10-4 mol· L-1 氯金酸和600 μ L 0.01 mol· L-1 冰浴的硼氢化钠溶液, 剧烈搅拌10 min后, 25 ℃陈化2.5 h。
金纳米棒合成: 在CTAB (9.5 mL, 0.1 mol· L-1)溶液中, 依次加入硝酸银(20 μ L, 0.01 mol· L-1), 氯金酸(0.5 mL, 0.01 mol· L-1)和抗坏血酸(55 μ L, 0.1 mol· L-1), 搅拌均匀后加入12 μ L制备的金种, 将此混合液于27 ℃陈化14~16 h。
离心浓缩: 取1.5 mL金纳米棒溶胶于离心管中, 12 000 r· min-1离心10 min, 去除上清液, 加入超纯水, 再离心10 min, 去除上清液, 再加入一定量的超纯水, 涡旋混匀, 待用。
1.2.2 标准溶液的配制
酸性橙Ⅱ 标准品用乙腈溶解后, 配成浓度为100 mg· L-1的储备液, -20 ℃避光保存。 用乙腈和水的混合液(1:1, V/V)将其稀释成系列浓度的标准溶液(酸性橙Ⅱ 浓度范围为0.05~10.0 mg· L-1), 密封后4 ℃避光保存备用。
1.2.3 光谱采集条件
用洗净的玻璃片将色素标准品固体粉末平铺均匀后采集其拉曼图谱。 将标准溶液与等量金纳米颗粒溶胶, 或离心浓缩后的金纳米棒溶胶混匀, 取5 μ L于载玻片表面, 50 ℃烘干后用于SERS检测。
光谱采集条件: 波长633 nm He-Ne激光源, 光源功率2 mW, 波长为780 nm半导体激光源, 光源功率 100 mW, 曝光时间为2 s, 曝光次数为3次, 采集图谱波数为400~2 000 cm-1, 分辨率为4.7 cm-1。
为确保实验数据的有效性, 每个浓度样品在基底上随机采集任意10个点获得10条谱图, 平均后作为样品光谱, 在不同批次的基底上每个浓度样品重复采集4次, 获得样品谱图进行数据分析。
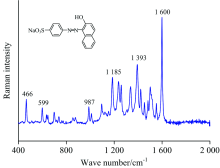
酸性橙Ⅱ 的常规拉曼光谱及分子结构式如图1所示。 酸性橙Ⅱ 的拉曼特征峰较多, 最强特征峰出现在1 600 cm-1, 该特征峰归属于苯环的伸缩和面内变形振动及N— H的平面内弯曲振动。 其他主要特征峰分别为1 500, 1 393, 1 185, 987, 599和466 cm-1可归属于N— H的平面内弯曲振动、 N— H的平面内弯曲振动、 C— N和N=N的伸缩振动、 苯环及萘环的面内变形振动[17, 18, 19]。 不同分子结构其拉曼特征峰的差异充分展示了拉曼光谱的指纹特性, 为不同物种鉴别提供了理论基础。
研究采用了KlariteTM金纳米固体基底(Renishaw Diagnostic Ltd.英国)、 实验室制备的金纳米颗粒、 金纳米棒溶胶基底作为SERS增强基底。 KlariteTM固体基底外观结构及结构表征如图2所示, 其表面是具有金膜覆盖的倒金字塔纳米结构, 固定于玻璃片上, 增强活性面积为4 mm× 4 mm的正方形, 金膜均匀, 结构稳定, 具有良好的重复性。
 | 图2 KlariteTM基底及结构[20]Fig.2 SERS-active substrates KlariteTM and TEM images |
图3为金纳米颗粒和金纳米棒的透射电镜图。 从电镜图中可看出合成的金纳米粒子具有良好的分散性、 粒径分布较均匀。 以100个纳米粒子为基数计算金纳米颗粒的平均粒径为(18.0± 2.0) nm, 金纳米棒的横纵比为1.8[长(40.1± 3.8) nm, 宽(21.8± 2.1) nm)]。
2.3.1 不同激光光源、 不同基底对酸性橙Ⅱ 分析的影响
基于金纳米颗粒溶胶基底, 对比分析了633和780 nm两种激光光源对酸性橙Ⅱ 溶液的SERS增强性能。 图4为酸性橙Ⅱ 基于不同激光光源的SERS谱图。 从图4 可以看出, 同一较低浓度(0.1 mg· L-1)时, 两种激光光源采集酸性橙Ⅱ 的SERS信号差异不大, 但780 nm的激发光源采用了更高的激光功率为100 mW, 而633 nm激发光源功率只需2 mW。 同等条件基于较高浓度(0.5 mg· L-1)进一步分析, 基于633 nm的激发波长酸性橙Ⅱ 具有更高强度的SERS信号。 由于不同波长的激光具有不同的激发能量, 对不同结构的分子, 具有不同的激发效应, 导致产生的拉曼光谱强度存在明显差异。 因此, 该结果表明633 nm的激光光源更有利于酸性橙Ⅱ 的SERS分析检测。
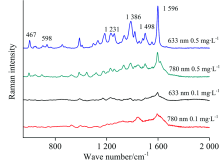 | 图4 酸性橙Ⅱ 基于不同激光光源的SERS谱图Fig.4 Representative SERS spectra of Acid Orange Ⅱ based on two laser excitation sources |
在确定激光光源之后, 对比分析了KlariteTM、 金纳米颗粒及金纳米棒三种纳米增强基底对酸性橙Ⅱ 溶液的SERS增强效果, 结果如图5所示。 不同基底获得的酸性橙Ⅱ 溶液的SERS谱图展示出类似的特征峰, 说明不同基底本身对酸性橙Ⅱ 溶液的SERS信号响应类似, 但不同粒径纳米颗粒基底增强效应存在较明显的差异。 采用2种不同粒径的金纳米粒子对酸性橙Ⅱ 进行分析, 对比发现, 基于粒径约为55 nm的Au纳米粒子采集获得的5 mg· L-1酸性橙Ⅱ 溶液的SERS强度几乎等同于粒径约为20 nm的Au纳米粒子采集获得的1 mg· L-1酸性橙Ⅱ 溶液的SERS强度, 由此可见, 小粒径的纳米粒子溶胶基底对酸性橙Ⅱ 的SERS增强效果优于大粒径的纳米粒子溶胶基底。 比较KlariteTM、 20 nm的金纳米颗粒溶胶基底及金纳米棒基底对1 mg· L-1的酸性橙Ⅱ 分析, 发现SERS强度差异不大, 金纳米颗粒基底增强性能稍显优势, 但三种基底对酸性橙Ⅱ 溶液均具有较好的增强效果, 可用于SERS分析。
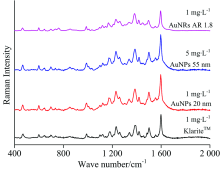 | 图5 基于不同纳米基底酸性橙Ⅱ 的SERS谱图Fig.5 Representative SERS spectra of Acid Orange Ⅱ based on different substrates |
2.3.2 不同基底对酸性橙Ⅱ 的检测
不同基底, 因其结构性能差异, 导致不同结构目标分子在基底表面吸附行为存在差异, 从而产生增强性能的差异性。 基于KlariteTM金纳米固体基底、 金纳米颗粒溶胶及金纳米棒溶胶基底结合SERS对不同浓度梯度的酸性橙 Ⅱ 标准溶液体系进行了检测研究, 结果如图6所示, 基于3种不同基底酸性橙Ⅱ 主要特征峰峰位基本一致, 随着溶液浓度的增加, 特征峰的强度逐渐增强。 基于KlariteTM基底, 浓度为0.1 mg· L-1时, 多数特征峰无法识别, 仅位于1 598 cm-1的特征峰可以辨别, 可认为基于KlariteTM金纳米固体基底, SERS对酸性橙Ⅱ 溶液的最低检测浓度为0.2 mg· L-1。
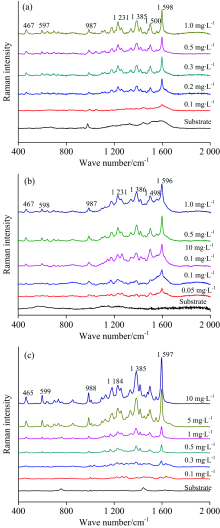 | 图6 酸性橙标准溶液的SERS检测Fig.6 Representative SERS spectra of Orange Ⅱ standard solutions based on (a) KlariteTM, (b) AuNPs, and (c) AuNRs |
如图6(b)和(c)所示, 基于金纳米颗粒溶胶基底, 酸性橙Ⅱ 溶液浓度为0.1 mg· L-1时, 位于467, 1 231, 1 498和1 596 cm-1的特征峰均可以辨别, SERS结合金纳米颗粒溶胶对酸性橙Ⅱ 的最低检测浓度为0.1 mg· L-1。 酸性橙Ⅱ 标准溶液浓度为0.1 mg· L-1时, 基于金纳米棒采集的SERS光谱位于988, 1 184, 1 385和1 597cm-1附近的特征峰仍能清晰辨认, 因此, 基于金纳米棒基底SERS对酸性橙Ⅱ 的最低检出浓度同为0.1 mg· L-1。
2.3.3 酸性橙Ⅱ 的定量分析
SERS强度随着酸性橙Ⅱ 浓度的增加而增强, 因此, 尝试建立SERS图谱特征峰强度与色素浓度间线性回归模型, 用于酸性橙Ⅱ 的定量分析。 选取1 184, 1 385和1 597 cm-1三个特征主峰, 酸性橙Ⅱ 标准溶液浓度与单个SERS特征峰强度之间的线性回归模型结果如表1所示。 决定系数R2范围为0.861~0.938, RMSE为0.88~1.15 mg· L-1, RPD为2.5~4.0, 1 597 cm-1特征峰强度与浓度之间的线性回归模型最佳, 以上结果表明SERS可用于酸性橙Ⅱ 的定量分析, 为实际样品中酸性橙Ⅱ 的定量分析提供了理论依据。
| 表1 特征峰强度与酸性橙Ⅱ 浓度间的线性回归模型 Table 1 Linear relationship between acid orange concentration and the peaks intensity |
应用表面增强拉曼光谱结合不同纳米基底对酸性橙Ⅱ 进行了检测分析, 对比了不同波长激发光源对酸性橙Ⅱ 的SERS检测影响, 分析了不同纳米基底增强性能, 并基于不同基底对酸性橙Ⅱ 标准溶液进行了检测, 该方法可为痕量酸性橙Ⅱ 及同类色素的检测提供快速、 准确、 灵敏的分析检测途径, 主要结论:
(1)实验室自制金纳米颗粒和金纳米棒基底分散性良好, 尺度一致; 波长为633 nm的激发光源对酸性橙Ⅱ 的SERS检测更加有效; 不同粒径金纳米颗粒对酸性橙Ⅱ 的增强性能差异显著, 小粒径纳米颗粒增强效果更好。
(2)SERS结合KlariteTM固体基底、 粒径为(18.0± 2.0) nm的金纳米颗粒, 横纵比为1.8的金纳米棒对酸性橙Ⅱ 的最低检出浓度分别为0.2, 0.1和0.1 mg· L-1; 基于SERS特征峰强度和酸性橙Ⅱ 浓度相关性, 建立了定量分析模型, 最优线性回归模型的决定系数R2为0.933, RMSE=0.88 mg· L-1, RPD=4.0。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|