作者简介: 张文月, 1993年生, 河北大学化学与环境科学学院硕士研究生 e-mail: 15233511915@163.com
利用以阳离子共轭聚合物为能量供体的荧光共振能量转移(FRET)策略和滚环扩增放大技术, 建立了一种新型的microRNA(miRNA)检测方法。 阳离子共轭聚合物采用聚[(9,9-双(6’-N,N,N-三乙基铵)己基)亚芴基亚苯基二溴化物](PFP)。 PFP是一种由大量吸光单元共轭而成的阳离子聚合物, 具有独特的光捕获和荧光增强性能, 可以和带有负电荷的DNA通过静电作用相互结合。 SG是一种能够结合于所有双链DNA双螺旋小沟区域的染料, 其在游离状态下, 荧光微弱, 但一旦与双链DNA结合后, 荧光会大大的增强。 首先, 设计了一条可与目标分子特异性杂交的锁式探针和与RCA产物序列互补的DNA链。 当体系中存在miRNA时, 在T4 DNA连接酶作用下, 锁式探针连接成环; 随后, 在phi29 DNA聚合酶和dNTPs共同作用下, 在miRNA的3’端滚环扩增出一条与锁式探针序列互补的长单链DNA, 所得产物与互补DNA链杂交形成双链DNA(dsDNA)。 此时SG作为FRET受体掺入其中, 形成SG-dsDNA共同体。 随后, SG-dsDNA与PFP因静电相互作用而紧密接近, 由于PFP的发射光谱与SG的激发光谱有重叠, 因此二者之间可以发生FRET现象。 反之, 当体系中不存在miRNA时, 挂锁探针则无法连接成环, 阻止了扩增反应的进行及其产物与互补DNA链的杂交反应。 加入SG后, 由于SG与单链DNA的结合能力很弱, SG则游离于溶液中, 不会与PFP发生有效的FRET。 因此目标分子的浓度与体系的FRET效率直接相关。 以let 7a作为待测miRNA分子, 在0.05~5 nmol·L-1的范围内, let 7a的浓度与从反应体系测得的FRET效率( I520 /I423)成正比。 同时以无PFP参加的检测方案作为对比实验, 证明了PFP确实具有提高灵敏度的作用。 另外, 以四种同族miRNA分子及两种其他miRNA分子作为干扰物质对方法的特异性进行了考察, 发现除了两种与目标分子序列高度相似的物质存在干扰外, 其他物质几乎不产生信号。 利用该方法对细胞总RNA提取液中let 7a的含量及其加标含量进行了检测, 测量所得回收率基本令人满意。 所建立的方案不需要荧光标记探针, 有效降低了检测成本, 简化了操作步骤, 在与miRNA相关的疾病诊断领域具有一定的应用前景。
A label-free analysis strategy of miRNA is designed using the rolling circle amplification (RCA) and fluorescence resonance energy transfer (FRET) with cationic conjugated polymer (CCP) as donor. In this strategy, the cationic poly [(9, 9-bis(6’-N, N, N-triethylammonium)hexyl) fluorenylenephenylene dibromide] (PFP) serves as the donor of FRET and SYBR Green Ⅰ(SG)serves as the acceptor. PFP is a water-soluble π-conjugated polymer with cationic charged side chain functionalities. Its structure allows for efficient intrachain and interchain energy transfer mechanisms. It can be combined with DNA by electrostatic interaction. SG is an asymmetrical cyanine dye which preferentially binds to double-stranded DNA (ds-DNA) and stains single-stranded DNA with lower performance. The fluorescence of SG is weak in the free state, but greatly enhanced once the DNA-SG-complex is formed. Let 7a is used as the target molecule. A padlock probe matched with let 7a and the DNA probes matched with the RCA product are designed. In the presence of loret 7a, the hybridization of the padlock probe and target sequences brings two ends of padlock probe close together and can be covalently ligated into a loop in the catalyzing of T4 DNA ligase. When phi29 DNA polymerase and dNTPs are added, the rolling circle amplification of the circularized padlock probe is initiated from the target molecules and then a long single strand DNA with a lot of repetitive sequences is generated. When DNA probes and SG are added, a long ds-DNA is produced and stained by SG. The DNA-SG-complex and PFP are absorbed together through electrostatic interaction and the strong FRET from PFP to SG occurs due to the overlapping between the fluorescent emitting spectrum of the PFP and the absorption spectrum of SG. In the absence of let 7a, the padlock probe is not circularized, which induces the inhibition of rolling circle amplification and hybridization process. Therefore, the FRET also cannot occur. As a result, the let 7a can be quantitatively determined by monitoring the change of FRET signal. The results show that the let 7a concentrations in the range of 0.05~5 nmol·L-1 are linearly proportional to the detection signals. The specificity of this method is studied and the most of tested interfering substances have no influence on the test result of let 7a except let 7b and let 7c. Additionally, by the detection of let 7a concentration in the extract solution of cells, it is indicated that the strategy can be applied to the practical samples analysis. Because fluorescent labeling is not required, this strategy reduces the detection cost and simplifies the operation steps. Therefore, this protocol shows certain potential in the study of miRNA-related biological processes as well as disease diagnosis.
MicroRNAs(miRNA)是一类非编码小RNA, 其长度约为20~24个核苷酸, 可参与细胞内多种生命过程, 并具有重要的调节作用[1]。 目前已有研究证明, miRNA的表达与多种疾病尤其是癌症密切相关[2], 并且miRNA可以稳定存在于生物体外周血循环过程中[3], 因此通过血液中miRNA含量的检测可以实现多种疾病的早期诊断和筛选。 早期miRNA通常是通过Northern印迹杂交法[4]、 微阵列芯片技术[5]及实时定量聚合酶链式反应法[6]等方法来检测。 虽然这些方法准确度比较高, 但均存在一定的缺陷。 由于miRNA序列短并且丰度低, 人们发展了多种扩增技术对其进行信号放大, 滚环扩增技术(RCA)就是其中一种。 该技术由Jonstrup等[7]于2006年引入到miRNA检测中, 跟传统方法相比, 它不需要变温热循环, 在恒温条件下即可达到与聚合酶链式反应相当的灵敏度, 另外, miRNA的短序列正好与滚环扩增中挂锁探针所需模板长度相匹配。 因此, 滚环扩增技术在miRNA检测中受到了广泛的关注。
阳离子共轭聚合物是由大量吸光单元共轭而成的高分子化合物, 具有较强的光捕获能力, 常被用作荧光传感探针以达到放大荧光信号的目的, 进而实现目标分子的高灵敏度检测[8, 9, 10]。 阳离子共轭聚合物可以和带负电的DNA通过静电相互作用结合, 如果对DNA进行适当的荧光标记, 二者可以发生荧光共振能量转移(FRET)现象[11], 该现象目前已被广泛应用到多种生物分子的检测中[12]。
本文将滚环扩增技术高效的信号放大作用和阳离子共轭聚合物介导的FRET策略结合起来, 发展了一种新型的miRNA检测方案。 该方法中, 首先使用目标分子引发滚环扩增反应, 其扩增产物与互补序列杂交形成长序列双链DNA, 然后以SYBR Green Ⅰ (SG)使该DNA染色并作为FRET能量受体, 此时加入阳离子共轭聚合物作为能量供体, 染色后的DNA与阳离子共轭聚合物通过静电吸附作用结合诱发强烈的FRET效应。 目标分子与体系的FRET效率直接相关, 因此通过本方案可以进行miRNA的定量检测。 由于整个检测过程中均不需要提前标记的探针参与, 本策略在简化方案和降低成本方面具有一定的优势。
(1)仪器: PCR(2720 Thermal Cycler, 美国); Fluorolog 3-211 荧光光谱仪(Horiba Jobin-Yivon, 法国); pH计(雷磁pH S-3C型, 上海精密科学仪器有限公司)。
(2)试剂: T4 DNA连接酶、 10× T4 buffer购于New England Biolabs, 其中10× T4 buffer pH为7.5, 包含MgCl2(100 mmol· L-1), ATP(10 mmol· L-1), Tris-HCl(500 mmol· L-1)及DTT(100 mmol· L-1); phi29 DNA聚合酶、 10× phi29 buffer购于Thermo Fisher Scientific, 其中10× phi29 buffer pH为7.9, 包含Mg-acetate(100 mmol· L-1), Tris-acetate(330 mmol· L-1), DTT(10 mmol· L-1), Tween-20(1%)及K-acetate(660 mmol· L-1); dNTPs及RNA酶抑制剂购于宝生物科技有限公司(中国, 大连); SYBR Green Ⅰ (20× , SG)购于厦门致善生物科技股份有限公司; 聚[(9, 9-双(6’ -N, N, N-三乙基铵)己基)亚芴基亚苯基二溴化物](PFP)购于常州欣宏科生物化学有限公司; HEPES购于Sigma-Aldrich; DEPC水及试验所用DNA均购于生工生物工程(上海)股份有限公司; 实验中所用的miRNA均由宝生物科技有限公司(中国, 大连)合成。 DNA及miRNA序列如下所示: 锁式探针, 5’ -P-CTACTACCTCATGGCATACAGGGAGCCAGGCATGGC-ATACAGGGAGCCAGGCAAACTATACAAC-3’ ; 互补链H1, 5’ -AACTATACAACCTACTACCTCA-3’ ; 互补链H2, 5’ -TGGCATACAGGGAGCCAGGCA-3’ ; Let-7a, 5’ -UGAGGUAGUAGGUUGUAUAGUU-3’ ; Let-7b, 5’ -UGAGGUAGUAGGUUGUGUGGUU-3’ ; Let-7c, 5’ -UGAGGUAGUAGGUUGUAUGGUU-3’ ; Let-7g, 5’ -UGAGGUAGUAGUUUGUACAGU-3’ ; Let-7i, 5’ -UGAGGUAGUAGUUUGUGCUGU-3’ ; miR-21, 5’ -UAGCUUAUCAGACUGAUGUUGA-3’ ; miR-143, 5’ -UGAGAUGAAGCACUGUAGCUC-3’ 。
(1) 锁式探针成环: 分别将20 U的T4 DNA连接酶、 100 nmol· L-1的锁式探针、 1× T4 buffer, 0.4 U RNA酶抑制剂与目标分子let 7a混合于10 μ L体系中, 然后利用PCR仪将该体系在37 ℃条件下反应2 h, 此时锁式探针的缺口被T4 DNA连接酶连接, 锁式探针成环状。 之后, 升高温度为65 ℃, 恒温10 min, 使T4 DNA连接酶失活。
(2) 滚环扩增过程: 总反应体积为10 μ L, 包含2.5 μ L上述反应液、 0.25 mmol· L-1 dNTPs, 1× phi29 buffer, 0.5 U phi29 DNA 聚合酶和5 μ L DEPC水, 首先在30 ℃下反应2 h, 此时得到延伸产物长单链DNA。 然后升高温度为65 ℃, 恒温10 min, 使phi29 DNA聚合酶失活。
(3) 延伸产物与互补链的杂交反应: 总反应体积为15 μ L, 包含上述反应体系和浓度均为10 nmol· L-1 的H1和H2。 首先将反应液升温至95 ℃, 使DNA变性3 min, 然后调节温度为30 ℃, 恒温30 min, 使杂交反应进行完全。
(4) 荧光共振能量转移过程: 总反应体积为100 μ L, 包含步骤3的反应液、 0.4× SG染料和150 nmol· L-1 PFP, 利用荧光光谱仪测量该反应液的荧光光谱。
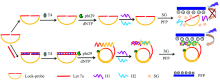
利用阳离子共轭聚合物与染料分子SG之间的FRET作用, 以滚环扩增技术作为信号放大手段, 本论文设计了一种新型的miRNA检测方法, 原理如图1所示。 首先将锁式探针与目标分子let 7a特异性杂交, 形成带缺口的挂锁结构, 在T4 DNA连接酶的作用下, 锁式探针闭合呈环状结构, 之后在phi29 DNA聚合酶的作用下, 该环状锁式探针从目标分子的3’ 端开始滚环扩增, 得到一条长单链DNA产物。 H1和H2为与该扩增产物互补的两条DNA链, 因此, 当二者加入到反应体系中时, 扩增产物将与H1和H2杂交形成长序列的双链DNA。 SG是一种荧光染料, 单独存在时荧光很弱, 但与双链DNA结合之后则具有强烈的荧光。 PFP是一种阳离子共轭聚合物, 可以与双链DNA因静电吸附作用而结合。 因此, 在上述溶液中加入SG和PFP之后, DNA-SG杂合体与PFP紧密结合, 使SG和PFP之间距离很近, 由于PFP的发射峰位置正好与SG的激发峰位置重叠, 因此二者可产生FRET效应。 如果体系中不存在目标分子, 锁式探针将不能成环, 后续的一系列反应都将无法进行, 因此体系不能产生FRET现象。 目标分子的浓度直接关系到扩增产物的含量, 进而影响体系的FRET效率(I520/I423), 因此通过记录体系的I520/I423值可对目标分子进行定量检测。
为了提高方法的分析检测性能, 本文对实验条件进行了考察。
首先对锁式探针、 T4 DNA连接酶、 phi29 DNA聚合酶及dNTPs的浓度进行了优化。 结果表明, 随着四种反应物浓度的增加, 空白均未有明显变化。 而样品的信号随着四种反应物浓度的增加, 均先增加, 达到最大值后变化趋缓, 根据优化结果, 选择100 nmol· L-1锁式探针、 20 U T4 DNA 连接酶、 0.5 U phi29 DNA聚合酶及125 μ mol· L-1 dNTPs作为后续实验的最佳用量。
然后对PFP的用量进行了优化, 结果表明, 随着PFP浓度的增加, 空白的FRET效率(I520/I423)变化不大, 样品的I520/I423值呈先不变而后降低的趋势, 这是因为随着PFP用量的增加, 扩增杂交产物相对不足, 造成没有足够的能量受体所致。 最终选择PFP的最佳用量为150 nmol· L-1。
利用最优化的实验条件, 详细考察和评价了本文提出的方法对不同浓度let 7a的分析性能, 结果如图2所示。 本实验中FRET效率利用520 nm处和423 nm处的荧光强度比值(I520/I423)来表示, 图中将荧光光谱图在423 nm处进行了归一化处理, 因此通过谱图中520 nm处的荧光强度即可反映出不同浓度的let 7a所引起的FRET效率的变化。 从图2(a)可以看出, 目标分子浓度的增加可引起光谱图中520 nm处荧光强度的持续增大, 图2(b)为目标分子浓度和I520/I423之间的关系图, 从其内插图中可以看出let 7a检测的线性范围为0.05~5 nmol· L-1, 线性方程为Δ (I520/I423)=0.14+0.10c(c/nmol· L-1, R=0.995 1)。
由于PFP具有光捕获和光增强效应, 通常可提高方法的灵敏度, 为了验证这一点, 本文在无PFP参与的情况下, 考察了只加入SG时系统的荧光强度随着let 7a浓度的变化情况。 结果表明, 该方法所能检测的最低let 7a浓度为0.2 nmol· L-1, 而本文提出的FRET方案, 最低let 7a检测浓度为0.05 nmol· L-1, 二者相差四倍, 充分证明了PFP的加入确实达到了提高灵敏度的目的。
利用不同类型的miRNA分子作为干扰物质, 对方法的特异性进行了考察, 结果如图3所示, 其中干扰物质浓度均为2.5 nmol· L-1。 从图中可以看出, 除了let 7b和let 7c之外, 其他物质对本实验基本无干扰。 干扰主要取决于干扰分子与目标分子之间序列的差异, 如果二者差异大, 锁式探针则不能与干扰分子杂交, 进而阻碍了后续的成环反应和滚环扩增, 导致最终干扰较小; 相反, 二者之间序列越接近, 干扰则越大。 本论文选取的六种干扰miRNA中, miR-21和miR-143与目标分子差异最大, 因此它们对let 7a的检测几乎无影响。 其他四种干扰分子均来自let 7家族, 彼此之间序列非常相近, 仅相差1~4个碱基, 尽管如此, let 7g和let 7i也几乎不干扰let 7a的检测, 这是因为二者与let 7a的序列差异正好位于与锁式探针杂交的缺口处, 有效阻止了锁式探针的成环反应。 但let 7b, let 7c与let 7a在探针杂交的缺口处完全相同, 因此二者造成的干扰比较大。
为了评价方法在复杂样品分析方面的潜力, 利用该方案对总RNA样品中的let 7a进行了含量检测。 总RNA样品是使用RNAiso for Small RNA试剂盒从Hela细胞中提取得到, 并采用吸光光度法对其中总RNA含量进行初步定量。 然后, 选取五份该样品, 每份中总RNA含量为0.156 μ g, 其中四份分别加入5, 10, 15和20 fmol的标准let 7a作为加标样品, 利用本方案对上述样品进行检测, 最终得出0.156 μ g总RNA样品中let 7a含量为19.6 fmol, 四个加标样品中let 7a的回收率分别为101.0%, 90.7%, 103.4%和100.9%, 由此可知, 本方法对加标样品测量的回收率基本令人满意, 说明该方法在复杂样品分析中具有一定的应用潜力。
利用SG对双链DNA的染色作用及其与阳离子共轭聚合物之间的荧光共振能量转移现象, 以滚环扩增技术作为信号放大手段, 建立了一种新型的miRNA检测方法。 该方法具有两个明显的优点: (1) 通过掺入SG的方式使滚环扩增产物具有强烈的荧光, 因此无需引入荧光标记的特定DNA探针, 在降低实验成本和简化实验方案方面具有一定的优势。 (2) 利用了以阳离子共轭聚合物作为供体的荧光共振能量转移策略, 阳离子共轭聚合物的荧光放大特性使检测灵敏度得到了一定的提高。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|