作者简介: 胡雪桃, 1992年生, 江苏大学食品与生物工程学院博士研究生 e-mail: 850304658@qq.com
胰蛋白酶生产障碍会阻碍消化过程, 在胰腺组织以外产生胰蛋白酶可能涉及癌症过程。 胰蛋白酶明显增高可能表明胰腺炎或者慢性肾功能衰竭等病症的发生, 它的含量与生命活动息息相关, 简单并及时监测胰蛋白酶含量对疾病的诊断具有重要的参考价值。 因此, 该研究构建氮化碳量子点和金纳米簇(CNQDs和AuNCs)的复合纳米探针检测尿液中胰蛋白酶含量。 通过煅烧三聚氰胺获得氮化碳粉末, 并将氮化碳粉末作为原材料通过溶剂热法合成了发射峰在440 nm的类石墨相氮化碳量子点(CNQDs)。 牛血清蛋白(BSA)和CNQDs两者同时作为还原剂和稳定剂合成了金纳米簇(AuNCs), 且AuNCs吸附在氮化碳量子点表面形成具有双发射性质的CNQD-AuNCs复合荧光纳米材料, 发射波长分别为440 nm(CNQD的发射波长)和650 nm(AuNC的发射波长)。 由于胰蛋白酶能特异性的水解CNQD-AuNCs中的牛血清蛋白, 导致牛血清蛋白结构被破坏, 从而破坏AuNCs稳定的结构, 使得其沉淀聚集, 引起荧光猝灭。 由于AuNCs产生的650 nm处的荧光被猝灭, 而CNQDs产生的440 nm处的荧光不受影响, CNQD-AuNCs复合荧光纳米探针产生比率型荧光信号响应。 利用比率型荧光信号的变化情况, 可实现胰蛋白酶的定量检测。 CNQD-AuNCs探针在650 nm处的荧光强度随着胰蛋白酶浓度的增加而逐渐下降, 而440 nm处的荧光强度保持不变。 胰蛋白酶在一定浓度下(10~400 ng·mL-1)与荧光强度比值( I650 /I440)呈良好的线性关系, 建立的线性方程为 y=2.471-0.004 x[ y为荧光强度比值( I650 /I440), x为胰蛋白酶的浓度(ng·mL-1)], 相关系数( R2)高达0.997 6, 检测限为1.5 ng·mL-1(3倍信噪比)。 利用建立的荧光法检测尿液中胰蛋白酶(实际含量分别为50, 100和150 ng·mL-1), 检测得到的平均含量分别为52.41, 103.25和154.39 ng·mL-1。 尿液中胰蛋白酶的回收率和相对标准偏差范围分别为102.93%~104.82%和3.57%~4.16%。 结果表明, 利用荧光强度比值( I650 /I440)作为胰蛋白酶定量检测的信号, 能够校正外界影响因素的干扰, 克服单一荧光信号易受光漂白、 探针浓度、 激发光强度以及光程等外界因素的影响的缺点。 基于CNQD-AuNCs建立的比率型荧光分析方法能够实现尿液中胰蛋白酶的高灵敏度和高特异性检测, 为实际样品中胰蛋白酶的检测提供科学依据。
Low level of trypsin has adverse impacts on digestion, and the obvious increase of trypsin may indicate the occurrence of pancreatitis or chronic renal failure. In addition, the secretory of trypsin outside of pancreatic tissue may involve a precursor to cancer. Trypsin concentration is closely related to life activities. Simple and timely monitoring of trypsin content can provide important reference value for disease diagnosis. Therefore, a sensitive and rapid fluorescent method was developed for determination of trypsin in urine based on carbon nitride quantum dots (CNQDs) and gold nanoclusters (AuNCs). CNQDs was synthesized via solvothermal treatment of bulk carbon nitride (C3N4) powder which was obtained by calcining melamine. The CNQDs displayed blue emission under radiation of UV light at 365 nm and the fluorescent band was at 440 nm. Albumin bovine serum (BSA) and CNQDs were used as reducing agents and stabilizers to prepare AuNCs which absorbed on the surface of CNQDs forming CNQD-AuNCs. CNQD-AuNCs with dual emission wavelengths at 440 and 650 nm displayed red fluorescence under radiation of UV light at 365 nm. BSA and AuNCs structure can be destroyed leading to aggregation of AuNCs in the presence of trypsin owing to the hydrolysis of BSA catalyzed by trypsin. Emission at 650 attributed to AuNCs is quenched and emission at 440 nm produced by CNQDs remain unchanged. The detection of trypsin can be performed by using fluorescent responses of CNQD-AuNCs. Fluorescent intensity at 650 nm gradually decreased with increasing trypsin concentration, while fluorescent intensity at 450 nm stayed unchanged. The ratio of fluorescent intensities at 650 and 440 nm had a perfect linear correlation with the concentrations of trypsin in the range of 10~400 ng·mL-1 with a good coefficient ( R2=0.997 6). The linear regression equation was y=2.471 ~0.004 x, where x was the concentration of trypsin (ng·mL-1), and y represented ratio of intensity at 650 and 440 nm. Limit of detection (LOD) for trypsin was calculated to be 1.5 ng·mL-1 at a signal-to-noise ratio of 3. The concentration of trypsin in urine (the actual concentration was 50, 100 and 150 ng·mL-1) detected by this ratiometric method was 52.41, 103.25 and 154.39 ng·mL-1, respectively. The recoveries of trypsin were 102.93%~104.82% with relative standard deviations of 3.57%~4.16%. AuNC@CNQDs nanosensor provide build-in self-calibration for correction of a variety of unfavorable factors by using the ratiometric responses as signals to detect trypsin. The ratiometric method can overcome shortcomings of signal response which is susceptible to effects of external factors such as light bleaching, nanosensor concentration, excitation light intensity and optical path, and so on. In summary, the developed method has been applied for detection of trypsin in urine with high sensitivity and selectivity, providing scientific basis for detection of trypsin in real application.
胰蛋白酶在胰腺中形成, 能水解肽链相连的氨基酸类化合物, 能够有效地消化蛋白质, 是人体最重要的消化酶之一[1]。 胰蛋白酶生产障碍会阻碍消化过程, 在胰腺组织以外产生胰蛋白酶可能涉及癌症过程[2]。 在正常人的尿液中基本不含胰蛋白酶, 但是急性胰腺炎病人及慢性肾功能衰竭病人的胰蛋白酶会明显增高, 半数以上的胰腺癌及慢性胰腺炎病人的胰蛋白酶也会增高。 因此, 简单并及时监测胰蛋白酶含量对疾病的诊断具有重要的参考价值。
目前, 检测胰蛋白酶的方法包括电化学法[3]、 荧光分析法[4]、 分光光度法[5]、 表面增强拉曼光谱法[6]等。 分光光度法容易受到复杂样品本身颜色的影响。 电化学法和表面增强拉曼光谱法容易受到环境等外界因素的影响。 荧光分析法因其灵敏度高、 选择性强且操作简便受到了研究者的广泛关注, 但传统的荧光分析法需要特殊的荧光染料标记, 使得检测成本偏高[7]。 因此, 开发低成本以及高灵敏度的胰蛋白酶荧光探针是研究的热点。
类石墨相氮化碳量子点(graphitic nitride carbon quantum dots, CNQDs)不含金属元素(由碳和氮元素组成), 具有类石墨烯结构, 其制备成本低, 合成简单, 具有明显的荧光特性、 良好的水溶性、 优良的生物相容性以及无毒性[8]。 这些优异的特性使得类石墨相氮化碳量子点备受关注, 有望取代传统的量子点(如CdTe量子点)[9]。 因此本研究将类石墨相氮化碳量子点应用于胰蛋白酶的检测。
以牛血清蛋白(BSA)为模板合成的金纳米簇(AuNCs)作为荧光探针已经成功用于胰蛋白酶的检测[10]。 但利用金纳米簇单一的荧光信号进行定量分析时, 所得结果易受光漂白、 探针浓度、 激发光强度以及光程等外界因素的影响。 而比率型的荧光探针建立在两个荧光信号的基础上, 可以克服单一型荧光材料的缺点, 因而具有更广泛的应用范围[11]。 因此, 本研究将利用金纳米簇和类石墨相氮化碳量子点的复合纳米材料构建比率型的荧光探针, 并用于尿液中胰蛋白酶定量分析。
聚乙二醇(PEG 200)和三(羟甲基)氨基甲烷(Tris)来源于上海阿拉丁生化科技股份公司。 三聚氰胺、 四氯金酸、 牛血清蛋白(BSA)、 胰蛋白酶等其他试剂购自国药集团化学试剂有限公司。 实验所用的水均是超纯水设备(Milli-Q, Millipore)提供。 透射电子显微镜(TEM, 日本JEOL公司)和中红外光谱仪(Thermo Fisher iS50, USA)用于材料的表征。 荧光光谱仪(F-98, 上海棱光有限公司)用于实验中荧光光谱的获取。
CNQDs的制备主要分为两步[12, 13]: (1)煅烧三聚氰胺粉末得到粉末状的C3N4; (2)利用溶剂热法加热块状的C3N4得到CNQDs。 具体步骤为: 首先称取10 g三聚氰胺放于600 ℃马弗炉中煅烧2 h。 得到黄色的粉末状C3N4; 其次, 将30 mg的C3N4溶于3 mL PEG 200中, 并加入0.45 mL浓KOH; 搅拌15 min后, 将溶液转移至反应釜中, 在180 ℃下反应16 h; 冷却至室温后, 将反应液用孔径为0.22 μ m的有机膜进行抽滤, 收集滤液在截留分子量为1 000 KD的透析袋中透析24 h, 将透析得到的溶液定容至100 mL待用。
合成CNQD-AuNCs的具体步骤为[11]: 将20 mL的CNQDs和5 mL牛血清蛋白溶液(50 mg· mL-1)混合搅拌2 h, 随后加入5 mL四氯金酸溶液(10 mmol· L-1, 37 ℃), 37 ℃下搅拌混合10 min后加入1 mL浓氢氧化钠溶液, 此时反应液的pH约为12, 溶液在37 ℃下持续搅拌12 h, 得到了CNQD-AuNCs复合纳米材料。 使用前将CNQD-AuNCs稀释10倍使用。
取制备好的1 mL CNQD-AuNCs复合纳米探针置于5 mL的比色试管中, 并加入0.5 mL不同浓度的胰蛋白酶, 并用Tris-HCl缓冲溶液(pH为8且含有5 mmol· L-1 CaCl2)定容到5 mL。 在37 ℃下反应2 h后采集荧光信号, 根据荧光信号随胰蛋白酶浓度的变化情况建立检测胰蛋白酶的标准曲线。 同时研究了一些蛋白酶和离子对CNQD-AuNCs荧光的影响。
利用建立的方法对来自健康人体的新鲜尿液中胰蛋白酶进行加标回收实验。 20 mL样品静置0.5 h后, 取上清液10 mL装入透析袋中透析24 h[7]。 为了得到含有胰蛋白酶的尿液样品, 我们向尿液样品中加入不同浓度的胰蛋白酶, 最终得到了胰蛋白酶浓度为分别50, 100和150 ng· mL-1的尿液样品。 最后按照1.3中的方法对加标样品中胰蛋白酶含量进行检测。
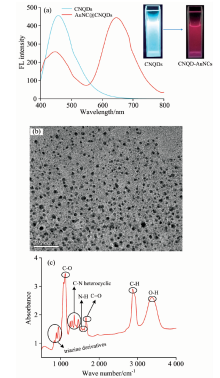
由图1(a)的CNQDs和CNQD-AuNCs的荧光光谱曲线以及荧光图片可以看出: 在365 nm紫外灯的照射下, CNQDs显示蓝色的荧光而CNQD-AuNCs显示红色的荧光。 在365 nm的激发光激发下, CNQDs在440 nm有明显的发射峰, CNQD-AuNCs在440和650 nm均有明显的发射峰。 表明本研究成功合成了具有双发射性质的CNQD-AuNCs荧光纳米材料。 图1(b)和(c)分别为CNQD-AuNCs纳米粒子的TEM照片和傅里叶红外光谱FTIR谱图。 由TEM图[图1(b)]发现CNQD-AuNCs纳米粒子是单一分散的小颗粒, 统计后的平均粒径为(7± 2.42) nm。 CNQD-AuNCs的FTIR光谱峰有3 360, 2 875, 1 956, 1 659, 1 580, 1 543, 1 456, 1 405, 1 351, 1 295, 1 250, 1 122, 940, 887和830 cm-1。 830和887 cm-1主要对应的是三嗪类化合物; 1 250~1 450 cm-1之间的光谱峰是由于含氮的杂环化合物引起的; 1 543和1 580 cm-1分别是由于酰胺中的N— H键的弯曲振动以及N=N键的伸缩振动引起。 1 122和1 659 cm-1分别对应的是C— O和C=O键的伸缩振动峰; 2 875 cm-1主要是由C— H伸缩振动引起的。 这些都表明两种材料的表面都存在大量的氨基羟基和羧基[9]。 通过观察CNQD-AuNCs的FTIR光谱峰, 发现S— H在~2 500 cm-1左右没有出现明显的伸缩振动峰, 说明在合成复合纳米材料的过程中, BSA中的巯基与金离子结合, 作为稳定剂使金或者金离子聚集形成金纳米簇[12], 使S— H的光谱峰消失。
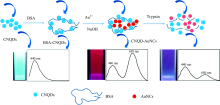
基于BSA-AuNCs合成及其检测胰蛋白酶的原理[13], 图2阐述了比率荧光纳米材料(CNQD-AuNCs)的构建的及其检测胰蛋白酶的原理。 根据已有文献报道牛血清蛋白既能作为还原剂(氨基酸残基), 又能作为稳定剂(半胱氨酸的巯基), 而氮化碳量子点主要是作为稳定剂存在(合成纳米簇的核心, 使纳米簇附着在量子点表面), 其次由于其表面含有氨基和羧基, 因此氮化碳量子点也具有微弱的还原性。 因此, 两者同时都能作为还原剂和稳定剂合成CNQD-AuNCs加入射型的荧光纳米探针, 两个荧光发射峰波长分别是440 nm(CNQDs)和650 nm(AuNCs)。 有文献表明[13], 牛血清蛋白是胰蛋白酶的有效反应底物, 向BSA-AuNCs体系中加入胰蛋白酶时会破坏AuNCs的结构, 使体系的荧光被猝灭, 从而实现胰蛋白酶的检测[10]。 因此, 当CNQD-AuNCs存在胰蛋白酶时, AuNCs产生的荧光峰(650 nm处)会被猝灭, 而CNQDs产生的荧光峰(440 nm处)基本会保持不变。 本研究设计合成了CNQD-AuNCs复合荧光纳米材料, 该材料具有双发射性质, 且能够对胰蛋白酶产生特异性荧光信号响应。 根据两个荧光峰强度的比值(I650/I440)变化情况可实现胰蛋白酶比率荧光检测分析。
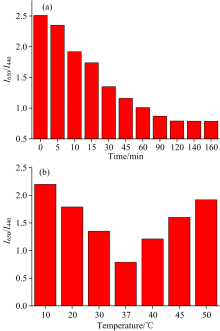
为了提高检测的灵敏度, 获得低的检测限, 我们优选出反应时的最佳参数, 如最佳的反应pH值, 反应时间和反应温度。 根据文献报道[10], 胰蛋白酶在pH为8, 且有Ca2+存在的情况下, 具有较高的活性, 因此我们选用pH为8且含CaCl2(浓度为5 mmol· L-1)的Tris-HCl作为实验的缓冲液。 将稀释的荧光纳米探针(1 mL)与最终浓度为400 μ g· mL-1胰蛋白酶混合, 并用所配制的Tris-HCl缓冲液将其定容至5 mL, 37 ℃水浴下反应5, 10, 15, 30, 45, 60, 90, 120, 140和160 min。 通过扫描荧光光谱曲线, 得到了不同反应时间下的荧光强度变化情况[图3(a)]。 实验发现, 刚开始胰蛋白酶水解BSA的速度非常快, 15 min后, I650/I440下降了40%, 之后反应速度逐渐下降。 待反应120 min后, 荧光强度几乎保持不变, 显示胰蛋白酶水解BSA的反应完成。 因此将120 min作为反应的最佳时间。 因为胰蛋白酶是一种蛋白酶, 温度过低会抑制酶的活性, 温度过高会使蛋白质变性, 失去活性, 因此需要对反应的温度进行优化。 将CNQD-AuNCs(1 mL)与胰蛋白酶混合, 并利用Tris-HCl缓冲液将其定容到5 mL, 此时胰蛋白酶的浓度为400 ng· mL-1。 在温度为10, 20, 30, 37, 40, 45和50 ℃水浴中反应120 min。 通过获得荧光光谱曲线, 得到了不同反应温度下的荧光强度变化情况[图3(b)]。 我们发现在37 ℃水浴中, 其活性最佳, 反应最快, 荧光下降最明显, 故选取37 ℃作为实验的最佳温度。 这些最佳反应参数与已有的文献报道相一致[10]。
将不同浓度的胰蛋白酶与CNQD-AuNCs(1 mL)混合, 并用Tris-HCl缓冲溶液定容到5 mL, 37 ℃水浴中反应120 min。 不同浓度胰蛋白酶下探针溶液的荧光光谱曲线如图4(a)所示。 随着胰蛋白酶浓度的升高, 荧光探针在650 nm处的荧光强度降低, 而440 nm处的荧光强度几乎保持不变。 当胰蛋白酶的浓度高于400 ng· mL-1时, 650 nm处的荧光强度达到稳定状态。 以荧光强度的比值(I650/I440)为纵坐标, 胰蛋白酶的浓度为横坐标(10~400 ng· mL-1)建立检测胰蛋白酶的标准曲线。 由图4(b)中可见, I650/I440与胰蛋白酶浓度在10~400 ng· mL-1呈线性关系, 线性方程为y=2.471-0.004x(R2=0.997 6)。 检测限为1.5 ng· mL-1(3倍的信噪比)。 为了体现比率型荧光法的优越性, 本研究将单一的荧光信号(I650)为纵坐标, 胰蛋白酶的浓度为横坐标(10~400 ng· mL-1)建立检测胰蛋白酶的标准曲线[图4(c)], 结果发现, I650与胰蛋白酶浓度在10~400 ng· mL-1呈线性关系, 线性方程为y=216.15-0.397 5x(R2=0.987 2)。 根据检测限计算公式(3倍的信噪比), 其检测限为9.1 ng· mL-1。 另外, 通过与已有文献对比(表1)[4, 10, 14, 15, 16], 发现本研究的检测范围宽(10~400 ng· mL-1/0.417~16.667 nmol· L-1), 检测限低(1.5 ng· mL-1/0.062 5 nmol· L-1), 所建立的荧光方法能够实现胰蛋白酶的超灵敏、 准确检测。
| 表1 本研究建立的方法检测结果与其他方法检测结果的对比 Table 1 The performance of results obtained by this method and other methods |
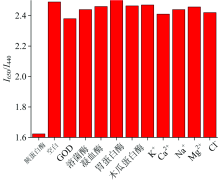
本实验选择了一部分离子(K+, Ca2+, Na+, Mg2+, Cl-), 一些常见的酶(葡萄糖氧化酶(GOD), 溶菌酶, 凝血酶, 胃蛋白酶, 木瓜蛋白酶), 测定他们对CNQD-AuNCs荧光特性的影响。 如图5所示, 与空白样的荧光比值比较发现只有加入胰蛋白酶(200 ng· mL-1)时引起了荧光比值的降低, 而其他的干扰成分(400 ng· mL-1)的加入没有引起荧光的变化。 以上结果表明, 本研究制备的CNQD-AuNCs能够实现胰蛋白酶的特异性检测。
为了测试CNQD-AuNCs在实际样品中的应用效果, 将建立的方法应用于尿液的检测分析。 样品经预处理后, 采用加标回收的方法进行检测研究。 尿液中加入不同浓度的胰蛋白酶标准溶液, 然后在同样的实验条件下对样品进行检测, 每个浓度平行测定3次, 结果列于表2。 由结果可见, 本方法检测尿液样品中的胰蛋白酶的加标回收率(Recovery)为102.93%~104.82%, 其相对标准差(RSD)分别为3.74%, 4.16%和3.57%。 结果表明本研究建立的方法可应用于实际样品中胰蛋白酶的检测。
| 表2 尿液中胰蛋白酶加标检测结果 Table 2 Analytical results of trypsin in urine |
构建了具有双发射性质(440和650 nm)的CNQD-AuNCs比率型复合纳米探针, 并利用该复合探针成功实现了胰蛋白酶的高灵敏检测。 当比率型荧光探针中加入胰蛋白酶时, 该体系中650 nm处的荧光猝灭, 而440 nm处的荧光保持不变。 荧光信号(I650/I440)与胰蛋白酶的浓度(10~400 ng· mL-1)呈良好的线性关系, 相关系数(R2)高达0.997 6, 最低检测线为1.5 ng· mL-1。 另外, 将建立的方法用于尿液中胰蛋白酶的检测分析得到的回收率为102.93%~104.82%, 相对标准差的范围为3.57%~4.16%。 结果表明建立的比率型荧光检测法能够实现尿液胰蛋白酶的简单且准确检测, 能够为实际样品中胰蛋白酶的检测提供重要的科学依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|