作者简介: 陈玉凤, 1985年生, 梧州学院化学工程与资源再利用学院讲师 e-mail: chenyfw@126.com
四丁基溴化铵(TBAB)半笼型水合物在二氧化碳(CO2)捕集和封存技术中具有巨大的发展与应用潜力。 由于晶体结构的复杂性, TBAB半笼型水合物的动力学过程尚未得到充分的研究。 为了解TBAB半笼型水合物在储气方面的动力学特性, 实验采用原位激光拉曼技术和多晶粉末X射线衍射仪(PXRD)对 nCO2·TBAB·26H2O和 nCO2·TBAB·38H2O水合物的光谱特征进行了鉴别与分析, 利用原位激光拉曼技术考察了CO2分子分别进入2种晶体结构的动力学过程。 研究结果表明, 2种晶体结构的拉曼光谱具有较高的相似性, 值得注意的是 nCO2·TBAB·26H2O中位于1 309.5和1 326.9 cm-1的拉曼峰为TBA+阳离子中C—C键的变形振动峰, 在 nCO2·TBAB·38H2O水合物中峰基本不发生改变, 但半峰宽降低, 峰形也变得相对清晰; 同时, nCO2·TBAB·26H2O中位于1 446.6和1 458 cm-1的拉曼峰为TBA+阳离子中C—H键的剪切振动峰, 在 nCO2·TBAB·38H2O水合物中分别向左、 右两边发生了位移, 峰形的重叠度也随之下降。 依据上述2处拉曼光谱特征可以对2种晶体结构进行辨别。 通过PXRD图谱可以发现2种晶体结构的衍射图谱存在着比较明显的差距。 nCO2·TBAB·26H2O晶体属于四方晶系, 空间群( P4 /m), 而 nCO2·TBAB·38H2O属于正交晶系, 空间群( Pmma)。 图谱中2 θ=8.406°和10.941°分别为 nCO2·TBAB·38H2O的(200)和(220)晶面的特征峰, 而2 θ=5.976°和6.969°分别为nCO2·TBAB·26H2O的(012)和(003)晶面特征峰, 可以用来判别样品中水合物的晶体结构。 在原位拉曼测量过程中, nCO2·TBAB·26H2O和 nCO2·TBAB·38H2O分别在已经合成好的TBAB·26H2O和TBAB·38H2O水合物表面形成。 在276 K, 2 MPa条件下, 气相中的CO2分子分别进入2种晶体结构中用于储气的512笼形结构, 在1 275.4和1 379.3 cm-1处形成特征峰并逐渐增长。 实验以2种TBAB水合物位于1 110.3 cm-1的拉曼峰作为参考, 比较了CO2在水合物中的增长速率。 研究发现在反应初期的75 min内CO2在2种水合物中的含量基本保持线性增长且上升速率的差别不大。 由于测量点位于水合物表面, 受气体在水合物中扩散的阻力较小同时2种TBAB水合物均采用512笼形结构储气导致了储气速率相近。 以上的微观晶体结构研究结果对TBAB水合物法捕集和封存CO2技术应用具有重要的意义。
TBAB semi-clathrate hydrate has a huge potential for effective application of carbon dioxide (CO2) capture. Because of the complexity of the crystal structure, the kinetics of TBAB hydrate remains poorly understood. In this work, the spectral characteristics of nCO2·TBAB·26H2O and nCO2·TBAB·38H2O were analyzed by Raman and powder X-ray diffraction (PXRD). To understand the gas storage characteristics of TBAB hydrate, the processes of CO2 molecules entering 2 kinds of crystal structures were measured using in situ Raman spectroscopy. Results showed that the Raman spectra of 2 crystal structures had high similarity. The Raman peaks at 1 309.5 and 1 326.9 cm-1 were assigned to be the C—C deformation vibration mode of TBA+ cations in nCO2·TBAB·26H2O hydrate. They did not shift in nCO2·TBAB·38H2O hydrate, but became detached and narrow in half-peak width. Meanwhile, the peaks at 1 446.6 and 1 458 cm-1 were assigned to be the C—H shear vibration mode of TBA+ cations in nCO2·TBAB·26H2O hydrate. They shifted away from each other and had lower less overlap region in nCO2·TBAB·38H2O hydrate. Those features in Raman spectra were helpful to distinguish the 2 kinds of structures. The PXRD patterns of the 2 TBAB hydrates showed large difference from each other. nCO2·TBAB·26H2O hydrate was tetragonal which had the space group of ( P4 /m), while nCO2·TBAB·38H2O hydrate was orthorhombic which had the space group of ( Pmma). In the PXRD patterns, the peaks at 2 θ=8.406° and 10.941° were (200) and (220) planes of nCO2·TBAB·38H2O hydrate respectively. The structure of nCO2·TBAB·26H2O hydrate was characterized by the (012) and (003) planes at 2 θ=5.976° and 6.969° respectively. During the in situ Raman measurements, nCO2·TBAB·26H2O and nCO2·TBAB·38H2O hydrates grew directly from the prepared TBAB·26H2O and TBAB·38H2O hydrates at 276 K, 2 MPa. The CO2 molecules were captured by the 512 hydrate cages in the 2 kinds of hydrates, formed the characteristic peaks of CO2 at 1 275.4 and 1 379.3 cm-1 and increased continuously. The Raman peaks at 1 110.3 cm-1 were chosen as reference peak to compare the CO2 concentration growth in the 2 kinds of hydrates. In the initial 75 minutes of in situ Raman measurements, the content of CO2 in hydrate phase grew linearly with generally the same growth rates in 2 kinds of crystals. As the measuring spots were on the hydrate surface where the gas diffusion resistance in hydrate phase could be neglected and the cage structures used for gas storage were all 512 cage, the similar gas storage rates were obtained. The microcosmic experimental study provides a theoretical basis for CO2 capture technology by forming TBAB semi-clathrate hydrate.
二氧化碳(carbon dioxide, CO2)的过量排放是导致全球气候变化的主要原因之一。 2014年, 全球二氧化碳浓度达到了百万分之四百, 而且依然保持着快速上升的趋势。 为了控制CO2浓度的快速上升, CO2捕集和封存技术逐渐得到世界各国的重视[1]。 半笼型水合物是一种性能良好的储气材料。 相比于经典的Ⅰ 型、 Ⅱ 型气体水合物, CO2可以在较为温和的条件下, 例如284 K, 0.8 MPa, 稳定的存储在由水分子构成的笼形结构中, 形成CO2半笼型水合物[2]。 同时, 半笼型水合物的储气密度高, 对混合气体中CO2表现出良好的选择吸收的特性[3]。 因此, 半笼型水合物在CO2捕集和封存技术中具有巨大的发展与应用潜力。
半笼型水合物通常由水分子和季铵盐构成。 水分子之间和季铵盐中的阴离子分别通过氢键和弱离子键相互连接, 将作为客体分子的季铵盐阳离子包裹在笼形结构中, 而晶胞中空余的512笼形结构则为捕集CO2分子提供了空间。 四丁基溴化铵(tetrabutylammonium bromide, TBAB)具有低毒性和较好的可降解性, 因此得到了广泛的研究。 TBAB半笼型水合物主要包含2种晶体结构, 分别为TBAB· 38H2O和TBAB· 26H2O[4]。 TBAB· 38H2O水合物晶体结构属于正交晶系(Pmma), 晶胞中包含6个512笼, 4个51262笼和4个51263笼, 2个TBA+阳离子分别被2个51262笼和2个51263笼所包裹; TBAB· 26H2O水合物晶体结构属于四方晶系(P4/m), 晶胞中包含10个512笼, 16个51262笼和4个51263笼, 6个TBA+以2种形式包覆于水合物笼中[5, 6, 7]。 由于2种半笼型水合物中较大的笼形结构, 例如51262笼和51263笼, 均被TBA+阳离子所占据, 只有较小的512笼用来容纳气体分子, 有利于对混合气体的选择性吸收。 大量实验研究表明, TBAB水合物对氢气和氮气中的CO2的捕集效果相比于经典的Ⅰ 型、 Ⅱ 型气体水合物得到了显著提升[8]。
至今, 半笼型水合物的相平衡条件已经有了比较充分的测量。 由于晶体结构的复杂性, 半笼型水合物的动力学过程尚未得到充分的研究。 Oyama等[4]指出TBAB水合物2种晶体结构的相变潜热差异较大, 但在较宽泛的温度和浓度条件下能够共存, 这为TBAB水合物形成动力学过程的分析带来困难。 Nguyen等[9]发现低浓度的TBAB溶液会抑制水合物的形成。 另外, 高压环境下的稀有气体会诱导半笼型水合物发生晶体结构的转变[10, 11]。 因此, 可以推断不同结构的TBAB水合物在动力学特性和热力学稳定性上存在着差异。
在过往对半笼型水合物研究中, 高压二氧化碳通常在水合物形成之前注入反应釜中, 因此, 无法判定溶液中哪一种水合物会率先形成, 也无法判定2种水合物的储气速率上的差异[12]。 激光拉曼光谱法, 因其能够获得水合物的结构、 组成、 笼占有率等重要参数, 已被广泛地用于水合物分析[13]。 为了更好地了解2种TBAB水合物在储气方面的特性, 本实验对每种晶体进行单独制备, 利用拉曼光谱和低温多晶粉末X射线衍射仪(powder X-ray diffractometer, PXRD)对晶体结构进行了测量分析和表征, 最后采用原位激光拉曼考察了晶体在不同CO2压力环境下的储气速率。 这为TBAB水合物法捕集CO2工艺技术提供了理论依据。
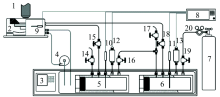
实验所需的原位拉曼装置为自主设计搭建的原位拉曼移动测试平台, 如图1所示。 其中原位拉曼反应釜为不锈钢材质, 底部设有冷却液夹套, 顶部为蓝宝石玻璃窗口, 设计耐压14 MPa。 原位拉曼反应釜两端连接缓冲罐, 用于稳定反应釜内压力。 关于本装置的详细说明可参考文献[14]。 实验采用质量分数高于0.99的四丁基溴化铵, 由东京化学工业株式会社(Tokyo Chemical Industry Co., Ltd.)提供。 CO2气体摩尔浓度不低于0.999, 由南海豪文气体厂提供。 所需的去离子水由实验室制备。
激光拉曼光谱仪采用Horiba, LabRAM HR拉曼光谱仪, 配备有开放式显微镜和Linkam BSC型冷热台, 冷热台采用液氮冷却。 光谱仪采用波长为532 nm的Ar+激光, 测试功率50 mW, 光栅刻线数600线· mm-1。 多晶粉末X射线衍射仪(PXRD)采用PANalyticalX射线粉晶衍射仪, CuKα 射线(λ =1.540 6 Å ), 扫描范围2θ =5° ~70° , 扫描速率4° · min-1, 扫描步长为0.017° 。 PXRD配备TCU100型温度控制单元(Anton Paar), 用来控制样品温度。
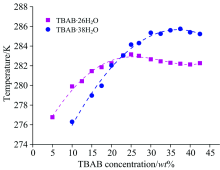
首先在常压下分别制备2种TBAB水合物晶体, 配置条件如表1所示。 在常压下两种晶体具有各自相对独立的相平衡曲线。 图2为TBAB水合物相平衡图, 从图中可以看出2种晶体的TBAB水合物的相平衡曲线存在交叉。 因此, 控制合成溶液中TBAB的浓度和温度处于两条相平衡曲线之间即可以有效抑制两种晶体同时在溶液中生成。 TBAB· 26H2O晶体呈方形的薄片, 在溶液底部螺旋堆叠生长; 而TBAB· 38H2O晶体在溶液的底部和气液接触面出现, 呈针状并以晶簇中某点为核心放射状生长[15]。 当晶体从溶液中析出后, 将晶体取出, 并在低温环境下将晶体表面残留的溶液用滤纸拭干。 最后, 将得到的晶体放入盛有液氮的研钵中充分研磨, 得到的粉体放入冻存管中备用。
| 表1 TBAB半笼形水合物合成条件 Table 1 Formation conditions of TBAB semi-clathrate hydrate |
在PXRD低温测试中, 先将低温冷台冷却至233 K, 然后将研磨好的粉体放在低温载物台上进行测试。 在原位激光拉曼测试中, 先将载物台预冷至设定温度, 然后将液氮中保存的水合物粉体快速转移至载物台上。 当温度恒定以后, 在水合物粉末表面选定待测点。 最后, 向原位拉曼反应釜注入一定压力的CO2气体并利用原位激光拉曼对测量点进行定期扫描, 扫面间隔为5 min。
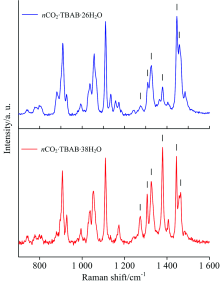
图3为nCO2· TBAB· 26H2O和nCO2· TBAB· 38H2O的激光拉曼图谱。 可以看出2种晶体结构中的客体分子相同, 其光谱的差异并不大。 但是, 由于客体分子所处的笼形结构不同, 部分峰的形状存在一定差异。 nCO2· TBAB· 26H2O中位于1 309.5和1 326.9 cm-1的拉曼峰为C— C键的变形振动峰, 在nCO2· TBAB· 38H2O水合物中峰位移基本不发生改变, 但半峰宽降低, 峰形也变得相对清晰。 同时, nCO2· TBAB· 26H2O中位于1 446.6和1 458 cm-1的拉曼峰作为C— H键的剪切振动峰, 在nCO2· TBAB· 38H2O水合物中分别向左、 右两边发生了位移, 且峰形的重叠度也随之下降。 由于2种半笼型水合物只有512小笼可以容纳CO2分子, 因此, 在CO2的特征峰基本保持不变, 分别位于1 275.4和1 379.3cm-1, 与参考文献[13]一致。 另外, 从图3中可以看出CO2分子在nCO2· TBAB· 38H2O中的相对拉曼峰强要明显高于nCO2· TBAB· 26H2O, 表明nCO2· TBAB· 38H2O水合物的储气能力要高于nCO2· TBAB· 26H2O。
图4为nCO2· TBAB· 26H2O和nCO2· TBAB· 38H2O的PXRD图谱。 由于nCO2· TBAB· 26H2O晶体属于四方晶系, 而nCO2· TBAB· 38H2O属于正交晶系, 因此衍射图谱存在着比较明显的差异。 可以看到2θ =8.406° 和10.941° 分别为nCO2· TBAB· 38H2O的(200)和(220)晶面的特征峰, 而2θ =5.976° 和6.969° 分别为nCO2· TBAB· 26H2O的(012)和(003)晶面特征峰。 因此, 依据PXRD谱图可以对2种晶体结构进行比较清晰的判别。
在276 K, 2 MPa条件下, 对2种半笼型水合物的储气过程进行了原位拉曼测量。 图5为TBAB· 26H2O和TBAB· 38H2O水合物原位拉曼图谱。 由于两种水合物晶体均可在276 K保持结构稳定, 因此, 初期过程中晶体不会发生剧烈相变, 同时体积也不会发生明显的改变, 有利于原位观测过程的进行。 从图中可以看到, 2种水合物的图谱基本不发生改变, 证明了晶体结构在储气过程中良好的稳定性。 然而, 依然可以看到在位于CO2气相峰(1 284.3和1 387.5 cm-1)左侧存在2个小峰逐渐上升。 这2个拉曼峰位于1 275.4和1 379.3 cm-1, 即为CO2在512小笼中的峰位[13]。
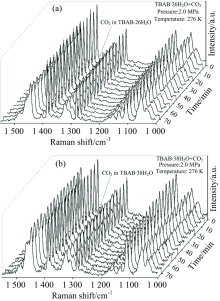 | 图5 TBAB· 26H2O (a)和TBAB· 38H2O (b) 水合物原位拉曼图谱Fig.5 In situ Raman spectra of TBAB· 26H2O (a) and TBAB· 38H2O (b) |
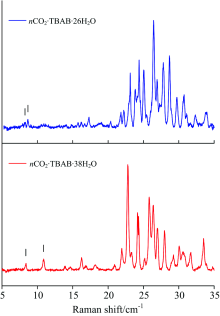
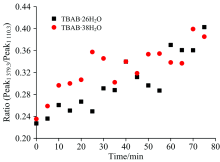
为了进一步对两种TBAB水合物的储气速率进行定量分析, 对CO2在1 379.3 cm-1处拉曼峰的峰面积进行计算。 由于激光拉曼测量样品表面某一点的光谱信息, 在不同测试点所表现出来的光谱峰强存在较大的差异, 因此, 实验以各自TBAB水合物位于1 110.3 cm-1的拉曼峰作为参考, 如图6所示。 位于1 110.3 cm-1的拉曼峰属于TBAB中C— C键的拉曼振动峰, 该峰在TBAB水合物的储气过程中峰强不发生改变且峰形相对独立, 有利于进行峰面积计算。 尽管晶体结构存在着差异, 2种晶体结构的水合物在储气过程的前75 min内基本保持线性增长且上升速率的差别不大。 这主要因为测量点位于水合物表面, 受气体在水合物中扩散的阻力较小。 另外, CO2分子均存储于512笼形结构中, 进笼所需克服的能垒基本相同, 因此在外部环境条件相同的情况下, CO2分子的进笼速率也基本相同。
采用激光拉曼和PXRD对TBAB· 26H2O和TBAB· 38H2O水合物的光谱特性进行了分析, 利用原位激光拉曼测量了276 K, 2 MPa条件下, CO2分子分别进入2种晶体结构的动力学过程。 研究结果表明, 位于1 309.5和1 326.9 cm-1的C— C键变形振动峰和位于1 446.6和1 458 cm-1的C— H键剪切振动峰在TBAB· 38H2O水合物中相比于TBAB· 26H2O水合物半峰宽较小, 峰形更加独立, 有利于对2种晶体进行辨别。 同时, CO2分子在水合物中峰位分别位于1 275.4和1 379.3 cm-1。 原位激光拉曼测量结果发现, 在反应初期的75 min内CO2在2种水合物中的含量基本保持线性增长且上升速率的差别不大。 2种晶体结构中用于储气的笼形结构相同以及储气环境的相同可能是导致储气速率相同的主要原因。 以上的微观实验结果为TBAB水合物法捕集CO2工艺技术的应用提供了理论依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|