作者简介: 周丹蕾, 1982年生, 北京理工大学生命学院博士后 e-mail: zhoudanlei106@163.com
胞红蛋白(Cygb)是珠蛋白家族中一个近期发现的血红素蛋白, 含有血红素辅基, 能在卟啉环的铁原子上可逆地结合氧分子, 在储存和传递氧中起着重要作用, 其C38和C83处含有半胱氨酸。 对Cygb上半胱氨酸进行修饰可影响其结合氧的功能。 用化学试剂4,4’-二吡啶二硫(4-PDS)、 N-乙基马来酰亚胺(NEM)、 氧化型谷胱甘肽(GSSG)和二硫苏糖醇(DTT)对纯化的胞红蛋白进行修饰, 以分别生成胞红蛋白分子内二硫键(Cygb-SS)、 胞红蛋白硫醚键(Cygb-SC)、 分子间二硫键(Cygb-SSG)及胞红蛋白自由巯基(Cygb-SH)。 修饰效果用4,4’-二吡啶基二硫(4-PDS)光谱法进行检测, 该方法通过测量修饰的胞红蛋白中自由巯基的含量来计算修饰率。 在Cygb-SS和Cygb-SC样品中检测到巯基浓度比样品浓度的十分之一还低, 说明胞红蛋白上的自由巯基已被4-PDS和NEM所占据; Cygb-SSG样品中检测到巯基浓度与蛋白浓度相当, 说明Cygb分子中有一个巯基参加了反应, 由于Cygb空间位阻的存在, 另一个巯基没有改变仍以自由状态存在; Cygb-SH样品中巯基浓度是蛋白浓度的两倍说明一个Cygb分子中含有两个自由巯基。 通过分别检测这四种Cygb中自由巯基的含量便可知道其修饰产率。 结果表明上述化学试剂均成功地修饰了胞红蛋白, 修饰率达到90%以上。 将4-PDS光谱法用于检测胞红蛋白化学修饰效果, 通过测半胱氨酸巯基浓度验证了该方法的可行性。 综上说明4-PDS光谱检测法准确可靠, 是对经典Ellman试剂法的补充, 更适用于吸收峰在410~420 nm的化合物巯基含量测定。
Cytoglobin (Cygb), a member of globin family, is a hemeprotein which was discovered 15 years ago. It contains a prosthetic group heme, which can reversibly bind an oxygen molecule between the iron ion of the porphyrin ring and a histidine of the polypeptide chain and play an important role in storing and delivering oxygen. There are two cysteines in C38 and C83 site of Cygb. Modification of the cysteine on Cygb can affect the oxygen-binding function of Cygb. In this article, chemical reagent 4, 4’- dithiodipyridine (4-PDS), N-ethylmaleimide (NEM), Oxidized Glutathione (GSSG) and Dithiothreitol (DTT) were used for modifying Cygb to intramolecular disulfide bond (Cygb-SS), thioether bonds (Cygb-SC), intermolecular disulfide bond (Cygb-SSG)and free sulfhydryls (Cygb-SH) respectively. The modified effect and product yield were detected by 4, 4’-dipyridine disulfide (4-PDS) spectroscopy method which can calculate modified rate by measuring the free sulfhydryl content in modified Cygb. The concentration of sulfhydryl in Cygb-SS and Cygb-SC samples is lower than one-tenth of the concentration of Cygb, indicating that the free sulfhydryl on the Cygb has been occupied by 4-PDS and NEM; The concentration of sulfhydryl in Cygb-SSG sample is comparable to that of the protein, indicating that one sulfhydryl in Cygb molecule participated in the reaction. Due to the steric hindrance of Cygb, the other sulfhydryl remained unchanged in the free sulfhydryl state; Double the concentration of sulfhydryl in the Cygb-SH sample as compared to the concentration of the Cygb indicates that one Cygb molecule contains two free sulfhydryl. We can know the modified yield by detecting the free sulfhydryl content of the four Cygbs respectively. The results showed that the four chemical reagents successfully modified cysteines on Cygb, and that the product yield reached more than 90%. This article measures the modified effect of Cygb by 4-PDS spectroscopy method and verifies the feasibility of this method by cysteine. In summary, the 4-PDS spectrometry method is accurate and reliable, which is complementary to the classical Ellman’s reagent method, and is more suitable for determining the content of sulfhydryl of compounds with absorption peak at 410~420 nm.
珠蛋白家族是一类在细菌、 真菌、 植物和动物中普遍存在的呼吸性蛋白, 它们具有相似的一级结构和三级结构, 含有血红素辅基, 能在卟啉环的铁原子上可逆地结合氧分子, 在储存和传递氧中起着重要作用[1]。 胞红蛋白(Cytoglobin, Cygb)属于珠蛋白家族中最近被发现的成员[1, 2, 3], 广泛表达于心肌细胞[4]、 成纤维细胞[5]、 血管平滑肌细胞[6]及肝星状细胞[7]等多种细胞[8]。 据报道胞红蛋白具有储存传递氧、 代谢NO[9, 10]、 参与胶原合成抑制纤维化[11]、 清除体内活性氧物种 (active oxygen species, ROS)[12]、 对抗氧化应激的损伤[13]及抗肿瘤[14]和基因调控[15]等多种功能。 最近本课题组还发现Cygb有调节血压和血管紧张度的作用, 为心血管类疾病的研究打下基础[16]。
胞红蛋白单体含有两个暴露的半胱氨酸残基(Cys 38和Cys 83), 它们能在胞红蛋白上形成分子内二硫键[17, 18, 19]。 这种分子内二硫键的形成极大地增加了胞红蛋白上铁离子的内在配体组氨酸的解离常数, 导致外在氧配体的表观结合常数明显增加[18, 19], 从而影响胞红蛋白储存和携带氧的功能。 在缺氧条件下, 分子内二硫键的形成使得Cygb-SS比Cygb-SH和Cygb-SC以Cygb(Fe2+ O2)的形式保存更多的O2。 因此, 对胞红蛋白上巯基进行化学修饰可以改变氧的结合常数并影响其相关功能[20]。
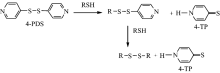
巯基含量的测定方法有多种, 其中Ellman试剂法应用最为广泛, 是经典的测量巯基含量的方法[21, 22]。 但Ellman试剂与巯基反应的生成物在波长 410~420 nm 内具有强吸收[22], 与胞红蛋白在416 nm的吸收峰有冲突[23], 因此无法准确测定样品中的巯基含量。 本实验用4, 4’ -二吡啶基二硫(4, 4’ -dithiodipyridine, 4-PDS)和巯基反应, 生成在波长324 nm处有最大吸收的4-硫代吡啶酮(4-thiopyridone, 4-TP)[24], 反应机理见图1。 该方法在检测胞红蛋白巯基含量, 检验其化学修饰效果上有独特的优势, 是对经典Ellman试剂法的补充, 对于测定在波长410~420 nm内有吸收的巯基化合物中巯基含量有重要参考价值。
紫外可见光谱仪(UV/Vis)型号(8453)、 温度控制仪型号(89090A)及操作软件(美国Agilent公司); 电子分析天平(Mettler Toledo公司); 离心过滤器型号(Ultra-15)(美国Millipore公司)二硫苏糖醇(DTT, C4H10O2S2)、 4, 4’ -二硫代二吡啶(4-PDS, C10H8N2S2)、 N-乙基马来酰亚胺(NEM, C6H7NO2)、 氧化型谷胱甘肽(GSSG, C20H32N6O12S2)、 连二亚硫酸钠(Na2S2O4)、 半胱氨酸(C3H7NO2S)、 乙醇(CH3CH2OH)均为分析纯购于美国Sigma公司
将携带有人胞红蛋白(Cygb)基因的pET3a质粒按照分子生物学方法转化至C41(DE3)pLysS品种的大肠杆菌中进行基因表达[9]。 按文献方法对表达产物中的胞红蛋白进行分离纯化, -80 ℃冰箱保存[25]。
取几支分装好的Cygb样品, 将其合并于一个离心管中, 置于冰上, 加入过量二硫苏糖醇(DTT)反应约20 min用来打开在样品制备过程中形成的二硫键, 使得所有Cygb均以巯基形式(Cygb-SH)存在。 然后将该蛋白质通过Sephadex G-25凝胶柱, 用10 mmol· L-1磷酸缓冲液洗脱以除去过量的DTT。 把所收集的Cygb-SH等分四份用于游离巯基的修饰: 第一份加入终浓度为2 mmol· L-1 N-乙基马来酰亚胺(NEM)使其与巯基进行烷基化反应形成硫碳键(Cygb-SC); 第二份加入终浓度为4 mmol· L-1 4, 4’ -二硫代二吡啶(4-PDS)使其与巯基反应促使Cygb二硫键形成(Cygb-SS), 4-PDS需要先用10%体积的乙醇溶解, 然后加入90%体积的缓冲液; 第三份加入终浓度为4 mmol· L-1氧化型谷胱甘肽(GSSG)使其与巯基反应形成(Cygb-SSG); 第四份不加任何试剂维持自由巯基(Cygb-SH)的形式[26](低温下可保持样品稳定), 以上反应均在室温下进行1 h。 反应完成后, 用Ultra-15离心过滤器浓缩样品, 最后将化学反应后的样品再次通过G-25柱以除去过量的小分子反应物。 收集所得样品, 取出少量用于检测, 其他样品置于-20 ℃保存。
采用半胱氨酸(Cys)作为巯基标准物, 精密称取一定量的半胱氨酸加入PBS缓冲液配置成浓度为1, 5, 10, 20和50 μ mol· L-1巯基标准液。 精密称取4-PDS 4 mg先溶解于20 μ L乙醇中, 然后加入180 μ L PBS缓冲液配置成10 mmol· L-1的母液。 分别向不同浓度的半胱氨酸加入终浓度为100 μ mol· L-1的4-PDS使其反应15 min后作为样品进行检测。 打开紫外可见光谱仪, 分别对空白缓冲液、 不同浓度的Cys、 终浓度为100 μ mol· L-1的4-PDS和不同样品进行200~800 nm全波长扫描, 空白缓冲液作为基线, 并记录Cys和4-PDS在324 nm处吸光值为A324p和A324r, 样品在324 nm处吸光值记为A324s。 据文献报道, 反应物产物4-PT在324 nm处的消光系数Δ ε 324=21 400 M-1· cm-1[27], 按照方程(1)可计算巯基浓度。
巯基浓度和半胱氨酸浓度的比值[SH]/[Cys]即为半胱氨酸中巯基数目。 半胱氨酸作为标准物可以用来检验该方法的可行性。
分别将四种经过修饰的Cygb取20 μ L分两组置于离心管中, 第一组分别加入280 μ L缓冲液, 第二组分别加入280 μ L终浓度为100 μ mol· L-1的4-PDS溶液使其反应15 min后待测。 打开紫外可见光谱仪, 分别对空白缓冲液、 不同化学修饰的Cygb(Cygb-SH, Cygb-SC, Cygb-SS, Cygb-SSG)、 终浓度为100 μ mol· L-1的4-PDS和四种与4-PDS反应后样品进行200~800 nm全波长扫描, 空白缓冲液作为基线, 并记录Cygb和4-PDS在324 nm 处吸光值A324p和A324r, 样品在324 nm处吸收值为A324s。 同时记录不同修饰的胞红蛋白在416 nm处的吸光值A416 s。 按照方程(1)可计算巯基浓度[27]。
Cygb在416 nm处的消光系数Δ ε 416=100 000 M-1· cm-1, 按照方程(2)可计算蛋白浓度。
巯基浓度和修饰的Cygb的比值[SH]/[Cygb]即为Cygb中巯基数目。
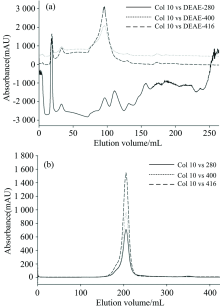
将携带有人Cygb基因的质粒转化至大肠杆菌中。 筛选含有该基因的阳性单菌落, 接种于少量肉汤培养基中培养, 并诱导其表达, 得到含有大量可溶性的Cygb的暗红色湿菌体。 将湿菌体裂解、 离心得到暗红色上清液, 依次通过HiPrep 16/10 DEAE FF阴离子交换柱和HiPrep 26/60 S-300HR聚丙烯酰胺葡聚糖凝胶柱进行纯化。 用280, 400和416 nm三个波长同时检测, 结果如图2所示。
由图2可知, 经过两次过柱纯化, 可获得一定量纯度较高的胞红蛋白备用。
已知一个半胱氨酸分子中含有一个巯基, 因此选用半胱氨酸作为巯基标准物, 用来检验4, 4’ -二吡啶基二硫(4-PDS)测巯基方法的可行性。 已知半胱氨酸标准液浓度为1, 5, 10, 20和50 μ mol· L-1, 按照上述方法使不同浓度的半胱氨酸与4-PDS反应, 然后做全波长扫描, 如图3所示。
记录324 nm吸光值, 按照方程(1)计算出不同浓度半胱氨酸中巯基的浓度。 结果如表1所示。
由表1得出半胱氨酸浓度与巯基浓度的比值接近于1, 意味着每个半胱氨酸上有一个巯基, 与事实相符。 验证了该方法的可行性。
| 表1 半胱氨酸浓度与测量的巯基浓度对比 Table 1 Comparison between the cysteine concentration and the measured sulfhydryl concentration |
2.3.1 胞红蛋白与4-PDS反应时间的考察
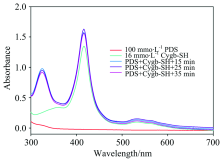
按照实验方法1.5操作, 4-PDS的浓度为100 μ mol· L-1, 分别和胞红蛋白反应15, 25和35 min后, 于波长324 nm处测量, 结果见图4所示。 结果证明, 从15~35 min, 巯基还原4-PDS的生成物4-TP较稳定, 吸光值变化不大。
2.3.2 胞红蛋白巯基含量测定
按照实验方法1.5操作, 将四种胞红蛋白修饰样品分别与100 μ mol· L-1的4-PDS溶液反应15 min, 反应所得产物4-PT扫描曲线如图5所示。
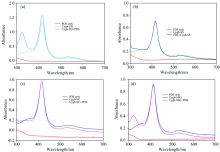 | 图5 不同修饰的胞红蛋白样品与4-PDS反应产物光谱图Fig.5 Spectral curves of the products formed by the reaction of different modified cytoglobin samples with 4-PDS |
由图5可得四种经过修饰的胞红蛋白样品在324 nm处吸光值, 根据方程(1)计算出样品中巯基浓度如表2所示。
| 表2 不同修饰的胞红蛋白浓度与巯基浓度(n=3) Table 2 Different modified cytoglobin concentrations and sulfhydryl concentration (n=3) |
表2列出了Cygb样品中巯基浓度、 样品浓度及二者比值, 揭示了Cygb的修饰效果和样品中的巯基数目。 由表可知PDS和NEM几乎与Cygb的巯基全部反应, 由于空间位阻的存在, GSSG只与Cygb上的一半巯基反应。 对巯基进行化学修饰能够改变Cygb内在组氨酸的解离速率常数, 从而改变外在配体的结合常数, 影响Cygb结合外源配体的功能[20]。
通过比较给定的胞红蛋白样品(通过朗伯-比尔定律测量)的浓度与同一胞红蛋白的游离巯基(通过4-PDS方法测的浓度来测定四种产物Cygb-SS, Cygb-SH, Cygb-SSG和量)Cygb-SC的纯度。 结果表明胞红蛋白样品巯基修饰的最终平均百分比> 90%。
论述了胞红蛋白的表达和纯化, 最终得到了纯度较高的具有生物活性的胞红蛋白, 并测量了所得胞红蛋白的浓度, 为研究其理化性质和相关功能打下基础。
采用化学试剂DTT, PDS, NEM, GSSG对Cygb的巯基进行修饰, 并用4’ 4-二吡啶基二硫法(4-PDS)法检测其修饰效果, 这比经典的Ellman试剂法更适用于胞红蛋白巯基测定, 它不仅是对Ellman试剂法的补充, 还能测出修饰后胞红蛋白中巯基的数目。 该方法可行性强, 对测量410~420 nm处有强吸收的化合物中巯基含量具有较好的实用性[28]。 通过4-PDS光谱检测法测量了修饰后胞红蛋白巯基的含量, 又根据胞红蛋白的浓度算出其化学修饰率, 确保胞红蛋白被成功修饰, 为后面研究修饰的胞红蛋白功能差异实验提供了样品。
上述表明, 制备得到的胞红蛋白纯度较高, 具有生物活性, 这为后面研究其性质和功能做了铺垫。 同时在胞红蛋白的巯基上进行化学修饰, 改变了其空间结构, 可用来进一步研究其理化性质的变化。
致谢: 感谢俄亥俄州立大学戴维斯心肺研究所Zweier教授和刘小平老师提供的实验条件, 感谢Craig Hemann提供的胞红蛋白分离纯化图及对实验做出的指导。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|