作者简介: 李菲菲, 1995年生, 南华大学公共卫生学院硕士研究生 e-mail: lffnanhua@foxmail.com
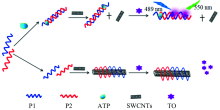
基于裂开型核酸适体序列短、 能有效降低因探针形成二级结构产生假阳性信号等优点, 选择裂开型核酸适体作为特异性识别探针, 核酸染料噻唑橙(TO)为信号探针, 用单壁碳纳米管(SWCNTs)降低背景信号, 利用“适配体-目标分子-适配体”的“三明治”夹心方式, 建立了一种检测ATP的新方法。 在pH 8.0的Tris-HCl缓冲溶液中, 裂开成两段的ATP适体特异性识别ATP分子, 生成稳定的“适配体-ATP-适配体”复合结构。 单壁碳纳米管对该复合结构的吸附力较弱, 因此该复合物游离在溶液中, TO与其结合而产生强荧光。 当不存在ATP时, 核酸适体探针以单链状态存在, 可通过π—π共轭作用结合到SWCNTs表面, 进而不能与TO结合, TO游离在溶液中荧光非常微弱。 反应体系中ATP浓度越高, 形成的“适配体-ATP-适配体”夹心识别结构复合物越多, 检测到的荧光强度越大, 据此实现对ATP的检测。 在优化实验条件下, 在最大荧光发射波长550 nm处, ATP的浓度在9.0×10-9~1.0×10-7 mol·L-1范围内与Δ F/F0值成线性关系, r=0.996 4。 该方法加标回收率为95.2%~104%, 相对标准偏差(RSD)为1.02%~4.54%, 检出限达到2.67×10-9 mol·L-1。 该方法基于功能核酸对目标物亲合力强、 选择识别性高的特点, 对ATP的检测表现出很好的选择性, 实验结果表明, 当相对误差控制在±5%以内时, 200倍的UTP, GTP和CTP均不干扰ATP的测定。 另外, 该方法操作简单、 快速、 无需标记、 灵敏准确, 可用于血清样品中ATP的测定, 在快速检测小分子物质领域中有较好的应用前景。
A novel Label-Free Fluorometric Assay based on the recombination of split aptamer chip was developed for thedetection of adenosine triphosphate (ATP). In this strategy, the split aptamer was selected as a specific capture probe for the split two fragments aptamers could specifically form a ternary assembly in the presence of ligand and the two separate oligonucleotides lack secondary structures, thus not yielding false-positive or nonspecific signals, while the Thiazole orange(TO), an almost non-fluorescence dye in buffer solution, was used as signal probe, and the single-walled carbon nanotubes (SWCNTs) was applied to reduce the background signals. In the pH 8.0 Tris-HCl buffer solution, those two split aptamer fragments will be combined with each other to form a stable “aptamer-ATP-aptamer” composite structure upon interacting with its target ATP. The “sandwich” structure can’t wrap the sidewalls of the SWCNTs and is freed in solution, and TO shows agreat fluorescence enhancement when binding to the “aptamer-ATP-aptamer” composite structure. In the absence of ATP, the split aptamers, existing in a single-stranded state, bind to the surface of the SWCNTs via a π—π-conjugate interaction, and TO shows weak fluorescence because “sandwich”structure is not formed. In the system, the higher the ATP concentration is, the more the “aptamer-ATP-aptamer” sandwich recognition structure complex obtained, sois the fluorescence. Under the optimized experimental conditions, the ATP concentration in the range from 9.0×10-9 mol·L-1 to 1.0×10-7 mol·L-1 was linear with the Δ F/F0 value at the maximum fluorescence emission wavelength of 550 nm, r=0.996 4, with a low detection limit of 2.67×10-9 mol·L-1. The recoveries of the method were 95.2%~104%, and the relative standard deviation (RSD) was 1.02%~4.54%, respectively. Based on the specific molecular recognition and high affinity of twosplit aptamers, the reaction product was shown that a “turn-on” fluorescence response to ATP with good selectivity, only a slight fluorescence change could be observed by GTP, CTP, and UTP (at a 200-fold higher concentration than that of ATP), indicating that UTP, CTP, and GTP could not interact with P1 and P1 to initiate the reaction. The method is simple, rapid, free-label, sensitive and accurate, and can be used for the determination of ATP in serum samples. Therefore, the present strategy has a great potential application prospect in the field of rapid detection of small molecular substances.
ATP是由腺嘌呤, 核糖和三个磷酸基团组成的多功能三磷酸腺苷, 是细胞代谢中不可缺少的贮能分子, 不仅可以作为细胞活力和细胞损伤的指标, 而且在细胞中的水平异常与许多疾病有关, 例如恶性肿瘤、 低血糖、 帕金森病等[1]。 因此, ATP的检测在临床诊断和研究中显得尤为重要。 常用检测ATP的方法有生物发光法[2]、 高效液相色谱法[3]、 电泳法[4]、 电化学法和光学分析法等。 生物发光法费用高且发光剂不稳定[5]; 色谱法灵敏准确, 可以实现同时检测和分离, 但仪器昂贵。 自从Huizenga于1995年首次筛选出ATP核酸适体[6], 核酸适体便在ATP的分析应用中成为一种很有前途的工具[5]。
核酸适体由于具有高选择性和高特异性, 可以结合多种靶分子, 如蛋白质、 小分子有机物、 病毒和完整的肿瘤细胞等[7], 已被广泛地应用于生物传感器的构建, 如比色传感器[8], 荧光传感器[9, 10], 电化学传感器[11]等。 常规的核酸适体通常根据适体与靶标物质相互作用后构象的变化或结构的转变激活信号探针从而实现对目标物质的检测。 裂开型核酸适体是将原始完整的核酸适体在恰当的位置断裂成两个或多个片段, 这些片段能够特异性识别目标物, 在有目标物存在的情况下结合形成识别构型, 片段之间相互靠近, 从而激发检测信号的产生[12]。 与常规完整的核酸适体相比较, 裂开型适体探针能有效避免因非特异性吸附等因素引起完整核酸适体原始结构变化而产生假阳性信号[13]; 也可避免因分子内相互作用引起的非特异性信号增强[14]; 还能有效降低检测背景, 裂开型核酸探针在理论上可实现零背景检测; 另外, 还可以有效降低DNA探针序列的长度, 进而降低合成成本, 更重要的是能有效避免长序列DNA探针易形成二级结构的缺陷, 有利于识别构型的形成。 “ 裂开型” 核酸适体保持着原有完整适体对靶标物的特异性和高度亲和力, 在设计上更加灵活, 在生物小分子检测领域中显示出了广阔的应用前景。
基于裂开型核酸适体的优点, 本文选择裂开型的ATP核酸适体作为特异性识别探针, 噻唑橙(TO)染料作为信号探针, 采用单壁碳纳米管(SWCNTs)降低背景值, 建立了一种操作简单、 灵敏准确的非标记检测ATP的新方法。
F-4500荧光光度计; AB204-S电子分析天平(梅特勒-托利多仪器有限公司); PB-20(PB-S)型精密酸度计(德国赛多利斯公司); 电热恒温水浴箱; 电热鼓风干燥箱; 真空干燥箱; 数控超声波清洗器; 涡旋混合器。
ATP储备液(1× 10-3 mol· L-1): 准确称取ATP, 溶于Tris-HCl(pH 7.4)缓冲液中; 核酸适体(上海生工生物工程公司): P1序列为5’ -ACCTGGGGGAGTAT-3’ , P2序列为5’ -TGCGGAGGAAGGT-3’ , 浓度均为100 μ mol· L-1, 用前稀释退火; Tris-HCl缓冲液(pH 8.0, 10 mmol· L-1 MgCl2, 50 mmol· L-1 NaCl); 羧基化SWCNTs分散液(0.4 mg· mL-1): 称取0.05 g购买的SWCNTs, 加入40 mL混合酸(浓硫酸:浓硝酸=3:1), 冰水浴超声4 h, 加入超纯水, 洗至近中性, 抽滤。 得到的滤饼在60 ℃真空干燥箱中干燥过夜[15]。 称取上述固体, 冰水浴超声30 min, 分散后溶液呈墨水样; 噻唑橙; 胎牛血清。
实验用水为超纯水, 电阻率18.25 MΩ · cm; 所用试剂均为分析纯。
首先, 在2 mL EP管中依次加入pH 8.0的Tris-HCl缓冲液、 适体探针P1和P2、 待测ATP溶液, 35℃反应1 h。 之后, 加入羧基化SWCNTs混匀, 再加入TO染料, Tris-HCl缓冲液定容至300 μ L, 35℃反应40 min。 在489 nm激发波长下, 520~600 nm范围内进行荧光扫描, 测量该溶液体系在最大发射波长550 nm处荧光强度F, 同时测量试剂空白荧光强度F0, 计算Δ F/F0=(F-F0)/F0值。
本文构建的基于裂开型核酸适体非标记荧光法检测ATP的原理示意图如图1所示。 裂开型的ATP核酸适体探针分别记为探针1(P1)和探针2(P2), 在pH 8.0的Tris-HCl缓冲体系中, 如果存在目标待测物ATP时, 在ATP的介导作用下, P1和P2探针发生协同性特异结合形成“ P1-ATP-P2” 的夹心识别结构复合物。 在缓冲溶液中几乎不发荧光的TO染料与该夹心结构结合后能发射强荧光, 产生灵敏检测信号。 当溶液中不含ATP时, 没有ATP的介导, P1和P2不能形成识别结构, 呈游离单链状态存在于溶液中。 TO染料与单链DNA作用也能发出一定强度的荧光, 产生背景荧光信号。 为了降低背景值, 我们加入SWCNTs。 加入SWCNTs后, 游离的P1和P2通过π — π 共轭作用结合到SWCNTs表面, 因而不能与TO结合, 而使背景荧光降低。 检测体系中所含ATP越多, 形成的“ P1-ATP- P2” 的夹心识别结构复合物越多, 荧光强度越大, 从而达到检测目的。
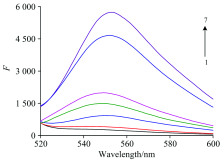
反应体系的荧光谱图如图2所示, 曲线1为仅有TO染料的缓冲液体系, 荧光强度非常微弱; 曲线7为加入P1, P2, ATP和TO体系, 在波长550 nm处荧光值为5661, 可见当加入ATP后, 由于ATP的介导作用形成“ P1-ATP-P2” 的夹心识别结构, TO染料与该结构相结合后, 显著增强荧光强度; 曲线6为P1, P2和TO体系, 荧光值为4 637, 曲线6荧光强度仅次于曲线7, 表明在无ATP介导下, P1和P2也能与TO作用产生较强荧光, 背景值很高, 不利于应用。 为了降低背景值我们选择加入SWCNTs, 曲线2为P1, P2, SWCNTs和TO体系, 荧光值为406.8, 与曲线6相比, 荧光值下降了91.2%, 可见加入SWCNTs后能有效降低检测体系的背景荧光值; 曲线3~5为加入P1, P2, SWCNTs, TO和不同浓度ATP的体系, 荧光值依次为928.6, 1 493和1 986, 可见检测体系的荧光强度随着ATP浓度的增加而增加, 据此建立检测ATP的新方法。
2.3.1 缓冲溶液pH的优化
实验采用Tris-HCl缓冲溶液调节体系pH值, 在pH 5.5~8.5范围内考查pH值对检测体系的影响。 结果发现pH值在5.5~8.0范围内, 检测体系的Δ F/F0值随着pH值增大而逐渐增加, 当溶液pH值超过8.0后, 随着溶液碱性的增强, Δ F/F0迅速降低。 由此选择pH 8.0的缓冲溶液进行后续实验。
2.3.2 核酸适体浓度的优化
实验在0.3~2.3 μ mol· L-1范围内探究了不同适体浓度对反应体系Δ F/F0的影响。 适体浓度在0.3~1.0 μ mol· L-1时, 随适体浓度增加体系荧光强度逐渐增大, Δ F/F0逐渐增加, 当适体浓度超过1.0 μ mol· L-1后, 因SWCNTs数量有限, 过量的探针不能与SWCNTs结合, 在体系中呈游离状态而使F0显著增大, Δ F/F0减小。 由此选用1.0 μ mol· L-1为实验用核酸适体浓度。
2.3.3 TO浓度的优化
荧光染料TO浓度在1.0~3.0 μ mol· L-1范围内, 实验探究不同TO浓度对反应体系Δ F/F0的影响。 TO浓度在1.0~2.0 μ mol· L-1时, 随TO浓度增加, F0和F均增加, Δ F/F0也逐渐增大; 当TO浓度为2.0 μ mol· L-1时, Δ F/F0达到峰值; TO浓度超过2.0 μ mol· L-1, Δ F/F0不再增大, 故选择TO浓度为2.0 μ mol· L-1。
2.3.4 SWCNTs浓度的优化
实验采用SWCNTs来降低反应体系背景荧光, 当SWCNTs浓度在6.7~20 μ g· mL-1范围内, 随SWCNTs浓度增加F0和F迅速降低, Δ F/F0逐渐增大, SWCNTs浓度为20 μ g· mL-1时, Δ F/F0达到最大值。 这是因为较低的SWCNTs用量, 部分探针游离在溶液中, 背景荧光不能得到有效地降低, F0较大, Δ F/F0较小。 当浓度超过20 μ g· mL-1时, Δ F/F0逐渐减小。 SWCNTs的最佳浓度为20 μ g· mL-1。
2.3.5 生成“ P1-ATP- P2” 复合物的温度和时间的优化
实验在15~45 ℃范围内考察了“ P1-ATP-P2” 复合物的稳定状态。 结果显示在15~35 ℃范围内, 随着温度的升高, “ P1-ATP-P2” 复合物的形成越来越多, 越来越稳定, 表现为体系Δ F/F0逐渐增大, 当温度达到35 ℃时, Δ F/F0达到最高值。 当温度大于35 ℃后, 发现Δ F/F0值随着温度的升高反而降低, 分析认为是由于温度过高导致“ P1-ATP-P2” 复合物解离, 进而使Δ F/F0降低。 实验选择“ P1-ATP-P2” 复合物生成阶段的反应温度为35 ℃。
实验对“ P1-ATP-P2” 复合物形成的反应时间在30~90 min范围内进行了考察。 在30~60 min范围内, 随着反应时间的延长, “ P1-ATP-P2” 复合物形成越来越多, Δ F/F0逐渐增大; 当反应时间达到60 min时, “ P1-ATP-P2” 复合物形成量趋于稳定, Δ F/F0达到最高值, 继续增加反应时间, Δ F/F0不再增加。 因此确定“ P1-ATP-P2” 复合物生成反应时间为60 min。
2.3.6 加入TO后反应温度和时间的优化
加入TO后, 实验考察了TO与“ P1-ATP-P2” 复合物的最佳反应温度。 实验结果显示低于15~35 ℃范围内时, TO与“ P1-ATP-P2” 复合物结合的效率随着温度的升高而增加, Δ F/F0迅速增大; 但是当温度大于35 ℃之后反而随着温度升高Δ F/F0而降低。 由此, 本方法选择反应温度为35 ℃。
加入TO后随着反应时间的增加, Δ F/F0快速增大, 当反应时间超过40 min后, Δ F/F0逐渐减小。 因此加入TO后反应40 min。
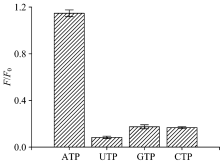
在最优的实验参数下, 考察了可能的共存物质干扰情况, 实验结果表明当ATP浓度为5.0× 10-8 mol· L-1, Δ F/F0的相对误差控制在± 5%以内时, 200倍的UTP, GTP和CTP不干扰ATP的测定。 结果如图3所示。
在已优化的实验条件下, 测定了不同浓度ATP标准溶液的荧光强度值F, 曲线1为未加ATP的体系, 曲线2— 7为ATP浓度依次增高的反应体系, 随着ATP浓度的逐渐增大, 荧光强度依次增强, 如图4所示。 由图4内插图可见, ATP的摩尔浓度在9.0× 10-9~1.0× 10-7 mol· L-1范围内与Δ F/F0呈现线性关系, 其线性回归方程Δ F/F0=0.193进行11次空白平行测定, 按照公式cL=3Sb/k, 计算得到ATP的检出限cL为2.67× 10-9 mol· L-1, 实验结果说明本方法有较好的灵敏度。
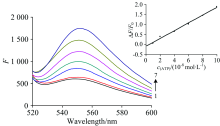 | 图4 标准系列图Fig.4 The standard series cATP=(0, 1.0, 2.0, 4.0, 6.0, 8.0, 10.0)× 10-8 mol· L-1, cP1/P2=1.0 μ mol· L-1, cTO=2.0 μ mol· L-1, Tris-HCl(pH 8.0), cSWCNTs=20 μ g· mL-1(× 10-8)c-0.086, r=0.996 4 |
对低(1.0× 10-8 mol· L-1)、 中(6.0× 10-8 mol· L-1)、 高(9.0× 10-8 mol· L-1)浓度的ATP标准溶液进行精密度实验, 分别平行测定7次, 相对标准偏差(RSD)分别为4.54%, 1.02%和2.94%, 表明该实验方法精密度性能良好。
选择胎牛血清为待测样品, 分别向血清样品中加入6.0, 30和54 μ L, 5.0× 10-7 mol· L-1的ATP标准溶液, 测定加标样中的ATP含量, 计算加标回收率, 结果如表1所示。
| 表1 血样中ATP分析结果(n=7) Table 1 The result of determination of ATP in the blood samples (n=7) |
利用DNA序列较短、 特异性高、 亲和力强的裂开型ATP适体作为识别探针, 用核酸染料TO作为信号探针, 结合SWCNTs对“ P1-ATP-P2” 和ssDNA吸附能力的差距降低背景信号, 建立了一种成本低、 操作简单、 灵敏度高的非标记荧光法检测ATP。 该方法选择了裂开型的核酸适体, 既保持了核酸适体对目标物的高度特异性和亲和力, 又有效降低了长序列DNA探针易形成二级结构产生假阳性信号、 分子内相互作用引起的非特异性信号增强等缺陷。 该方法能有效避免UTP, GTP和CTP等物质的干扰, 血清中其他复杂成分也不影响该方法对ATP的准确测定。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|