作者简介: 付赛, 女, 1991年生, 中国中医科学院中药研究所硕士研究生 e-mail: 1968853703@qq.com
用近红外光谱法实现嫩, 中, 老三种炼蜜含水量的快速测定及不同炼制程度蜂蜜的快速分级。 过程化控制是中药质量稳定的关键因素, 但由于检测手段的滞后而无法实现, 因而影响中药质量。 蜜丸是具广阔应用市场的剂型; 炼蜜工艺是影响蜜丸质量的关键工序; 在炼蜜过程中, 蜂蜜从嫩蜜炼制到中蜜仅需几至几十秒, 变化迅速, 传统检测手段不能对蜂蜜炼制过程进行实时监测, 进而无法保证炼蜜质量的均一性。 力求采用近红外光谱法(NIRS)对炼蜜过程进行实时检测, 准确控制嫩蜜、 中蜜的炼制程度, 并对其含水量进行定量测定。 实验通过Rudolph折光仪测定不同炼蜜的含水量, 并快速测定样品的近红外光谱, 结合偏最小二乘法(PLS)建立并优化88批炼蜜水分的定量模型, 利用校正模型决定系数( R2)、 校正模型均方根误差(RMSEE); 内部交叉验证决定系数( R2), 内部交叉验证均方根误差(RMSECV); 预测模型的相关系数( r)、 预测均方根误差(RMSEP)对校正模型进行评价, 其中RMSECV主要用来筛选建立模型的最佳主成分数, RMSEE和RMSEP分别对所建立校正集和验证集进行误差分析。 同时采用鉴别分析法建立定性模型用来区分炼蜜等级。 经不断优化, 图谱经矢量归一化法(SNV)预处理后, 在7 201.25 446.2 cm-1波段内选取9个主成分建立水分模型。 建立的最佳模型中, 校正集 R2, RMSEE分别为99.43, 0.299, 内部交叉验证 R2, RMSECV分别为99.05, 0.348; 预测集 R2, RMSEP分别为98.19, 0.347; 定量模型显示, NIRS可快速、 准确、 无损的对炼蜜含水量进行测定。 同时按照含水量测定结果对炼蜜嫩、 中、 老3个等级进行划分, 进而采用鉴别分析法对炼蜜进行定性分析, 结果显示嫩、 中、 老3种炼蜜有明显的聚类现象, 表明因子化法是鉴别炼蜜程度的一种有效方法; 综上所述, NIRS可望实现对炼蜜过程实时监测, 准确控制嫩蜜, 中蜜的炼蜜程度并对炼蜜含水量进行快速实时定量测定, 为不同炼蜜等级划分提供参考, 保证炼蜜质量的均一性, 最终保证蜜丸质量的稳定性。
Near-infrared spectroscopy(NIRS) was used to quantify moisture content about refined-honey, and the practicability to classify the samples degree through refining was investigated. Process Analysis Technology is vital to affecting the quality stability of traditional Chinese medicines, with the lagging nature of detection methods, accurate real-time control of them cannot be achieved, ultimately affecting the homogeneity and stability of quality about traditional Chinese medicines. Sweetpill has a wide application market. The honey refining process is a critical process to affect the quality of it. However, the transition from tender to medium honey takes only a few to several tens of seconds. The traditional detection method cannot monitor it, leading to the fact that the uniformity of honey quality cannot be achieved. In order to identify and predict moisture content for tender, medium and old honey at the same time, the 88 different honeies were refined, and the qualitative and quantitative models were established based on Near Infrared Spectroscopy (NIRS). Using refractometer to measure the moisture content, and near infrared spectra of samples were also measured. Combined with partial least squares(PLS) algorithm were conducted on the calibration of regression model; the qualitative prediction model was used to establish the level of the refined honey by the factorization method. For the quantitative calibration model, the R2, RMSEE, RMSECV were 99.43, 0.299, 0.34, respectively. For the prediction model, the R2, RMSEP were 98.19, 0.347, respectively. Through the discriminant analysis, the qualitative model showed obvious clustering phenomenon. NIRS has good application prospects to be applied to real-time monitoring and moisture determination of refined honey.
目前中药制剂产品质量依靠终端控制远甚于过程控制, 但过程化控制是影响中药质量稳定性、 均一性的关键因素, 只是由于目前检测手段的滞后, 无法实现准确的实时控制, 最终无法保证中药质量的均一性、 稳定性。 蜜丸是目前市场上较为常用的剂型, 如六味地黄丸, 补中益气丸, 附子理中丸等被国家食品药品监督管理总局批准的有上百个。 蜂蜜炼制是影响蜜丸的关键工艺之一, 是影响蜜丸的成型质量均一性、 稳定性的重要因素。 目前以水分、 相对密度、 性状进行炼蜜等级的判断。 市场上不同种类蜂蜜相对密度多集中在1.3881.394 g· cm-3(25 ℃), 已达到中蜜的要求; 蜂蜜的色泽从水白色、 浅黄色至深色不等, 视觉判断较难。 以外观或手感判断炼蜜工艺具有明显的主观性, 导致炼蜜工艺过程相关参数的不一致。 寻找量化的炼蜜标准是保证蜜丸的成型质量的关键之一 。 蜂蜜的炼制主要作用是去掉部分水分增加粘度, 所以采用含水量作为区分炼蜜等级的量化指标是现实可行的。
在炼蜜过程中, 从嫩蜜到中蜜的过度时间为几秒至几十秒, 传统的水分测定法均无法实现对其控制。 但是近红外光谱(near-infrared spectrometry, NIRS)分析技术具有快速、 无损, 可以在线实时分析[1]等优点, 己被普遍应用于药效成分含量的在线分析[2]、 天然药物鉴别、 中药材的产地鉴别等[3]。 用近红外光谱法实现炼蜜水分的快速测定, 以期能准确控制从嫩蜜到中蜜的过程, 准确量化炼蜜过程工艺参数, 保证炼蜜质量的均一性。
MPA傅里叶变换近红外光谱(德国Bruker), 配备InGaAs检测器和液体光纤探头和OPUS7.5分析软件; Rudolph折光仪(J357, Rudolphresearch); EYELA油浴锅(OSB-2001, 上海爱朗仪器有限公司)。 酸枣蜂蜜(20170810)、 荆花蜂蜜(20170811, 20171107)、 洋槐蜂蜜(20170829, 20171101)、 紫云英蜂蜜(20170516, 20171108)、 椴树蜂蜜(20170327, 20170726)均购自北京农科瑞奇蜂业科技有限公公司; 枣花蜂蜜(20171107)、 荆条蜂蜜(20170816)、 槐花蜂蜜(20171107)、 紫云英蜂蜜(20170916)、 椴树蜂蜜(20170816)均购自北京紫云英保健品开发有限责任公司。
1.2.1 蜂蜜炼制与含水量测定
对新购置的蜂蜜按照《中国药典》2015版(一部)有关蜂蜜水分、 酸度、 5-甲基糠醛、 含糖量等指令进行测定[4]; 按照国标GBT 18932.16— 2003对蜂蜜淀粉酶值进行测定。
取不同种类、 不同批次、 不同厂家的蜂蜜, 按照表1[5]的温度及感官评价进行炼制。 对炼制的蜂蜜参照2015版《中国药典》蜂蜜项下要求进行含水量测定指数[4], 以区分炼蜜的等级, 为后续含水量分级提供参考和依据。
| 表1 不同规格炼蜜工艺以及性状描述 Table 1 Traditional honey refining process |
1.2.2 近红外光谱的采集
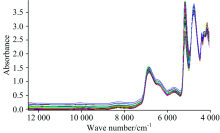
测试前, 将炼蜜在60 ℃水浴锅中加热至恒温3 h, 直至晶体完全溶化。 预热近红外光谱仪30 min稳定后, 直接将液体光纤探头插入样品中进行近红外光谱测定。 实验采用透射方式; 扫描范围为4 000~12 800 cm-1; 分辨率8 cm-1; 扫描次数32次; 每张图谱扫描3次, 取平均值作为该样本的原始光谱如图1。
1.2.3 模型建立与验证
采用OPUS软件建立炼蜜含水量的定量和定性预测模型。 为获取有效的特征信息, 减少由于温度、 仪器等条件造成基线漂移、 光散射、 噪音的影响, 在建立定量分析模型之前, 需要对光谱进行一定的预处理[6]。 常见的光谱预处理方法有矢量归一化(SNV)、 一阶导数、 二阶导数等, 也可组合运用到模型中进行模型建立[7]; 同时采用PLS进行波段的选择, 通过比较相关系数r, RMSEE和RMSEP来实现最优波段的筛选[8]; 最终采用PLS法建立炼蜜含水量的定量模型, 建模时, 将样品随机分为校正集及验证集, 并确保预测集含水量范围被校正集整体覆盖[9], 采用内部交叉验证法对模型进行内部检验, 并采用验证集对模型进行外部校验; 同时, 采用鉴别分析法对炼蜜进行定性分析。
按照《中国药典》2015版一部有关蜂蜜的规定, 测出蜂蜜的含水量在15.8%22%之间, 5-羟甲基糠醛含量均小于0.004%, 含果糖和葡萄糖的总量均大于60.0%, 果糖与葡萄糖含量比值均大于1.0, 且酸度、 淀粉、 糊精等均符合要求; 炼蜜淀粉酶值均在2050 mL· (g· h)-1, 均符合GBT 18932.16— 2003要求; 综上所述, 可初步判断所用蜂蜜为真蜜。
对炼制后的蜂蜜采用折光仪间接水分测定法对不同等级炼蜜进行水分测定, 表2显示, 88种炼蜜含水量范围均在传统炼蜜范围, 且分布较广泛, 具有代表性。
| 表2 炼蜜水分测定结果 Table 2 Moisture content of refined honey |
分别采用一阶导数, 二阶导数, SNV, 一阶导数+SNV方法对近红外光谱进行前处理。 图1显示了88中炼蜜的平均光谱图, 由图可知, 在近红外谱区样品重叠较严重, 因此在全波长范围内采用PLS进行波段选择, 筛选最佳波段。 为防止模型出现“ 欠拟合” 或“ 过拟合” 的现象[10], 采用内部交叉验证方法, 以最大R2和最小RMSECV筛选最佳主成分数。 表3列出了内部交叉验证结果。
| 表3 炼蜜含水量模型定量及交互验证结果 Table 3 Calibration and cross-validation results of moisture content |
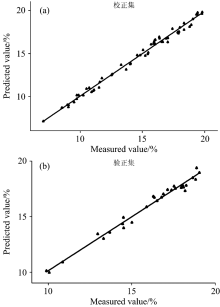
从表3可以看出, 图谱经SNV预处理后, 在7 201.25 446.2 cm-1波段选取9个主成分数, 进行最佳模型的建立如图2(a)所示。 建立的最佳模型中, RMSEE为0.299, R2为99.43, RMSECV为0.348, R2为99.05。
为了验证含水量校正模型的可行性与准确性, 除了采用模型自身的参数进行内部交叉验证以外, 还需采用未参与建模的29个预测集样品对模型进行外部检验。 图2(b)和表4列出了检验集对模型外部验证的结果。 其中预测集的RMSEP为0.347, R2为98.19。
| 表4 近红外定量模型对预测集样品含水量的预测结果 Table 4 Predicted moisture content of validation set |
采用SPSS21软件对近红外模型的预测值与标准方法测得的化学值进行t检验, 给定95%置信区间内, t检验结果P为0.972, 大于0.05, 表明近红外光谱法与折光仪测定法不存在显著性差异, 说明两种分析方法是一致的。
使用相对分析误差RPD对预测精度进行评价, 若RPD大于3, 说明预测效果好, 所建的定量模型可用于实际检测[11]。 得到RPD=9.13, 说明模型预测精度好, 可应用于实际检测。
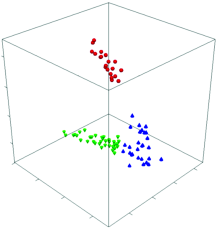
近年来近红外光谱常用于药材道地产区、 真伪及食品安全性的定性鉴别[12, 13]。 本工作对80个不同炼蜜样品进行定性鉴别分析。 首先, 按照传统的炼蜜方式结合含水量测定结果, 将炼蜜初分为3组, 经多次优化后, 对4 5007 500 cm-1范围内的光谱进行SNV处理, 采用因子化算法计算3组炼蜜的阈值T和平均光谱之间的距离D, 得出S值[14]。 当S> 1时, 表明各类样品之间已经被完全分开, 当S< 1时, 表明各类样品之间有重叠交叉。 结果见表5, 图3。
| 表5 炼蜜定性分析结果 Table 5 The result of qualitative model of refined honey |
由表5可知, 老蜜与中蜜, 老蜜与嫩蜜之间的S值均大于1, 表明老蜜与嫩蜜, 老蜜与中蜜之间是完全分开的。 但是嫩蜜与中蜜之间的S值小于1, 说明二者之间有部分交叉。 但由图3可知, 不同炼蜜有明显的聚类现象, 表明因子化法是鉴别炼蜜程度的一种有效方法。
采用偏最小二乘法, 建立不同等级炼蜜含水量的NIR/近红外定量模型, 样品的预测值与实际值之间有较好的相关性, 且误差较小, 在一定程度上可以实现对炼蜜含水量的预测。 该模型为快速、 实时、 无损测定蜂蜜含水量提供参考。
鉴别分析说明, NIRS可以较好的鉴别中蜜、 嫩蜜与老蜜, 由于嫩蜜和中蜜差别较小, 市售许多蜂蜜处于嫩蜜与中蜜之间, 且实验中样品较少, 导致嫩蜜和中蜜未能完全被鉴别。 但在实际炼蜜过程中, 嫩蜜会迅速过渡到中蜜仅需几秒到几十秒, 传统的检测方法不能对该过程进行监测, 但采用近红外快速(几秒至几十秒完成样品测定)、 实时监测、 无损的特点能准确控制该过程, 准确量化炼蜜过程工艺参数, 保证得到炼蜜质量均一、 稳定, 最终使蜜丸的成型质量得到保证, 故采用近红外测定炼蜜含水量, 准确确定嫩蜜, 中蜜, 老蜜的炼蜜程度, 量化炼蜜标准是现实可行的。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|