作者简介: 李佳佳, 女, 1988年生, 陕西中医药大学药学院讲师 e-mail: ljjzhw2007@163.com
从中药材黄花蒿中提取的青蒿素, 是一种含有过氧基团的倍半萜内酯药物, 目前已成为世界卫生组织推荐的抗疟疾药物。 含有青蒿素的复方制剂具有抗疟、 抑菌和调节免疫功能等作用, 然而含青蒿素的复方制剂没有可量化的统一质量标准, 因此难以控制和评价这些复方制剂的质量。 目前对于青蒿素复方制剂的研究主要集中在定性分析其有效成分上, 但具体如何定量分析其中青蒿素含量的研究工作却并不多, 迫切需要一种简便、 快速、 无损的方法监控青蒿素的生产和使用。 激光拉曼光谱是一种分子联合的光散射现象, 能够提供样品分子的成分及结构, 对研究青蒿素具有重要的意义。 首先对青蒿素标准样品进行激光拉曼光谱定性分析测试, 获得青蒿素标准品的拉曼特征图谱, 这些标准图谱为以后分析中药复方制剂中的青蒿素奠定了基础。 通过拉曼测试分析得到位于724 cm-1处的拉曼峰是与青蒿素中过氧基团直接相关的特性声子振动模式, 可用于检测过氧桥键的存在, 也是决定其抗疟活性的关键; 而位于1 736 cm-1处的拉曼峰强度大、 周围无其他振动峰干扰, 是与青蒿素中内酯基团相关的特性声子振动模式, 也可用来检测分析青蒿素。 因此, 拟采用青蒿素分子中位于724 cm-1处和1 736 cm-1两处的拉曼特征峰进行定性定量分析。 然后, 在实验室制备了一系列具有不同青蒿素质量百分数的青蒿素/面粉混合样品, 确定出混合样品中青蒿素724 cm-1处和1 736 cm-1处拉曼光谱参数。 并以峰面积比值 A724 /A1 736的平均值作为横坐标, 青蒿素质量百分数作为纵坐标, 拟合青蒿素质量百分数与峰面积比的函数关系, 得到二次函数关系式为 y=0.907 22 x2+0.465 93 x(0< x<0.9), 相关系数 r为0.992 65。 最后, 将该关系式用于中药复方制剂青蒿素哌喹片中青蒿素的含量检测分析, 按照此方法计算得到的青蒿素含量值与真实值(14.29%)比较, 相对误差较小(<10%), 可以初步建立起青蒿素含量的拉曼光谱测试方法。 本文提出应用激光拉曼光谱技术, 以期实现原位、 无损和快速检测。 在青蒿素标准样品实验研究基础上, 确定青蒿素拉曼光谱参数和实验条件, 建立起复方制剂中青蒿素含量的实验分析方法, 为青蒿素的研究和应用开创新的局面。
Artemisinin is a kind of sesquiterpene lactone drug containing peroxide groups, which is extracted from Artemisia annua L. Now it has become an antimalaria drug recommended by the world health organization. The compound preparation of Chinese material medica containing artemisinin has strong anti-malarial, antibacterial and immunomodulatory effects. However, there is no measurable and generalized standard for controlling and evaluating the quality of the compound preparations. Currently, the main researches of artemisinin compound preparations focus on the qualitative analysis of the active ingredients, and only less work is aimed at how to quantitatively analyse the artemisinin content. Therefore, it is urgent to develop a convenient, rapid and nondestructive method to monitor the production and use of artemisinin. Laser Raman spectroscopy is a kind of molecule scattering spectroscopy, which is characterized by frequency excursion that is caused by interactions of molecules and photons, to obtain information on molecules. Laser Raman spectrometry is a potential method for quantitatively analyzing artemisinin content. In this study, we demonstrate that Laser Raman spectroscopy is a suitable and non-destructive technique to qualitatively analyze artemisinin. The spectral characteristics of artemisinin will provide standard Raman spectra for identification and analysis of artemisinin in Chinese traditional compound medicine. It is found that the vibrational mode at 724 cm-1 is related to the vibration of peroxide groups, and also it is the key to verifying its anti-malarial function, in Artemisinin. In addition, the phonon mode at 1 736 cm-1 is not affected by the surrounding vibrational modes and its intensity is strong. The vibrational mode at 1 736 cm-1 corresponds to the vibrational mode of lactone bond, so it could be used for detecting artemisinin. Hence, this paper attempts to adopt the characteristic vibrational modes at 724 and 1 736 cm-1 simultaneously to analyze Artemisinin qualitatively and quantitatively. A series of artemisinin/flour binary mixture with different artemisinin mass percentage were synthesized with the aim of obtaining Raman spectral parameters at 724 and 1 736 cm-1. The average of Raman peak area ratios in accordance with the abscissa, the ordinate artemisinin content for result analysis. Afterwards the results are analyzed through nonlinear regression in order to get the function between the artemisinin content and Raman peak area ratios. The quadratic function is y=0.907 22 x2+0.465 93 x(0< x<0.9), and its correlation coefficients is 0.992 65. In addition, measurements of artemisinin content in Chinese traditional compound medicine by Laser Raman analysis were carried out on artemisinin-piperaquine tablets. The values of artemisinin content obtained by Laser Raman spectroscopy technology and true values (14.29%) are in good agreement with each other (relative errors <10%). This research provides a fundamental analysis tool for determining artemisinin content quantitatively by using Laser Raman spectroscopy. Experiment results demonstrate that this method has the potential for obtaining artemisinin content in Chinese traditional compound medicine.
黄花蒿(Artemisia annua L.), 又名青蒿, 是一种传统中药, 全株黄绿色, 具有挥发性香气[1, 2]。 青蒿素是黄花蒿的主要有效成分, 具有抗疟、 免疫调节、 抗菌、 抗肿瘤、 抗寄生虫等药理作用[3, 4], 已成为世界卫生组织推荐的药品。 现代药理研究表明青蒿具有抗菌、 消炎、 镇咳和祛痰的作用, 含有青蒿素的复方制剂主要有六神曲、 青蒿素哌喹片、 复方青蒿安乃近片等, 用可于疟疾、 饮食停滞、 胸痞腹胀、 呕吐泄利等症。 但是目前各厂家生产的这些复方制剂配方不统一, 对其质量评价主要通过感官和经验, 没有统一的质量标准, 难以控制和评价复方制剂的质量。 因此, 为更好地控制这些复方制剂的质量, 采用激光拉曼光谱法分析其中青蒿素的含量, 为复方制剂的质量控制提供依据。
长期以来, 人们对分析青蒿素含量的测试技术进行了不懈探索, 目前常用的主要有高效液相色谱(HPLC)法[5, 6]、 紫外分光光度法[7, 8]、 气相色谱法[9]、 碘量法[10]等。 这些方法虽然基本上能够满足目前对青蒿素含量的测定分析, 但还存在一些不足之处。 例如: 前处理过程复杂影响分析精度、 仪器复杂昂贵导致检测成本高、 使用大量有机试剂不够绿色环保以及检测过程复杂不适于大批量样品的快速测定等。 激光拉曼光谱以分子基团的振动理论为原理, 是一种散射光谱分析, 具有高精度、 原位、 无损和快速等特点[11, 12]。 每一种具有拉曼活性的物质都有其特定的拉曼光谱特征, 根据物质的特征拉曼光谱可以辨认出物质种类, 这就是拉曼光谱定性分析的基本原理。 Wopenka等[13]提出拉曼谱带的强度与单位体积内的分子数或离子数成正比, 这就奠定了拉曼光谱定量分析的理论基础。 方一行等[14]研究了青蒿素在700~900 cm-1范围内红外及拉曼谱型, 指出拉曼谱图中724 cm-1处的特征峰是过氧基团中与过氧桥直接相关的特征振动频率。 Kapetanaki等[15]进行了青蒿素与氯高铁血红素的反应, 主要研究了拉曼光谱图中青蒿素/氯高铁血红素二聚物中FeⅣ ═O伸缩振动频率出现在850 cm-1处。 Moroni等[16]分析了青蒿素分子在100~1 210 cm-1范围内的拉曼光谱特性。 孔梦红等[12]运用激光拉曼光谱分析了100~3 500 cm-1范围内青蒿素的声子振动特性, 指出出峰位置在724 cm-1处的过氧基团和位于1 734 cm-1内酯基团的特征拉曼峰能够快速检测青蒿素。 然而, 关于具体如何定量分析中药复方制剂中青蒿素含量的研究工作却并不多。
本研究经过拉曼测试得到已知不同质量百分数的青蒿素拉曼光谱图, 研究分析得到位于724 cm-1处的拉曼峰是与青蒿素中过氧基团直接相关的特性声子振动模式, 可用于检测过氧桥键的存在; 而位于1 736 cm-1处的拉曼峰是与青蒿素中内酯基团相关的特性声子振动模式, 能够用来进一步检测分析青蒿素。 在确定青蒿素中724 cm-1处和1 736 cm-1处拉曼光谱参数的基础上, 拟合青蒿素质量百分数与峰面积比的函数关系, 运用此函数关系式确定出含有青蒿素复方制剂中青蒿素的含量, 从而初步建立分析青蒿素含量的激光拉曼光谱基本方法。
青蒿素标准品购于上海阿拉丁生化科技股份有限公司, 青蒿素含量为98%。 青蒿素哌喹片购于广东新南方青蒿药业股份有限公司, 面粉购于金龙鱼麦芯粉系列, 符合国家食品质量标准的规定。 将面粉与青蒿素标准品按比例混合研磨制备成青蒿素质量百分数分别为2%, 5%, 10%, 20%, 30%, 40%, 50%和70%的一系列混合样品。
采用SX-51 inVia型的激光拉曼光谱仪对样品进行测试, Ar+激光器波长514 nm, 功率30 mW。 样品测试的光谱范围为100~3 500 cm-1, 用Origin 8.5软件对所测样品的拉曼谱图进行分析。
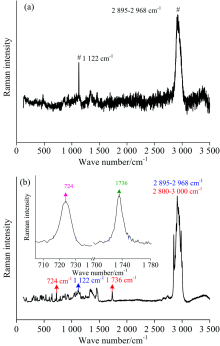
青蒿素的分子式是C15H22O5, 如图1(a)所示, 其中含有环戊内酯基团、 过氧基团和环己烷基团, 还包括若干甲基取代物。 采用密度泛函(DFT)方法经过理论计算[16, 17]得到青蒿素有120个振动模式, 且全部为拉曼活性模式, 因此在图1(b)中可以观察到青蒿素的拉曼谱图中存在较多且分布密集的拉曼振动峰。 在100~1 210 cm-1光谱范围内, 青蒿素有61个拉曼峰; 而在1 210~3 500 cm-1光谱范围内, 青蒿素的拉曼峰大都与CH3, CH2及CH等烷基相关。 通过分析青蒿素标准品激光拉曼光谱图, 能够确定青蒿素的拉曼特征峰及它们的振动模式, 拉曼图谱为分析复方制剂中的青蒿素提供识别和对比的参考标准。
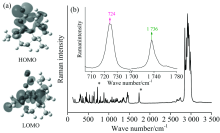 | 图1 (a)青蒿素的HOMO和LUMO 轨道图[17]; (b)青蒿素标准品拉曼光谱图(插图: 谱图范围从700~1 780 cm-1的青蒿素标准品拉曼光谱图)Fig.1 (a) HOMO and LUMO orbitals of artemisinin[17]; (b) Raman spectra of artemisinin (Insert: Raman spectra of artemisinin integral from 700 to 1 780 cm-1) |
确定可用于定量分析的青蒿素的拉曼特征峰, 对于检测青蒿素含量有着至关重要的意义。 作为定量分析的拉曼特征峰应满足以下条件: ①拉曼峰容易被检测到, 具有较强的信号; ②检测到该拉曼特征峰便可确定此物质的存在; ③拉曼峰的强度(峰面积)随物质含量(浓度、 质量分数等)而变化。
在青蒿素中, 对治疗疟疾起关键作用的是过氧桥键O1— O2, 因此确定过氧桥键所对应的拉曼特征峰对于定量分析青蒿素尤为重要。 研究表明[12, 14]过氧基团中与过氧桥键直接相关的特征峰位置为724 cm-1, 检测到该拉曼特征峰就可基本确定过氧桥键的存在。 刘靖丽等[17]曾应用密度泛函理论研究计算了青蒿素的HOMO轨道和LUMO轨道, 其中HOMO成份主要集中在过氧桥键的原子上, 表明青蒿素中的过氧桥键是决定其抗疟活性的关键, 因此724 cm-1处的拉曼特征峰可用于定量分析青蒿素。 然而, 在振动模式丰富的青蒿素中仅仅采用724 cm-1这一拉曼峰进行定量分析, 会影响检测的准确性和分析的精度, 因而还需再确定一个拉曼特征峰。 研究发现在青蒿素分子中还存在一个特征基团— — 环戊内酯基团[16], 实验检测及理论计算结果表明1 734 cm-1拉曼峰是内酯键(O11— C10═O)的特征振动频率。 而在2 800~3 500 cm-1光谱范围内的拉曼峰尽管具有较强的信号, 但由于光谱密集不易作为检测青蒿素的有效特征峰。 因此, 采用位于724 cm-1和1 736 cm-1的两个拉曼峰作为定量分析青蒿素的依据。
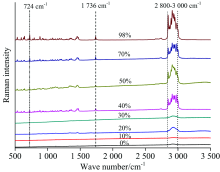
应用激光拉曼光谱法分析青蒿素含量的关键是确定其拉曼参数, 包括峰的位置、 宽度和强度等。 在不同质量百分比青蒿素/面粉混合样品拉曼光谱图(图2)中可以看到, 随着青蒿素含量的增加, 青蒿素724 cm-1、 1 736 cm-1处以及2 800~3 500 cm-1光谱范围内的拉曼峰峰强度也在逐渐增大。 图3(a)所示为面粉的拉曼光谱图, 其中1 122 cm-1的拉曼特征峰表征指面粉中纤维素糖苷键COC对称伸缩振动, 2 895~2 968 cm-1光谱范围内的拉曼峰是纤维素CH2伸缩振动。 在50%青蒿素/面粉混合样品拉曼光谱图[图3(b)]中可以明显看到青蒿素724, 1 736以及2 800~3 500 cm-1光谱范围内的拉曼特征峰, 以及面粉1 122和2 895~2 968 cm-1光谱范围内的拉曼特征峰, 其中面粉2 895~2 968 cm-1光谱范围内的纤维素CH2伸缩振动与青蒿素2 800~3 500 cm-1光谱范围内的拉曼特征峰有部分重叠。
根据拉曼光谱定量分析的原理可知, 定量分析青蒿素含量的关键取决于青蒿素特征峰峰强, 即峰面积的确定。 对谱峰进行基线校正、 谱解卷积的具体操作为: 打开Origin 8.5 软件, 选取将要处理的拉曼光谱谱线, 点击Analysis Fit multi-peaks Gaussian, 将需要处理的子峰个数设置为2; 双击2个子峰的出峰位置, 系统自动完成高斯多峰拟合计算, 选择Analysis Non liner curve fit, 并输出峰面积A及出峰位置x等参数。 通过对已知不同质量百分数的青蒿素/面粉混合样品进行拉曼光谱分析, 确定其峰面积值, 进而拟合青蒿素质量百分数与峰面积比的函数关系, 由此确定青蒿素含量分析的实验条件和定量计算的基础理论数据。
表1是青蒿素质量百分数分别为0%, 2%, 5%, 10%, 20%, 30%, 40%, 50%, 70%和98%的一系列混合样品位于724和1 736 cm-1的拉曼峰面积值, 分别记为A724和A1 736, 而它们的峰面积比值记为A724/A1 736, 每个样品都进行拉曼测试分析5次。
| 表1 不同质量百分比青蒿素/面粉混合样品的拉曼参数 Table 1 The data of the Raman spectra of artemisinin/flour binary mixtures with different mass percent |
激光拉曼光谱法分析青蒿素含量的精密度和准确度是通过计算不同质量百分比青蒿素/面粉混合样品中拉曼峰峰面积比值A724/A1 736的平均值(M)、 标准偏差(SD)和相对标准偏差(RSD)来确定的, 如表2所示。
| 表2 计算所得不同质量百分比青蒿素/面粉混合样品中拉曼峰峰面积比平均值(M), 标准偏差(SD)及相对标准偏差(RSD) Table 2 Calculated data of the mean of Raman peaks areas ratios (M), Standard Deviation (SD) and Relative Standard Deviation (RSD) in artemisinin/flour binary mixtures with different mass percent |
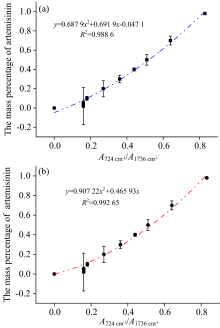
将不同质量百分比青蒿素/面粉混合样品中计算所得的5次拉曼峰峰面积比平均值(M), 标准偏差(SD)及相对标准偏差(RSD)列于表2。 首先将峰面积比值A724/A1 736的平均值作为横坐标, 青蒿素质量百分比作为纵坐标, 将计算所得的峰面积比平均值M以及相应的标准偏差、 相对标准偏差值代入后作图[图4(a)]。 对图4(a)中的曲线进行方程拟合, 则得截距为常数的二次函数关系(1)为y=0.687 9x2+0.691 9x-0.047 1(0< x< 0.9), 相关系数r为0.988 6。 同样的方法, 对曲线[图4(b)]进行截距为0时的二次函数方程拟合, 则得二次函数关系(2)为y=0.907 22x2+0.465 93x(0< x< 0.9), 相关系数r为0.992 65。 对曲线进行拟合后发现, 截距为0时得到的二次函数方程相关性较好。
对中药复方制剂青蒿素哌喹片进行分析得到的拉曼光谱如图5(a)所示, 可以明显观察到727 cm-1和1 739 cm-1的青蒿素拉曼特征峰。 进一步分析青蒿素哌喹片700~1 780 cm-1的拉曼光谱图[图5(b)], 得到了这两个拉曼特征峰所对应的峰面积值, 实验中进行5次拉曼测试得到的拉曼参数如表3所示。
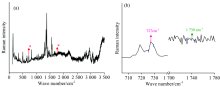 | 图5 (a)青蒿素哌喹片样品拉曼全谱图; (b)谱图范围从700~1 780 cm-1的青蒿素哌喹片拉曼光谱图Fig.5 (a) Raman spectra of artemisinin-piperaquine tablets; (b) Raman spectra of artemisinin-piperaquine tablets integral from 700 to 1 780 cm-1 |
根据前面分析拟合得到的两种二次函数关系式计算中药复方制剂青蒿素哌喹片中青蒿素的含量。 广东新南方青蒿药业股份有限公司生产的青蒿素哌喹片, 其中每片含青蒿素62.5 mg, 哌喹375 mg, 因此青蒿素的实际含量约为14.29%。 表3中列出了青蒿素哌喹片中青蒿素实际含量的真实值, 运用二次函数关系式(1)计算青蒿素含量记为估算值1, 相对误差记为RE%1, 而运用二次函数关系式(2)计算青蒿素含量记为估算值2, 相对误差记为RE%2。
| 表3 运用拉曼光谱法得到的青蒿素哌喹片中青蒿素的峰面积及含量 Table 3 The data of the Raman spectra of artemisinin-piperaquine tablets and artemisinin content determined by Raman analysis method |
对中药复方制剂青蒿素哌喹片通过激光拉曼光谱测试分析后, 应用截距为常数的二次函数关系式(1)对青蒿素哌喹片中青蒿素含量进行5次计算, 得到的估算值1与真实值相比, 相对误差的范围为13.93%17.21%。 而应用截距为0的二次函数关系式(2)进行5次计算, 青蒿素哌喹片中青蒿素含量分别为12.95%, 13.21%, 12.91%, 13.31%和13.01%, 估算值2与真实值比较, 相对误差的范围小于10%, 误差较小。 这表明应用激光拉曼光谱法分析拟合得到的截距为0的二次函数关系式能够比较准确可靠地计算中药复方制剂中青蒿素的含量。
首先对青蒿素标准样品进行激光拉曼光谱定性分析测试, 获得青蒿素拉曼特征图谱。 然后, 在确定青蒿素中724 cm-1和1 736 cm-1处拉曼光谱参数的基础上, 拟合青蒿素质量百分数与峰面积比的函数关系, 进而用于中药复方制剂青蒿素哌喹片中青蒿素的含量检测分析。 通过该方法可以快速获得青蒿素的含量, 未来可以更好地控制含有青蒿素复方制剂的质量, 对青蒿素药物生产及其药理药效研究都具有重要意义。 该方法是一种能够分析青蒿素含量的测试技术和方法, 解决了目前现有的分析技术存在耗时、 处理复杂、 检测成本高等问题, 能够更好地控制含有青蒿素复方制剂的质量, 为青蒿素的研究和应用开创新的局面。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|