作者简介: 孙天磊, 1991年生, 长春理工大学化学与环境工程学院化学硕士研究生 e-mail: 1064726770@qq.com
基于有机-无机杂化材料的理念, 利用稀土硝酸铽[Tb(NO3)3]、 有机配体BINDI (BINDI=N,N'-双(5-间苯二甲酸)-1,4,5,8-萘二酰亚胺)及Keggin型多酸H4SiW12O40·26H2O在溶剂热的条件下反应, 成功合成出多酸基稀土配位聚合物Tb4[SiW12O40]·[BINDI)]2·[DMA]16。 采用X-射线单晶衍射仪、 X-射线粉末衍射仪、 红外光谱仪、 热重分析仪、 紫外-可见吸收光谱仪、 元素分析仪、 荧光光谱仪和电子顺磁共振仪对稀土聚合物的结构组成、 热稳定性、 发光性能以及光致变色性能进行了表征。 X-射线单晶衍射分析发现该稀土配位聚合物结晶于Tetragonal晶系, 空间群为P42/n, 展现出3D手性双螺旋网络结构特征, 其中多酸阴离子SiW12O40(简写为{SiW12})镶嵌在稀土有机基团形成的孔道中; 红外及紫外吸收光谱分析发现稀土Tb3+与配体(BINDI)配位成键; 荧光光谱表明, 在380 nm的激发波长下, 配体显示出最强荧光发射峰, 位于441 nm处, 而化合物的最强发射峰位于471 nm处。 由于三价铽离子不易被氧化也很难被还原, 所以化合物的荧光发射不能归因于金属与配体之间的电子辐射跃迁, 且化合物的发射峰与配体的发射峰比较相近, 因此荧光主要是配体BINDI的发光。 另外Tb(Ⅲ)离子的特殊跃迁发射带没有出现是因为在荧光测试时由于光照的原因导致样品的颜色发生了突变, 即发生了光致变色的现象, 导致光诱导电子转移以致荧光猝灭。 引起金属配合物荧光猝灭的原因通常是光致电子转移, 而电子转移的方向是配体中的电子向金属空轨道转移(LMCT)所致, 形成配合物后其最大发射峰红移或蓝移是由电子转移导致分子内电子分布的改变, 从而引起HOMO-LUMO能隙的减小或增大所致, 与配体荧光光谱相比, 化合物的发射峰发生了红移。 此外, 电子顺磁共振结果表明由于化合物中的BINDI配体在紫外与可见光照射下发生电子转移形成配体自由基, 以及多酸在光激发下, 发生W5+→W6+的过程进一步促进该化合物发生光致变色现象。 因此, 该化合物具有极其敏锐光致变色的性质。
Based on the concept of organic-inorganic hybrid materials, take advantage of the fact that rare earth terbium nitrate [Tb(NO3)3], organic ligands BINDI (BINDI=N,N'-bis (5-isophthalic acid)-1,4,5,8-naphthalenediimide and the Keggin-type polyoxometallate H4SiW12O40·26H2O will react under solvothermal conditions to successfully synthesize a polyacid rare earth coordination polymer Tb4[SiW12O40]·[BINDI)]2·[DMA]16. The structure, composition, thermal stability, luminescence properties and photochromic properties of the rare earth polymer are characterized by X-ray single crystal diffractometer, X-ray powder diffractometer, infrared spectrometer, thermal gravimetric analyzer, ultraviolet-visible absorption spectrometer, elemental analyzer, fluorescence spectrometer and electron paramagnetic resonance spectrometer. X-ray single crystal diffraction analysis revealed that the rare-earth coordination polymer is crystallized in the tetragonal crystal system, and the space group is P42/n, exhibiting the 3D chiral double helix network structural characteristics. Among them, the polyacid anion SiW12O40 (abbreviated as {SiW12}) is embedded in the pores formed by rare earth organic groups; Through infrared and ultraviolet absorption spectroscopy analysis we found that rare earth Tb3+ and ligand (BINDI) have been coordinated to form a bond; Fluorescence spectroscopy indicated that at the excitation wavelength of 380 nm, the ligand shows the strongest fluorescence emission peak at 441 nm, while the strongest emission peak of the compound is at 471 nm. Since the trivalent europium ion is not easily oxidized and is difficult to be reduced, the fluorescence emission of the compound cannot be attributed to the electron radiation transition between the metal and the ligand, and the emission peak of the compound is similar with the emission peak of the ligand. Therefore, the fluorescence is mainly the luminescence of the ligand BINDI. In addition, the special transitional emission band of Tb(Ⅲ) ions does not appear, because the color of the sample has break due to illumination during the fluorescence test, that is, the phenomenon of photochromism has arisen, resulting in photoinduced electron transfer to cause fluorescence quenching. The reason for the fluorescence quenching of metal complexes is usually photoelectron transfer, and the direction of electron transfer is the transfer of electrons in the ligand to the metal orbit (LMCT). The red shift or blue shift of the maximum emission peak after complex formation is caused by the change of electron distribution in the molecule resulting from electron transfer, which gives rise to the decrease or increase of the HOMO-LUMO energy gap. The fluorescence spectrum of the compound is red-shifted compared to the fluorescence spectrum of the ligand. Furthermore, electron paramagnetic resonance spectrometer manifests that owing to the electron transfer of the BINDI ligands in the compound to form free radicals under ultraviolet and visible light irradiation, and the polyoxometallate under light excitation, the occurrence of W5+→W6+ further promotes the photochromism of the compound. Therefore, the compound has extremely acute photochromic properties.
多金属氧酸盐(POMs)是具有丰富的拓扑结构和组成的阴离子型金属氧簇。 拥有独特的氧化还原性和酸性, 是构建功能材料的理想材料。 因此, 可广泛应用于催化、 吸附、 分离、 电化学、 光致变色、 磁性和药物输送[1, 2, 3]等领域。 在材料化学中, POMs可以作为构建模块, POMs与其他金属离子连接, 可以合成纯无机的多酸金属化合物[4, 5]。 POMs也可与有机配体或有机金属配合物相互作用形成杂化材料, 包括POMOFs[6, 7]和POM-macrocation材料[8, 9]。 形成多功能材料一般是通过引入过渡金属配合物, 使其作为连接基团和改性剂并与多金属氧酸盐结合合成出新的POMs杂化物[10, 11]。 迄今为止, 基于POMs的金属有机框架(MOFs)材料的合成主要有两种思路。 (1)MOFs材料是一类多孔固体, 它可以作为各种客体分子的固体容器[12]。 例如, Keggin型POMs簇被引入到Cu-btc, MIL-101和MIL-100框架中, 形成多功能材料[13, 14]。 这些分子器件的设计和构建不仅可以提高单个组分的稳定性, 还可以提高这些MOFs材料的催化效率。 (2)多金属氧酸盐可以作为构建POMOFs的有效连接体, 被认为是构建POMs基骨架材料的有效方法。 例如, 在水热条件下原位形成的Zn(Ⅱ )离子帽式ε -Keggin型POMs被用于构建新颖的POMs基金属有机框架[15]。
相比之下, 基于镧系元素有机-无机杂化物和POMs模板的类似物很少报道[16], 成为当前一个新的研究热点, 特别是镧系元素POMs基配合物可能赋予新的“ 增值” 功能, 如发光, 磁性和催化性能。 然而, 在这些化合物的合成过程中出现了几个问题: (1)亲氧镧系元素离子通常对富氧的POMs具有高反应性, 导致生成沉淀而不是结晶; (2)镧系元素离子与许多N-供体配体表现出相对较低的配位能力, 尤其是在酸性介质中; (3)当使用阴离子O-供体配体时, 例如含多羧酸盐的配体时, 多酸阴离子和阴离子O-供体配体与镧系元素离子之间的反应竞争难以避免并且常常导致意想不到的结果[17]; (4)使用中性的O-供体配体可以为上述问题(3)提供解决方案, 但与中性N-供体配体相比, 中性的O-供体配体仍然处于探索研究中。 因此, 设计和合成新的以POMs为模板的镧系元素有机框架仍然是一个巨大的挑战。
迄今为止, 具有光致变色性质的MOFs材料主要由碱土金属、 过渡金属离子和含有光致变色性质的配体构成。 虽然镧系元素有机骨架(LOFs)中Ln(Ⅲ )离子凭借独特的4f电子而产生发光性能和磁性能, 但对于中心金属原子来说, 具有光致变色特性的LOFs很少被报道[18], 此外, 关于光致变色性质, 由于紫外光的潜在危害和低渗透能力, 使得MOFs的光致变色性质受到了限制, 因此, 可见光响应多功能LOFs的设计和合成也是一个重大创新。
本工作使用多酸H4SiW12O40· 26H2O和半刚性的含氮含羧酸芳香族配体BINDI以及稀土硝酸盐在溶剂热的条件下构筑一个单晶化合物。 基于多酸阴离子的高负电荷易于与金属或苯环发生配位, 制备出镧系元素有机-无机杂化化合物, 并对此晶体进行了结构解析和性质研究, 其中光致变色性质极为突出, 对此进行了相关的探索。
仪器: X-射线单晶衍射仪(Oxford Diffract ion Gemni R Ultra)、 红外光谱仪(Alpha Centaurt FT/IR)、 元素分析仪(Perkin-Elmer 2400)、 热重分析仪(Perkin-Elmer TGA7)、 X-射线粉末衍射仪(Rigaku Dmax 2000 X-ray)、 紫外-可见吸收光谱仪(Cary 500 UV-Vis-NIR)、 荧光光谱仪(Cary Eclipse)、 电子顺磁共振仪(Bruker ELEXSYS E500)等。
试剂: Tb(NO3)3· 5H2O(分析纯, 长春三邦医药科技有限公司)、 C2H4N2(分析纯, 天津光复试剂)、 N, N'-二甲基乙酰胺(DMA)(分析纯, 天津光复试剂)和硅钨酸(分析纯, 西亚试剂)等。
准确称取H4SiW12O40· 26H2O (0.05 g, 0.017 mmol)溶于2 mL乙腈中, 室温下磁力搅拌2~5 min观察乙腈溶液变澄清后, 准确称取Tb(NO3)3· 5H2O (0.030 5 g, 0.07 mmol)和有机配体BINDI (0.021 g, 0.035 mmol)溶于4 mL DMA中并磁力搅拌5~10 min至液相均匀, 然后将两种溶液转移到25 mL的聚四氟乙烯反应釜内衬中, 由室温在35 h时间内升温至100 ℃加热72 h, 以每小时13 ℃的速率降至室温。 绿色针状的晶体过滤、 洗涤、 空气中干燥, 得到产率约为48 %(以铽的原子量计算)的目标化合物。 C60H52N4O80SiTb4W12的元素分析, 理论值: C, 14.56%; H, 1.02%; N, 1.19%。 实验值: C, 14.46%; H, 1.04%; N, 1.12%。
选取透明度高, 大小均一的单晶, 于室温下进行XRD测试, 数据在Oxford Diffract ion Gemni R Ultra单晶衍射仪上收集, 收集得到的单晶数据在Crystal Clear程序还原后使用SHELXS-97软件包直接进行解析处理, 首先利用直接法确定出金属原子的位置, 然后使用差值函数法和全矩阵最小二乘法F2计算出全部非氢原子的坐标及各向异性参数, 最后再理论加氢, 用全矩阵最小二乘法F2对结构进行修正, 并做经验吸收校正。 目标化合物的晶体学数据列于表1中, 其中重要的键长键角列于表2中。
| 表1 化合物的晶体学数据和结构参数 Table 1 Crystalline data and structural parameters of the compound |
| 表2 目标化合物的部分键长和键角数据 Table 2 Partial bond length and bond angle data for the compound |
单晶衍射分析表明化合物结晶于Tetragonal晶系, 空间群为P42/n, 化合物的不对称单元中包含了一个由羧酸O原子连接的Tb原子, 半个BINDI配体, 半个{SiW12}阴离子和四个DMA分子, 半个BINDI配体分子中的两个羧基(Tb(1)-O(8)#1, 2.418(6)Å , Tb(1)-O(9)#1, 2.466(3)Å , Tb(1)-O(14), 2.465(7)Å , Tb(1)-O(17), 2.446(5) Å ), 另外四个氧原子来自于四个DMA分子(Tb(1)-O(15), 2.288(3)Å , Tb(1)-O(18), 2.302(6)Å , Tb(1)-O(19), 2.310 0 Å , Tb(1)-O(20), 2.310 0Å )[图1(a)]。 BINDI配体分子中的四个羧基均是去质子化, 采用μ 1-η 1∶ η 1配位模式连接四个Tb3+[图1(b)]。 Tb(Ⅲ )金属阳离子桥接BINDI配体分子的间苯二酸酯部分, 形成一个无限的螺旋链[Tb2(ip)2(H2O)8
通过阴离子-π 相互作用准确捕获Keggin阴离子{SiW12}作为电荷平衡客体, 以π …π 之间的相互作用力镶嵌在3D网络结构的孔道内, 从而形成稳固的3D结构。 [图2(a, b)]其中存在氢键的相互作用。
在进行相关性质测试之前, 采用粉末X-射线衍射方法验证了化合物的样品纯度。 测试结果的衍射峰与化合物的单晶模拟结果的衍射峰吻合, 表明了化合物的样品纯度较好(图3)。
化合物的热重分析如图4所示, 在50~200 ℃区间内的失重可以归因于配位水分子和游离水分子的损失(理论值: 11.2%, 实际测量值: 10.09%), 随后200~590 ℃区间内, 是溶剂分子的流失, 而第三次失重发生在590~690 ℃区间内, 是有机框架的快速分解导致的。
化合物的红外光谱如图5所示, 在图中782, 924, 982以及1 019 cm-1处时的红外特征峰分别对应标题化合物中{SiW12}的ν (W— Ob— W), ν (W— Oc— W), ν (W═Od)和ν (Si— O)的振动峰, 另外在接近3 000 cm-1的两个峰出现了吸收负值可能是配位效应导致。
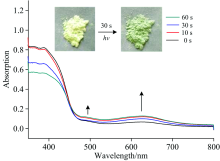
通过紫外-可见吸收光谱以及其固体紫外漫反射对标题化合物进行了相关的测试, 如图6所示, 化合物对在350~800 nm的范围波长内均有光吸收。 然而, 光照射前后的紫外-可见光谱在可见光区域是不同的, 这表明可逆光致变色是由光致电荷转移机制造成的, 而不是结构转变造成的, 图10可以进一步说明光致变色并不是由于光致结构异构化或者光致结构分解产生的。 并且通过固体紫外漫反射光谱, 根据Kubelka-Munk函数(F=(1-R∞ )2/2R∞ )可以计算出化合物的能带间隙为2.64 eV(如图7), 化合物在波长为469 nm处被激发, 说明了标题化合物在可见光区可以被激发成氧化态从而被吸收, 众所周知, POMs可以被光化学还原成混合物种, 1, 4, 5, 8-萘二酰亚胺(NDI)可以在光照射下产生自由基。 因此, 620 nm处的吸收带分配给W5+→ W6+ IVCT(交换电荷转移)的电子转移和500 nm处的带是归属于NDI的π …π 堆叠之间的分子间电子转移(ET)。 这些实验结果说明了化合物有作为可见光区掺杂材料的潜质。
图8为化合物粉末样品和配体在室温条件下测试得到的发射光谱, 激发狭缝宽度为20 nm。 均采用380 nm的光做为激发波长, 配体显示出最强荧光发射峰, 位于441 nm处。 化合物的最强发射峰位于471 nm处。 由于三价铽离子不易被氧化也很难被还原, 所以化合物的荧光发射不能归因于金属与配体之间的电子辐射跃迁, 且化合物的发射峰与配体的发射峰比较相近, 因此荧光主要是配体BINDI的发光。 另外Tb(Ⅲ )离子的特殊跃迁发射带没有出现, 分析认为在荧光测试时由于光照的原因导致样品的颜色发生了突变, 即发生了光致变色的现象, 导致光诱导电子转移以致荧光猝灭, 引起金属配合物荧光猝灭的原因通常是光致电子转移, 而电子转移的方向是配体中的电子向金属空轨道转移(LMCT)所致[19], 形成配合物后其最大发射峰红移或蓝移是由电子转移导致分子内电子分布的改变, 从而引起HOMO-LUMO能隙的减小或增大所致。 与配体荧光光谱相比, 化合物的发射峰发生了红移。
通过电子顺磁共振(EPR)测试可以知道, 化合物在光照前后都在g=2.004 7处出现了强的信号峰(图9)。 一般来说, 只有在光照之后发生光诱导现象从而形成电子转移才会出现强的信号, 但却发现在光照前后都出现了信号, 说明化合物对光有极其敏锐的感应, 在紫外-可见光的瞬时照射下迅速变色, 导致在进行测试时避免不了与光接触。 进而说明光致变色的过程是因为在光照的影响下, 配体BINDI形成氧自由基或配体自由基。 另外在产生光致变色的过程中, 发现化合物颜色变化前后的结构并没有明显的改变, 结果如图10所示。
使用Keggin型多酸H4SiW12O40· 26H2O和半刚性的含羧酸含氮配体BINDI以及稀土硝酸盐在溶剂热的条件下构筑成一种晶态聚合物。 此稀土聚合物晶型结构良好, 性质稳定, 是一种Tetragonal晶系, 空间群为P42/n的具有3D手性双螺旋网络结构的晶态聚合物。 尤其是配合物具有良好的光致变色的性质, 由于化合物中配体BINDI形成氧自由基或配体自由基, 另外多酸在光的影响下凭借其良好的氧化还原特性, 在光诱导电子转移的过程中也会使化合物变色。 在产生光致变色的过程中, 发现化合物变色前后的结构并没有明显的变化, 对以后合成新型稀土有机配位聚合物提供了坚实的理论依据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|