作者简介: 范功端, 1984年生, 福州大学土木工程学院副教授 e-mail: fgdfz@fzu.edu.cn
为探明饮用水处理中ClO2预氧化高藻水过程DOM三维荧光特征的变化规律, 采用三维荧光光谱研究了ClO2预氧化过程藻类胞内外溶解性有机物组分变化, 并通过荧光体积积分法定量分析了DOM组分变化规律。 结果表明, 高含铜绿微囊藻原水的IOM荧光特征光谱有4个较为明显的荧光峰, 主要为类酪氨酸类物质与类色氨酸类等代表的蛋白类荧光峰、 腐殖酸类荧光峰、 富里酸类荧光峰及可溶性微生物代谢产物峰, 占比分别为14.52%, 48.27%, 16.22%和20.99%; 而EOM荧光特征光谱只有1个较为明显的荧光峰, 主要为可溶性微生物代谢产物, 占比为63.14%, 藻类有机物主要含在IOM中。 在经过0.5 mg·L-1的ClO2预氧化后, 3 min内叶绿素a的去除率达到73.58%, IOM中以氨基酸、 蛋白质及富里酸为代表的Ⅰ区、 Ⅱ区及Ⅲ区物质释放至胞外并被ClO2氧化为类腐殖质。 随着ClO2预氧化的进行, 藻细胞不断破裂, IOM释放到水中, 造成胞外EOM总响应值的提高, 即EOM总响应值增加了54.89%, 而IOM总响应值降低了51.50%。 因此, 饮用水处理高藻水时应该特别注意藻细胞IOM的释放, 应选用合适氧化时间, 在保证除藻效果良好的情况下, 尽可能减少IOM的释放; 该研究将为饮用水预氧化除藻及藻类消毒副产物的控制提供一定的理论基础和科学依据。
In order to explore the three-dimensional fluorescence characteristics of DOM during the preoxidation process of high algae-laden water with ClO2, the three-dimensional fluorescence spectroscopy technique was used to qualitatively investigate the changes of the composition of intracellular and extracellular organic matters in algae, and the quantitative analysis of changes in DOM composition was performed by fluorescence regional integral method. The results showed that the IOM fluorescence spectrum of the raw water containing high concentration of Microcystis aeruginosa had four distinct fluorescence peaks, which were protein fluorescence peaks, humic acid fluorescence peaks, fulvic acid fluorescence peaks, and soluble microbial metabolites peaks that were represented mainly by tyrosine-like substances and tryptophan-like proteins with 14.52%, 48.27%, 16.22% and 20.99%, respectively. While the EOM fluorescence spectrum had only one significant fluorescence peak with 63.14% that was mainly behalf of soluble microbial metabolites, and algae organics were mainly contained in IOM. The removal rate of chlorophyll a reached to 73.58% within 3 minafter preoxidation process with 0.5 mg·L-1 ClO2. During this process, substances in the regions Ⅰ, Ⅱ, and Ⅲ represented by amino acids, proteins, and fulvic acid respectively were released to outside of the algal cell membrane, and then were oxidized to non-biological humus by ClO2. Owing to algal cells burst constantly, IOM was released into the water during the ClO2 preoxidation process, leading to the results that the total response value of EOM increased by 54.89% within 3 min and the total response value of IOM decreased by 51.50%. Therefore, the drinking water treatment of high algae-laden water should pay close attention to the release of IOM from the algae cells. The appropriate preoxidation time and dosage should be properly selected, and the release of IOM should be reduced as much as possible under the premise of effective algae removal.This study will provide further theoretical and scie.pngic basis for the removal of algae by pre-oxidation in drinking water and the control of algae disinfection by-products.
水体富营养化已成为重要的全球性环境问题之一, 富营养化水体常引发藻类大量繁殖, 暴发水华[1]。 含高浓度藻类的原水(高藻水)对饮用水净水工艺运行会造成极大的影响, 甚至引起供水中断, 如2007年太湖水华蓝藻暴发引发无锡饮水断供一周[2]。 对高藻水处理时, 由于藻细胞表面的电负性, 生成的表面络合物附着在絮体颗粒表面, 阻碍颗粒的相互碰撞结合, 大大增加了混凝剂的消耗量[3]。 藻细胞形态、 运动性及其胞外有机物(extracellular organic matter, EOM)与胞内有机物(intracellular organic matter, IOM)浓度会影响预氧化效果。 在水处理过程中, 粘附于藻细胞表面的EOM对藻细胞具有保护作用, 会减弱消毒剂的氧化作用。 EOM中酸性物质能与混凝剂的水解产物发生反应, 产生的絮体密度低, 沉淀性不佳, 影响混凝效果。 当混凝阶段未能完全去除的藻细胞会继续繁殖, 附着于滤池表面并堵塞滤层, 由藻细胞光合作用产生的气泡也会阻碍水流通过, 如果不及时处理将缩短过滤周期, 降低产水率, 部分藻类还会穿透滤池, 影响出水水质。 IOM内含有大量的藻类有机物质, 包括有机质、 藻毒素和嗅味物质等[4], 这些物质往往是消毒副产物的前体物, 对人类健康会产生极大的影响; 如果处理不当, IOM中有机物容易释放到水中, 大大增加水处理的难度, 而常规工艺对于此类物质的去除效果不佳[5]。
当前, 水厂除藻的方法主要包括气浮、 强化混凝法和氧化剂氧化等, 然而, 气浮除藻过程受制于混凝条件、 表面活性剂以及气泡特性等因素的影响, 除藻效果不够理想, 且常出现藻类穿透的问题。 强化混凝法主要通过增加混凝剂的投加量或投加助凝剂来达到强化混凝的效果, 但该方法容易造成水中的残余的铁、 铝的浓度超标, 对供水管道以及人体健康造成不利的影响[6]。 ClO2是目前水厂中最常用的消毒方式之一, ClO2能与有机物、 无机离子等发生氧化还原反应, 其有效氯含量约为氯气的2.63倍, 具有很强的氧化能力[7], 因此, 采用ClO2消毒的水厂常用ClO2预氧化除藻, 但是ClO2预氧化除藻过程中产生的藻类有机物的变化及其规律还未引起广泛关注, 藻类分泌的IOM和EOM, 在消毒过程中与消毒剂发生取代反应, 是三氯甲烷、 卤乙酸及卤代烃等有机消毒副产物的前体物, 对人类健康存在潜在的威胁, 同时EOM中的腐殖酸类物质会抑制微囊藻毒素的降解[8]。 IOM和EOM氯化消毒过程还会产生N, N-二甲基亚硝胺消毒副产物[9], 且IOM贡献更大。 高藻水DOM在预氧化过程中有机物如果不加以控制, 会产生大量的消毒副产物, 使水质更加恶化, 因此, 探究ClO2预氧化除藻过程中高藻水DOM的变化规律就显得尤为重要。
藻液中DOM主要来源于藻类IOM和EOM, 含有未饱和脂肪链的各种官能团以及多种芳香环结构[10], 这些结构均在激发态下具有荧光性, 可用荧光光谱技术检测研究。 近年来, 三维荧光分析技术被一些研究人员用于水质跟踪调查中[11]。 但是, 关于采用三维荧光技术对饮用水净化除藻过程中荧光特性变化的相关研究还未有过报道。 故本文选取福州市某水厂作为实际考察水厂, 通过在预氧化阶段投加0.5 mg· L-1 ClO2预氧化去除藻细胞, 选取蓝藻水华中最常见的铜绿微囊藻作为研究对象, 通过测定预氧化过程叶绿素a的含量变化考察ClO2预氧化除藻效果, 并结合三维荧光技术探究含藻水中DOM组分变化情况, 采用荧光体积积分法(fluorescence regional integration, FRI)对其变化过程进行分析, 得到DOM组分变化规律, 以期为实际生产中预氧化除藻提供参考, 同时为后续消毒副产物的控制与研究提供理论基础。
1.1.1 ClO2的制备
纯ClO2溶液制备采用盐酸法[12], 其制备装置主要为5个1 L的锥形瓶串联组成, 顺序标记为A, B, C, D和E瓶。 实验时B— D用锡纸包裹以达成避光条件。 A为洗气瓶, 其内含大约600 mL超纯水, 前端通过空气泵鼓入空气, 进气速度为0.27m3· h-1。 B为反应溶液, 配置3%NaClO2+3%HCl反应溶液, 保证酸过量。 C瓶含有600 mL亚氯酸钠饱和溶液, 吸收制取过程中产生的氯酸盐。 D瓶为超纯水, 吸收产生的ClO2气体, 从而得到最终制取的ClO2溶液。 E瓶含有600 mL 10%的碘化钾溶液, 作为尾气吸收瓶。
1.1.2 高藻水的配置与预氧化实验
为了使原水藻类达到高藻水浓度, 实验中往原水加入一定量的实验室培养的铜绿微囊藻(Microcystis aeruginosa, 编号FACHB-905购自中国科学院野生生物种质库)。 铜绿微囊藻培养所用光照培养箱温度设置为30 ℃, 光照强度控制在2 000 lux左右, 光暗周期为12 h: 12 h。 采用BG-11培养基进行藻种培养, 培养基配方参考Zhou等的研究[13], 并用磷酸二氢钾与氢氧化钠缓冲溶液将pH值调至7.25。 实验采用对数生长阶段的铜绿微囊藻。 实验前先通过分光光度计(UV-2000, UNICO, US)测定在680 nm处的吸光度值, 确定实验藻细胞浓度, 并用原水稀释至1 L, 实验时藻密度为3.0× 105个· mL-1, 考察ClO2浓度为0.5 mg· L-1除藻效果, 并在预设时间时投加硫代硫酸钠猝灭反应并取样待测。
EOM和IOM的提取采用离心法[14], 采用离心机(TDL-5-A, 上海安亭科学仪器厂, 中国)进行离心, 取500 mL水样在8 000 r· min-1转速下离心10 min, 取上清液, 然后采用0.45 μ m玻璃纤维膜(OE67, Whatman, UK)过滤, 滤后水即为EOM溶液。 离心管底部和滤膜上残留的藻细胞用超纯水冲洗稀释, 并采用冻融法进行3次冷冻/解冻操作, 采用0.45 μ m玻璃纤维膜过滤, 滤出水即为含IOM的溶液。
1.3.1 除藻效果的测定
通过测定叶绿素a的含量来反映藻类的去除效果[15], 预氧化后水样采用0.7 μ m玻璃纤维(GF/F, Whatman, UK)过滤, 过滤后滤膜置于-40 ℃冰箱中冻融3次, 并在10 mL丙酮溶液中避光浸泡12 h后测定其叶绿素a含量。 叶绿素a测定在分光光度计上完成, 以3 500 r· min-1的速度离心待测样品15 min, 将90%丙酮作为参比溶液, 分别测定750, 664, 647和630 nm波长处的吸光度值。 按照下列公式[16]计算叶绿素的浓度, 每组实验做三组平行样以得到叶绿素a误差线。
1.3.2 EEM分析
通过荧光光谱分析仪(FS5, Edinburgh Instruments, UK)测定IOM与EOM的三维荧光。 激发波长Ex设定为220~450 nm, 发射波长Em为290~530 nm, 激发波长与发射波长的步长均为5 nm, 狭缝宽度均为3 nm。 样品装入1 cm光程石英荧光样品池测定荧光强度并由光子数表示。 测定数据经过超纯水校正二级瑞利散射后, 根据Em与Ex波长范围将荧光区域划分五个区: Ⅰ 区(Em< 330, Ex< 250)与Ⅱ 区(330< Em< 380, Ex< 250)主要有机组分来源为芳香类蛋白质; Ⅲ 区(380< Em< 500, Ex< 250)为类富里酸; Ⅳ 区(Em< 380, Ex> 250)为微生物代谢产物; Ⅴ 区(Em> 380, Ex> 250)为腐殖质类物质[17]。 用Origin 9.1软件绘制三维荧光图谱, 并用MATLAB10.0分析EEM数据。 采用Zhou[18]的方法进行FRI分析。
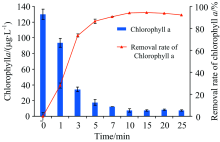
考察预氧化时间(1, 3, 5, 7, 10, 15, 20和25 min)对除藻效果的影响, 预氧化时间为0 min组为对照组, 以此计算各组叶绿素a去除率。 实验设定ClO2投加量为0.5 mg· L-1, 反应初始pH值为7.0± 0.1, 反应温度为(22± 0.5) ℃。 预氧化时间对于叶绿素a含量的影响情况见图1。
由图1可知, 0.5 mg· L-1ClO2对于藻细胞的去除效果较好, 在10 min内去除率即达到94.21%。 叶绿素a在0~1 min的去除率达到27.99%。 在ClO2反应初始时, 藻细胞群体对于ClO2有一定忍耐度, 因而1 min内去除效果较低, 仅27.99%; 随后忍耐度达到极限, 藻细胞被大量去除, 叶绿素a在3 min时去除率达73.58%。 预氧化5 min后藻浓度去除效果明显趋缓, 在10 min之后去除率基本无上升, 主要是由于投加的ClO2已经被消耗殆尽。
藻类通过光合作用形成藻类有机物。 藻类有机物包括EOM和IOM, EOM是藻细胞正常生长繁殖过程中由代谢作用释放到水环境的有机物[19]; IOM存在于藻细胞内, 由于细胞自身分解作用而形成, 当藻细胞衰亡破裂时, IOM会由细胞内释放至水体中[20], 未经ClO2预氧化的高藻水的EEM分析见图2。
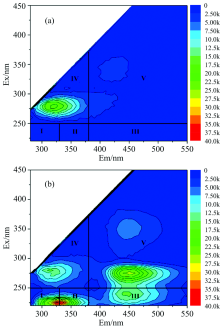 | 图2 高藻水DOM三维荧光特征光谱 (a): EOM; (b): IOMFig.2 Three-dimensional fluorescence characteristic spectrum of DOM in high algae-laden water (a): EOM; (b): IOM |
由图2(a)可知在不投加ClO2时, 原始藻悬浊液EOM荧光特征光谱有一个较为明显的荧光峰, 位于Ex/Em: 270~280/320~330, 定义为T1峰, 以类色氨酸类物质为主, 代表可溶性微生物代谢产物[21]; 还有一个强度较低的峰, 为腐殖酸类物质, 出峰位置Ex/Em: 325~370/400~450, 腐殖质是藻类的分泌物以及藻细胞死亡后被微生物分解而产生的, 腐殖质的荧光响应值低说明藻类活性高。 图2(b)所示IOM荧光特征光谱有4个较为明显的荧光峰, 其中除了前述T1峰以外, 在Ex/Em: 225/325位置有一蛋白类荧光峰, 主要为类酪氨酸类物质与类色氨酸类等蛋白类物质, 定义为T2峰; 在Ex/Em: 225~235/450位置有一类富里酸荧光峰, 定义为A峰。 在Ex/Em: 275/435~450位置有一类腐殖酸荧光峰, 定义为C峰。 此外在Ex/Em: 325~350/450位置有一响应值较小的腐殖类荧光峰。 峰T1和峰T2所表征的荧光特性物质属于藻细胞内部具有丰富活性的生化有机物, 正常的蓝藻细胞中含有多种物质, 具有荧光特性基团的物质主要有蛋白质(酶、 藻蓝蛋白)、 多肽(藻毒素)、 氨基酸和DNA等[22]。 峰A和C主要为类富里酸和类腐殖酸物质, 可能来源为死亡的藻细胞以及冻融过程中所破坏而产生的有机物。 对比图2(a)(b)两图可得, 虽然EOM与IOM的EEM图谱出峰位置不同, 但主要物质皆以蛋白类物质为主, 腐殖酸与富里酸类物质占比较少。
2.3.1 EEM定性分析
为了全面了解0.5 mg· L-1ClO2预氧化高藻水过程中DOM的变化情况, 分别在预氧化开始后1, 3, 5, 7, 10, 15, 20和25 min时间点, 对水样进行三维荧光分析, 预氧化过程中高藻水IOM和EOM三维荧光特征各个时间段变化过程见图3与图4。
由图3可以看出, 随着预氧化的进行IOM中以芳香族蛋白质为代表的Ⅰ +Ⅱ 区荧光响应值逐渐减小, 以类腐殖质为代表的Ⅲ +Ⅴ 区荧光响应值也逐渐减小, 可溶性微生物代谢产物荧光响应值(Ⅳ 区)略微减小。 与此相对应的EOM中腐殖酸类(Ⅴ 区)的荧光响应值随着预氧化的进行逐渐增大, 说明IOM中的类腐殖质在藻细胞破裂后进入到了水中导致了EOM中的腐殖酸类物质荧光响应值的增大(见图4)。 另一方面EOM中的芳香族蛋白质(Ⅰ +Ⅱ 区)和富里酸类物质(Ⅲ 区)几乎没有荧光响应。
2.3.2 EEM定量分析
对EEM特性光谱进行FRI分析可以得到ClO2预氧化过程中胞内外有机物荧光强度总含量及各分区含量, 其结果见图5和图6。
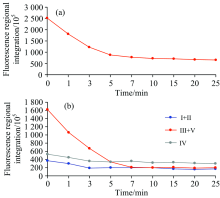 | 图5 预氧化过程中IOM的(a)总荧光和(b)分区荧光响应值Fig.5 Fluorescence response of (a) total fluorescence and (b) partition fluorescence of IOM during preoxidation process |
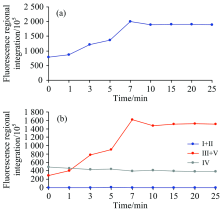 | 图6 预氧化过程中EOM的(a)总荧光和(b)分区荧光响应值Fig.6 Fluorescence response of (a) total fluorescence and (b) partition fluorescence of EOM during preoxidation process |
图5(a)中可知, IOM响应值总量随着预氧化时间增加而下降。 当预氧化时间为5 min时, IOM响应值总量由原藻液的252 003 690下降至88 206 106, 降低了65%; 三维荧光总响应值在1~3 min这段时间内下降程度最为明显; 在10 min后三维荧光总响应值含量总体保持恒定。 通过图5(b)以分析在不同分区IOM响应值的变化, 10 min内Ⅰ +Ⅱ 区的响应值从36 631 950下降到19 893 146基本达到稳定, Ⅲ +Ⅴ 区的响应值从162 497 990下降到20 449 514基本达到稳定。 各区响应值含量基本随着预氧化时间增加呈下降趋势, Ⅲ 区与Ⅴ 区荧光强度响应值下降最为显著。
由图6(a)可知, 随着预氧化过程的进行, EOM荧光强度总响应值从78 400 645逐渐上升, 直至预氧化时间为7 min达到200 948 105后略微下降, 7 min内EOM总响应值提高了156%; 在5~7 min EOM显著提高, 10 min后荧光强度基本保持恒定, 荧光总响应值达到了189 440 967。 由图6(b)可知, 类腐殖质(Ⅲ +Ⅴ 区)及可溶性微生物代谢产物(Ⅳ 区)与EOM总荧光响应值的变化趋势基本一致, 而以氨基酸、 蛋白质和富里酸为代表的Ⅰ , Ⅱ 和Ⅲ 区物质几乎没有荧光响应, 这与图5的荧光图谱变化相一致, 可能的原因是IOM中Ⅰ 区、 Ⅱ 区和Ⅲ 区物质在藻细胞破裂后立刻被氧化为无生物性的类腐殖质。 随着预氧化时间的不断增加, 除藻率明显上升, 且在预氧化时间为7 min时有明显突越。 在10 min后, 随着投入的ClO2消耗殆尽, 时间的增加不会增加除藻率, 藻细胞不再破裂释放IOM, 从而计算的EOM响应值恒定。
综合叶绿素a与EEM的分析, 在ClO2浓度为0.5 mg· L-1的情况下, 可以将预氧化时间设置在3 min内。 在此段时间内, 叶绿素a的去除率达到了73.58%, 而且此时IOM释放量相对比较少, EOM提高了54.89%。
采用0.5 mg· L-1的ClO2预氧化来处理高藻水效果较好, 随着预氧化时间的增加除藻效果也随之增加, 作用3 min后去除率即达到73.58%。 ClO2会破坏藻细胞结构诱导IOM释放到水中从而增强了EOM的荧光响应强度。 在预氧化前, EOM荧光特征光谱只有一个较为明显的荧光峰, 主要为可溶性微生物代谢产物, IOM中主要是以氨基酸、 蛋白质及富里酸为代表的Ⅰ 区、 Ⅱ 区及Ⅲ 区物质。 随着ClO2预氧化的进行, 藻细胞破裂, IOM释放到水中, 造成EOM总响应值的提高, IOM总响应值降低了51.50%, 而EOM总响应值增加了54.89%。 因此, 高藻水处理时应该特别注意藻细胞IOM的释放, 应选用合适浓度的氧化剂与氧化时间, 在保证除藻效果良好的情况下, 尽可能减少IOM的释放。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|