作者简介: 张 妍, 1989年生, 天津科技大学天津市制浆造纸重点实验室博士研究生 E-mail: 15122753563@163.com
利用合适的溶剂液化生物质不仅可以把木质纤维资源转化成液体燃料, 还可以将得到的低分子降解产物制备成所需的化学品和化工原料。 选用价格低廉的多羟基醇类液化剂进行液化, 研究了二甘醇(diethylene glycol, DEG)混合1,2-丙二醇(1,2-propanediol, PG)、 传统的乙二醇(ethylene glycol, EG)混合PG (均6:1 ω/ω)分别作为液化剂对玉米秸杆液化得率和所得生物油产品性能的影响。 并采用气质联用技术(GC-MS)、 傅里叶红外光谱技术(FTIR)、 热裂解气相色谱-质谱联用技术(Py-GC/MS)和X-射线衍射技术(XRD)对玉米秸秆、 生物油及液化残渣的纤维特性进行了分析。 结果表明, 当DEG与PG混合液化时, 玉米秸秆生物油的得率为98.57%; 而EG混合PG时的液化得率为96.08%。 GC-MS分析表明, 玉米秸秆生物油的主要组成成分为醇类和有机酸类, 总含量高达97%以上, 而EG混合PG液化所得的生物油中含有有机酸将近60%, 这是造成生物油具有酸性和腐蚀性的主要原因, 不利于液化反应的进行; 利用FTIR检测生物油中一些分子量较大的低聚物的相应官能团, 以弥补GC-MS检测的局限性, 结果表明了液化体系中生成了很多活泼化学键, 提高了反应体系的活性, 并且生物油中包含了大量的C—O和C=O官能团, 有力地佐证了GC-MS的检测分析结果。 对两种液化残渣进行表征, Py-GC/MS结果表明, 液化残渣的成分比较复杂, 含有一定量非常难降解的大分子物质。 这些物质可能是反应后期裂解的小分子重新聚合生成的大分子物质; 可能是玉米秸秆本身存在一些不能被液化降解的成分; 还有可能是降解的小分子物质与液化剂之间相互反应生成的新的高分子化合物。 通过FTIR表明, 在液化过程中, 液化残渣中纤维素、 半纤维素和木质素的特征吸收峰都消失了, 表明三大组分的基本结构单元都被破坏, 三大组分都发生了液化, 并且木质素降解程度最大。 利用XRD对液化残渣进行表征, 液化破坏了碳水化合物所构成的聚合物晶体结构, 导致纤维素大分子被裂解, 表明纤维素在液化作用下遭到降解, 液化程度高。 最终, 该实验选取液化效果较好的DEG复配PG作为玉米秸秆液化时的溶剂, 这也为玉米秸秆液化生产低成本、 高品质的生物油提供了一种高效、 环保的工艺流程。
It is a significant technique for choosing proper solvents during liquefaction of biomass process to produce fuel additives and valuable chemicals. In this study, the mixtures of new low-cost diethylene glycol (DEG) with 1,2-Propanediol (PG) and the traditional ethylene glycol (EG) with PG (6:1 ω/ω) were adopted as liquefying agents. And analyses were conducted to throw light on the effects of these two different liquefying agents on the liquefaction yield and the properties of the biomass liquefaction oil products. The properties of the corn stalk, bio-oil and residue were studied with gas chromatography and mass spectrometry (GC-MS), Fourier transform infrared spectroscopy (FTIR), pyrolysis-gas chromatrography/mass spectrometry (Py-GC/MS) and X-rays diffraction (XRD). The results indicated that when the DEG and PG were cooperatively used as liquefying agent, the liquefaction yield was 98.57%. And there was a liquefaction yield of 96.08%, with the mixture of EG and PG as liquefying agent. GC-MS analysis results showed that the main components of bio oils were alcohols and organic acids, with a total content of more than 97%. However, the bio oil obtained by EG mixed PG liquefaction contained nearly 60% of organic acids, which was the main cause of the acidity and corrosiveness of the bio oil, and was not conducive to the liquefaction. The characteristic absorption peaks of the corresponding functional groups of some oligomers in the bio oil were detected by FTIR to compensate for the limitation of the GC-MS characterization. It turned out that many active chemical bonds were generated in the liquefaction system, leading to improving the activity of the reaction system, and the bio oil contained a large number of C—O and C=O functional groups, which strongly supported the results of the conclusions of GC-MS. Furthermore, Py-GC/MS, FTIR and XRD were applied for the characterization of the liquefaction residues. Py-GC/MS explained that the liquefaction residue composition produced in this way was complicated and contained a certain amount of large molecular substances which were very difficult to degrade. The liquefaction residues were mainly originated from the polycondensates or derivatives of interactions between small molecules of lignin or hemicellulose degradation or unreacted cellulose, and the macromolecular substances generated by the reaction of the degradation products of three components and liquefying agents. The signals of FTIR reported that the functional groups of cellulose, hemicellulose and lignin were disappeared and the liquefaction degree of lignin was the largest. Results from XRD presented that because of the destruction of crystalline structure of carbohydrates, the cellulose molecules was cracked, indicating that the cellulose was degraded and the degree of liquefaction was high. Consequently, all the results successfully confirmed that the liquefaction effect of DEG mixed PG was better than the mixture of EG and PG. Even it provided an efficient and environmental process for generating bio-oil from lignocellulosic mass at a low cost in liquefaction of corn stalk.
当前, 随着全球经济的快速发展, 造成了环境的恶化和石化能源的匮乏, 故而寻找开发廉价、 环保、 可持续的再生能源已刻不容缓[1]。 由于生物质能具有可再生、 储运便利等优点而成为新型能源的首要选择。 并且人们正在加大力度研发利用生物质能, 使其具有一定的商品化与规模化, 在全球能源框架中占有重要地位[2]。
常压催化液化是一种高效的木质资源综合利用技术[3], 它是在低于200 ℃的温度和常压下, 选取合适的溶剂以及催化剂将生物质转变成液体的热化学反应[4]。 液化之后所得产物的种类繁多, 其用途更是遍及众多领域。 不但能够制备便于贮存和运输的液体产物来取代一部分石化产品, 而且还能够制取低分子的降解产物来用作多种化工产品或化学原料。
对于常压催化液化, 选择优良而又廉价的液化剂是该方法的重中之重, 它能够使粉末状原料混合的足够均匀和分散, 可以大大提高产物油的液化得率。 如果选择的液化剂类别有差异, 那么液化产生的生物油、 分子量以及液化效果也不尽相同[5]。 本实验主要针对多元醇液化剂的选取, 在比较温和的液化条件下进行。 以玉米秸秆为原料, 选择复配多元醇溶剂为液化剂, 在高压反应釜中制备玉米秸秆生物油。 考察了二甘醇(diethylene glycol, DEG)和乙二醇(ethylene glycol, EG)分别复配1, 2-丙二醇(1, 2-propanediol, PG)作为液化剂时对玉米秸秆三大组分的降解作用和液化效果的影响, 并通过一系列检测方法对玉米秸秆、 生物油及液化残渣的纤维特征进行了分析。
原料: 玉米秸秆(来源于天津塘沽农田), 经植物试样粉碎机粉碎过筛, 粒径是20~80目, 平衡水分后备用。
主要试剂: 1, 4-二氧六环、 二甘醇、 乙二醇、 1, 2-丙二醇、 浓磷酸、 吡啶, 分析纯; 硅烷化试剂(BSTFA 90%, TMCS 10%)、 溴化钾, 色谱纯(国药集团化工有限公司)。
仪器: 4848型高压反应釜(PARR, 美国); 650型傅里叶变换红外光谱仪(Bruker, 德国); 单击式PY-2020iS热裂解器(Frontier, 日本); 7890A型气相色谱仪-5975C型质谱仪(Agilent, 美国); XRD-6100型X-射线衍射仪(Shimadzu, 日本)。
1.2.1 玉米秸秆的液化
将一定量的玉米秸秆粉放入高压反应釜中(温度精度± 2 ℃), 然后加入10%催化剂(浓磷酸)和一定量用PG分别复配DEG和EG(1:6 ω /ω )的液化剂, 液固比为5:1, 混合均匀后进行液化实验。 转速为338 r· min-1, 温度升高到规定温度时开始计时, 60 min后反应完毕, 打开冷凝水冷却至室温。
1.2.2 液化得率的测定
将液化产物用80%的1, 4-二氧六环洗涤溶解转移至烧杯中, 磁力搅拌30 min后进行离心(转速10 000 r· min-1, 温度10 ℃, 时间15 min)。 上层液体通过旋蒸去除溶剂, 获得浓缩液(生物油)。 下层固体在已恒重滤纸上使用旋蒸回收的溶剂和去离子水洗涤过滤后, 将其放到105 ℃烘箱, 恒重后称取质量, 并计算液化得率以及残渣率(残渣率定义为二氧六环不溶物占玉米秸秆绝干质量的质量百分比[6])。
1.2.3 液化产物的分析
1.2.3.1 生物油GC-MS分析
硅烷化条件: 取20 mg的生物油, 用N2将溶剂挥发干净, 置于真空干燥箱中干燥(温度40 ℃, 时间30 min)。 完成后, 分别注入吡啶和硅烷化试剂80和150 μ L, 摇匀后将其置于70 ℃烘箱中进行45 min硅烷化处理[7]。 最后用0.22 μ m的微孔滤膜(有机系)进行过滤。
GC条件: HP-5MS色谱柱(30 μ m× 250 μ m× 0.25 μ m), 使用高纯氦气作为载气, 气流量设为1.00 mL· min-1; 分流比设为10:1; 进样量为0.2 μ L; 进样口温度是300 ℃, 溶剂延迟3 min。 升温程序设置: 初始温度80.0 ℃, 保留3.00 min, 以5 ℃· min-1升温速率达到150 ℃, 再以10 ℃· min-1升温速率升至300 ℃并保留5 min, 总共运行时间为37 min。
MS条件: 离子源和四级杆温度分别设为230和150 ℃, EI电离方式。
1.2.3.2 生物油与液化残渣FTIR分析
利用KBr压片法对试样的官能团进行表征, 分辨率为4 cm-1下扫描16次[8]。
1.2.3.3 液化残渣Py-GC/MS分析
取0.1 mg左右的样品放入裂解石英管中, 在预设裂解温度600 ℃下反应12 s。 裂解气在高纯He吹扫下进入GC-MS系统, 总流速14 mL· min-1, 分流比10:1, 分流流量10 mL· min-1。
柱箱程序设置: 初始柱温为40 ℃并保留5 min, 然后以升温速率为10 ℃· min-1加热到280 ℃, 终温停留3 min, 总共运行时间32 min。
GC和MS接口温度都是280 ℃, 离子源和四级杆温度分别为230和150 ℃, EI扫描模式, 质谱质量数扫描范围50~800 amu。
1.2.3.4 液化残渣XRD分析
利用X-射线衍射仪对样品(玉米秸秆及液化残渣)的结晶形态进行检测, 用Cu-Kα 射线(λ =1.54 Å )进行辐射, 扫描角度2θ =5° ~40° , 扫描速度4° · min-1 [9]。
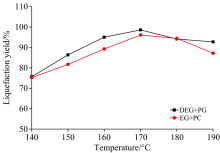
在液化体系中一直存在着两个反应: 裂解和聚合, 反应初始阶段主要发生裂解反应, 而终止反应阶段则以聚合为主[10], 转折点是由原料类别和反应条件共同作用决定的[11]。 由图1可知, 以DEG和EG分别复配PG作为液化剂时, 最适宜的反应温度都是170℃, 此时的液化得率最高, 分别为98.57%和96.08%。 当温度由140 ℃上升至170 ℃时, 两组液化剂作用所得的玉米秸秆液化得率都提高了20%以上。 其原因是在液化过程中, 反应介质会逐步渗透到构成玉米秸秆的主要组分的微组织结构中, 使分子间的连接遭到破坏, 并且还可以降解一些纤维素分子。 当液化得率达到最高值前, 可能此时的环境适合木质素的裂解, 使得其液化反应较快, 但此时纤维素和半纤维素的反应相对平缓。 当达到最适温度170 ℃时, 反应速率可以达到峰值, 此时反应进行的最快。
可当温度进一步上升至190 ℃时, 液化得率却下降了接近6%, 这是由于液化系统中的物质在较高温度、 酸催化影响下能够发生缩聚反应而生成新的物质(不溶于有机溶剂)[7]。 说明温度过高不利于玉米秸秆催化液化反应的进行。
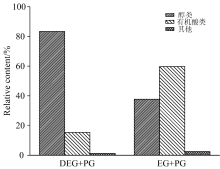
由图2两种生物油总离子流图(TIC)可以看出, 两个谱图中的峰值分布相近, 虽然相同出峰时间下检测出的物质基本相同, 但同种物质出现的峰高不同, 这说明选取不同液化剂对生物油组分含量有很大的影响[12]。 TICs图中各色谱峰对应的质谱图经分析, 鉴别出的化学组分见表1。 以DEG混合PG为液化剂所得生物油包含35种能够分析出来的有机物; 而EG和PG混合液液化所得生物油中含有31种可以检测出来的有机物。 各化学组分含量根据面积归一化法表征, 其结果见图3。
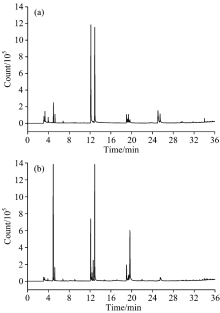 | 图2 不同液化剂液化所得生物油的GC-MS总离子流图 (a): DEG+PG; (b): EG+PGFig.2 GC-MS total ion chromatogram of bio oils (a): DEG+PG; (b): EG+PG |
| 表1 两种生物油的主要化学族类含量分布 Table 1 Amounts of main compounds in two bio oils |
由图3和表1所示, 液化剂不同, 导致两种生物油的化学成分也不尽相同。 即使每一种生物油本身都具有特有的成分, 但是其组成的主要化学成分来源于相同族类, 它们都以醇类和有机酸为主。 使用DEG和EG分别复配PG作为液化剂, 其生物油含有的醇类为83.41%(12种)和37.75%(12种); 有机酸为15.38%(15种)和59.72%(11种); 还存在少许的酯、 酮和酚类等物质。 可能是多元醇产生的自由基和玉米秸秆中各组分液化生成的小分子中间体自由基之间经过聚合、 环化等而使两者自由基反应产生了醇、 酸、 醚类等小分子化合物。 利用液化获得富含羟基的液化物可以合成多种聚合材料, 如: 胶黏剂[13], 聚氨酯泡沫塑料[14], 酚醛树脂[15], 聚酯纤维[16]等。 在液化产物中产生的有机酸是造成其具有酸性和腐蚀性的主要原因, 这对液化反应来说是不利的。
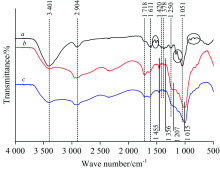
由图4所示, 与玉米秸秆相比, 生物油在3 401 cm-1处的O— H的伸缩振动峰的强度明显减弱, 原因是到了液化后期阶段玉米秸秆中的羟基受到磷酸和多元醇的作用重新聚合生成了水分子或其他的小分子化合物[6]。 在1 420~1 250 cm-1区间内, 这是因为纤维素、 半纤维素和木质素发生裂解导致生物油中的一些取代基改变, 从而使得生物油的吸收峰发生转移[17]。 1 718 cm-1处是来自糖类的羰基, 而两种生物油在此处的吸收峰的强度强于玉米秸秆的。 原因是碳水化合物在液化时裂解产生了大量的羰基类物质或是木质素发生裂解反应产生了酸或酮类物质[8]。 与玉米秸秆中1 718~1 378和1 250~1 051 cm-1中的吸收峰强度相比较, 生物油中的明显降低乃至消失, 这种现象是由两方面因素引起的。 一是玉米秸秆中的木质素发生裂解产生新的物质; 二是在液化终止阶段液化剂的含量会逐步降低。 897 cm-1处是由C1基团振动或环振动引起的葡萄糖单元间β -糖苷键的特征吸收峰。 两种生物油与玉米秸秆相比, 在此处的吸收峰强度减弱甚至消失。 原因是糖类物质在液化时发生了反应形成了一些不能溶于1, 4-二氧六环的物质[18], 这也是造成生物油含有大量C— O官能团的原因[7]。
Py-GC/MS技术因其具有样品使用量少、 分离效率高、 分析速度快、 产物定性准确以及重现性好等优点, 而被广泛应用于高聚物的化学结构和热解特性的探究中。 由图5两种液化残渣TICS可以看出, 两个谱图中的峰值分布存在差异, 其相对峰高也略有不同, 两个谱图图形较为复杂, 这说明使用DEG, EG分别复配PG参与液化反应所得残渣化合物的种类相似、 相对含量会有差别, 以及化合物种类比较复杂。
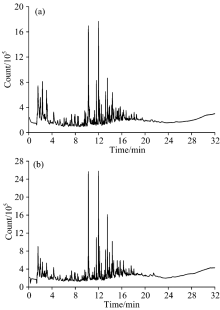 | 图5 不同液化剂液化所得液化残渣的总离子流图 (a): DEG+PG; (b): EG+PGFig.5 Total ion chromatogram of liquefaction residues (a): DEG+PG; (b): EG+PG |
采用面积归一化法, 图谱库识别出的化学成分具体分布见图6和表2。 能够识别出以DEG复配PG为液化剂所得液化残渣中含有82种有机物; 而用EG复配PG参加液化反应所得液化残渣中包含的有机物是102种。 两种液化残渣中都以含量高于32%的酚类物质居于榜首; 烃类次之, 含量达到21%以上; 呋喃类物质也都高于11%; 酮类达到了5%以上。 此外还含有少量的醇、 有机酸、 醚、 酯、 醛、 糖类等, 这与生物油所含主要成分趋势相反, 说明在液化过程中纤维素、 半纤维素和木质素反应良好。 液化残渣可能是在反应后期裂解的小分子重新聚合成大分子物质; 可能是玉米秸秆本身存在一些不能被液化降解的物质; 还有可能是降解的小分子物质与液化剂反应生成了难溶于80% 1, 4-二氧六环溶剂的物质, 这些都造成液化残渣热裂解时的复杂性。
| 表2 两种液化残渣的主要化学族类含量分布 Table 2 Amounts of main compounds in two liquefaction residues |
由图7所示, 与玉米秸杆的FTIR相比, 1 724 cm-1处是与苯环相连的醛、 酮或酯基以及来自糖类化合物的特征吸收峰[19], 两种液化残渣在此处的峰强度有所提高, 其原因是液化过程中糖类降解生成较多的羰基化合物, 或是液化时生成的醛基连接在构成木质素的基本单元上形成较稳定的结构。 1 618 cm-1处的吸收峰是木质素中C=O伸缩振动引起的, 1 506 cm-1处吸收峰归属于木质素苯环骨架伸缩振动, 而两种液化残渣在此两处的吸收峰强度明显减弱, 甚至消失, 这表明木质素在液化过程中发生了降解。 1 444 cm-1处的吸收峰来自CH2的弯曲振动, 1 239 cm-1处的吸收峰是由连接在木质素的愈创木基核上的— OCH3引起的, 残渣在此两处的吸收信号显著降低, 甚至消失, 原因是木质素中β -O-4上的C— O键发生断裂, 产生了大量的小分子物质, 导致残渣中含有极少的C— O键连接在木质素的β 位上。 两种液化残渣在1 371 cm-1处的吸收峰几乎消失, 原因是木质素在液化作用下降解为小分子结构单元, 这些物质在抽滤时会被洗去, 致使其在液化残渣中存在量较小。 由三大组分的特征峰可知, 在液化过程中, 木质素、 纤维素和半纤维素都发生液化, 而且木质素发生变化的程度最大。
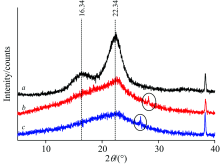
如图8所示, 玉米秸秆存在较为平整晶面: 次峰(16.34° )和主峰(22.34° ), 这是纤维素I型的结晶结构[20]。 而两种液化残渣的主峰晶体结构遭到毁坏而形成弥散峰, 次峰的多糖晶体结构完全消散, 产生了无定形物质, 原因是纤维素和半纤维素所构成的聚合物晶体结构在液化作用下全部遭到破坏, 致使纤维素大分子被降解, 表明纤维素的液化程度相当高。 曲线b的弥散峰强于c, 这说明EG混合PG作为液化剂时产生大量的无定形残渣物质。 此外, 曲线b和c分别在26.72° 和28.30° 处出现了新的衍射峰, 说明有新的晶面产生, 新晶面可能属于液化反应中新生成的高分子化合物。
在170 ℃时, 浓磷酸催化作用下, 分别以DEG, EG混合PG作为液化剂对玉米秸秆粉进行液化, 其液化得率为98.57%和96.08%。 DEG与PG复配的液化残渣率小于2%, 可作为玉米秸秆液化的良好溶剂。 玉米秸秆生物油的组分复杂, 以醇类和有机酸类为主, 总含量高达97%以上; 而EG混合PG所得的生物油中有机酸类接近60%, 这是造成生物油具有酸性和腐蚀性的主要原因, 不利于液化反应的进行。 并且生物油包含了大量的C— O和C=O官能团, 有力地佐证了GC-MS的检测分析结果。 所选液化剂对玉米秸秆中的三大组分具有良好的降解作用, 破坏碳水化合物所构成的聚合物晶体结构, 致使纤维素大分子被降解, 且木质素在液化时发生降解的程度最大, 使得液化残渣的成分比较繁杂。 综合表明, DEG复配PG作为液化剂时要优于EG与PG复配的液化效果。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|