作者简介: 乔 金, 1991年生, 东北师范大学紫外光发射材料与技术教育部重点实验室硕士研究生 E-mail: qiaoj338@nenu.edu.cn
采用细叶蜈蚣草( Egeria najas)作为受试植物, 分别用不同浓度的ZnO NPs处理细叶蜈蚣草六天, 通过OJIP荧光动力学曲线和脉冲瞬态荧光动力学曲线评估暴露在不同浓度的ZnO NPs悬浮液中的细叶蜈蚣草的光合性能。 当细叶蜈蚣草暴露在ZnO NPs悬浮液中, 光系统Ⅱ关闭的净速率( MO)、 J点的相对可变荧光强度( VJ)和单位反应中心用于热能耗散的能量(DI0/RC)有明显的下降趋势( p<0.05), 最大光化学量子效率( ΦP0)、 捕获的激子中用来推动电子传递的效率( Ψ0)、 电子传递的量子产额( ΦE0)、 实际光化学量子效率( ϕ'PSⅡ)有上升的趋势( p<0.05)。 表明ZnO NPs增强了光系统Ⅱ反应中心之间的连通性、 促进了光系统Ⅱ受体侧的电子传递和光能的利用, 即ZnO NPs在某些方面促进了细叶蜈蚣草的光合作用。 用相应浓度的Zn2+溶液来处理细叶蜈蚣草, 当细叶蜈蚣草暴露在Zn2+溶液中, 光系统Ⅱ关闭的净速率、 J点的相对可变荧光强度和单位反应中心用于热能耗散的能量有明显的上升趋势( p<0.05), 最大光化学量子效率、 捕获的激子中用来推动电子传递的效率、 电子传递的量子产额、 实际光化学量子效率有下降的趋势( p<0.05), 单位反应中心吸收的光能(ABS/RC)、 捕获的光能(TR0/RC)和非调节性能量耗散量子产量( ϕ'NO)有明显的上升趋势( p<0.05), 即Zn2+降低了光系统Ⅱ反应中心之间的连通性、 抑制了光系统Ⅱ受体侧的电子传递和光能的利用并使反应中心失活, 即Zn2+抑制了细叶蜈蚣草的光合作用。 在ZnO NPs处理细叶蜈蚣草的实验中并没有发现光合作用受抑制情况, 表明ZnO NPs的促进作用强于其释放的游离Zn2+的抑制作用。
In this study, we selected Egeria najas as the sample plant, which was exposed to different concentrations of Zinc oxide nanoparticles (ZnO NPs) suspensions for six days. The effects of different concentrations of ZnO NPs on photosynthetic processes of Egeria najas were explored respectively, by analyzing the O-J-I-P fluorescence induction dynamics curve and the pulse transient fluorescence induction dynamics curve. ZnO NPs strengthened the connectivity between photosystem Ⅱ (PSⅡ) units, promoted the efficiency of the electron transport at the acceptor side of PSⅡ and the utilization of the absorbed light energy, indicated by the significant decrease ( p<0.05) in the net rate of PSⅡ closure ( MO), the relative variable fluorescence intensity at phase J ( VJ) and the effective dissipation of an active RC(DI0/RC), and the significant increase ( p<0.05) in the maximum quantum yield of primary photochemistry ( ΦP0), the efficiency with which a trapped exciton can move an electron into the electron transport chain further than
由于氧化锌纳米粒子(ZnO NPs)具有大比表面积效应和较强的氧化还原能力, 因此ZnO NPs已经被广泛地用于化妆品、 橡胶、 医学、 化学纤维、 电子工业和其他领域[1]。 人们将ZnO NPs加入到防晒霜中, 使其能有效地吸收长波紫外线[2]。 ZnO NPs有抗衰老、 抗摩擦、 低消耗和长寿命等优点, 因此它可以作为高速耐磨橡胶制品的添加剂[3]。 ZnO NPs有抗菌、 脱臭和自清洁等特点, 被用于卫浴产品当中[4]。 然而, 在生产、 使用和处理过程中, ZnO NPs不可避免地释放到环境当中。 据统计, ZnO NPs每年的生产总量在550~5 550 t, 其产量大约是任何其他纳米材料的10~100倍[5]。 在欧洲, 天然水和海水中ZnO NPs的含量分别是10和430 ng·
叶绿素a荧光检测在过去的几十年已经被广泛地应用到光合作用研究中, 对于分析光合生物对各种因素的生理反应。 这一技术是具有便捷、 可靠、 对生物体没有影响的优点。 叶绿素a荧光检测是通过测量光系统Ⅱ 发出的叶绿素a荧光的变化来分析植物光合作用受到的影响[11]。 光系统Ⅱ 的荧光产量主要受到两方面的影响, 一方面是光系统Ⅱ 反应中心绑定的醌受体的氧化还原(光化学荧光猝灭, qP), 另一方面是在光系统天线色素分子中发生的热能耗散。 在适应光照的过程中, 这种耗散性能的增强来源于非光化学荧光猝灭(NPQ)。 目前, 人们一般用两种不同的方法来测量叶绿素a荧光: (1) 经过暗适应处理后, 用一个短的饱和脉冲光来测量快速荧光动力学曲线。 (2) 在几分钟的光化光适应后, 叶绿素a荧光达到稳态, 通过加饱和脉冲光的方法测量荧光产量从而分析稳态下的光合作用情况[12]。 通过用脉冲振幅调制荧光仪(PAM)测量非光化学荧光猝灭可以得到发生在光系统Ⅱ 中的调节性能量耗散量子产量、 非调节性能量耗散量子产量和实际光化学效率[13]。 通过用植物效率分析仪(PEA)测量快速叶绿素荧光诱导动力学曲线(OJIP曲线)可以获得更多的信息。 OJIP曲线反应了光系统Ⅱ 受体侧电子从微秒级到秒级的电子传递情况, 曲线中可以得出一些重要信息。 例如在光系统Ⅱ 中的能量捕获、 电子传递、 天线复合体上的激发能依靠质子梯度的热能耗散等[14]。 因此本文就通过这两种叶绿素a荧光检测法研究ZnO NPs对细叶蜈蚣草光合作用的影响。
有研究者认为ZnO NPs的毒性是由其悬浮液中溶解释放的Zn2+造成的[9, 10, 15], 故配置了相应浓度的Zn2+用来处理细叶蜈蚣草, 检测Zn2+对细叶蜈蚣草光合作用的影响, 并与ZnO NPs作对照。 结果表明ZnO NPs在某些方面促进了细叶蜈蚣草的光合作用, 而当Zn2+浓度为0.4 mg· L-1时, Zn2+就已经抑制了细叶蜈蚣草的光合作用。
ZnO NPs购买于Sigma-Aldrich, 粒径范围< 50 nm(BET), 纯度> 97%。 ZnSO4· 7H2O购买于天津市福晨化学试剂厂。 细叶蜈蚣草(Egeria najas)购买于水族养殖场。 挑选生长良好, 粗细、 长度均匀, 生长状况一致的细叶蜈蚣草, 用去离子水冲洗干净, 置于10 L的玻璃鱼缸中, 在室温下用去离子水(UPH-IV-10T, 四川优普超纯科技有限公司)培养, 并且用植物生长灯(SY-ZWD-1200W, 广西三熠照明电器有限公司)每天光照8 h, 光强大约100 mol· m-2· s。
用分析天平(XS205DU, Switzertand)称取15 mg的ZnO NPs加入到150 mL的去离子水中水浴超声(KQ-250DB, 350 W, 昆山市超声仪器有限公司)5 min, 得到150 mL浓度为100 mg· L-1的ZnO NPs悬浮液。 然后用去离子水将150 mL的悬浊液稀释成50 mL的20, 40, 60, 80和100 mg· L-1的悬浮液分别置于5个100 mL的烧杯中。 用分析天平称取2.0 mg的ZnSO4· 7H2O加入到226 mL的去离子水中, 得到浓度为2.0 mg· L-1的ZnSO4溶液, 然后用去离子水将其稀释成50 mL的0.4, 0.8, 1.2, 1.6和2.0 mg· L-1的溶液分别置于5个100 mL的烧杯中。
随机挑取三根生长良好, 长短、 粗细相同, 生长状况一致的细叶蜈蚣草作为受试植物。 将每一根的根部与顶部切掉, 剩下的中间部分均匀地分成十二段。 将这十二段随机抽取, 每两段为一份, 每一根细叶蜈蚣草分为六份, 一共三根, 共计三组。 将这三组细叶蜈蚣草分三种方式进行处理。 处理一, 将一组细叶蜈蚣草分别放置到六个盛有50 mL去离子水的烧杯中。 此处理用于研究每一根细叶蜈蚣草的不同部分的光合性能是否有差别。 处理二, 将另一组细叶蜈蚣草分别暴露在浓度为0, 20, 40, 60, 80和100 mg· L-1的ZnO NPs悬浮液中(0 mg· L-1为50 mL的去离子水)。 处理三, 将最后一组细叶蜈蚣草分别暴露在浓度为0, 0.4, 0.8, 1.2, 1.6和2.0 mg· L-1的溶液中。 用封口膜将烧杯口封住, 用光强约为100 mol· m-2· s的植物灯, 将以上三组细叶蜈蚣草在室温下每天光照8 h, 培养6 d。 然后从每一个烧杯中的两段蜈蚣草各摘取三片叶片, 随机将每段中两枚叶片分为一组, 每段中剩余的叶片组成一组, 共分为三组, 从而对每个烧杯中的细叶蜈蚣草进行三次叶绿素荧光探测。 测试前, 将样品放入叶夹内进行暗适应15~20 min。
1.4.1 快速叶绿素荧光诱导动力学曲线的测量
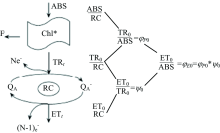
利用便携式叶绿素荧光仪(Yaxin-1161G, 北京雅欣理仪科技有限公司)在室温下测量快速叶绿素荧光诱导动力学曲线(OJIP曲线)。 470 nm的蓝光LED作为激发光源, 采用性能优异的PIN硅光电二极管探测波长为685 nm的叶绿素a荧光。 激发光的持续时间设置为10 s, 光强为3 500 mol· m-2· s。 采样速率分别为: 在300 μ s以前每10 μ s一次, 300 s~30 ms每100 s一次, 30~300 ms每10 ms一次, 300 ms~1 s每100 ms一次, 1~10 s每1 s一次。 一般将20 μ s处的荧光强度标记为O值(FO), 分别把2和30 ms的荧光强度标记为J(FJ)和I(FI)点, 饱和光照条件下的最大荧光值标记为P(FM)点。 图1是光系统Ⅱ 能量流简化模型。 吸收的能量(ABS)表示天线叶绿素吸收的光子。 一部分激发能以荧光和热能的方式耗散, 另外一部分被反应中心所捕获, 即捕获的能量(TR)。 一般把QA还原成
为了分析OJIP暂态, Strasser引入了JIP测定[16]。 表1列举了一些JIP测定参数, 参数的计算公式和简单的解释说明。
| 表1 快速叶绿素荧光诱导动力学曲线(O-J-I-P)分析中使用的参数 Table 1 Formulae and terms used in the analysis of the O-J-I-P fluorescence induction dynamics curve |
1.4.2 脉冲瞬态荧光动力学曲线的测量
将叶绿素荧光仪的测量方式设置成脉冲瞬态荧光动力学曲线测量模式。 在此测量模式下, 首先光源会发射出一束持续时间为1 s的蓝光饱和脉冲, 波长为470 nm、 光强为3 500 mol· m-2· s, 可以测得叶片的最大叶绿素荧光(FM)。 接着用蓝色的光化光, 强度为100 mol· m-2· s, 可以测得稳态荧光(FS), 在荧光处于稳态的基础上用饱和脉冲可以测得稳态下的实际最大叶绿素荧光(F'M)。
一条完整的荧光动力学曲线包括O-J-I-P快速上升的过程和P-S-M-T缓慢下降最终达到稳态的过程。 P-S-M-T缓慢下降过程的变化情况反应了两方面的调整。 一方面, 光合机构通过使用光和磷酸化产物(ATP, NADPH), 卡尔文循环能力增强。 另一方面, 吸收的能量主要用于光化学电子传递和天线色素的热能的耗散。 热能的耗散主要以非光化学猝灭的形式进行, 这种形式一般受类囊体的质子梯度和玉米黄素的数量调控[11]。 因此我们可以通过脉冲瞬态荧光动力学曲线的测量, 从中得到光系统Ⅱ 能量耗散的几个参数。 表2列举了这几个参数, 参数的计算公式和简单的解释说明。
| 表2 脉冲瞬态荧光动力学曲线分析中使用的参数 Table 2 Formulae and terms used in the analysis of the pulse transient fluorescence induction dynamics curve |
每组实验均重复三次以上, 数据处理采用SSPS 23.0软件进行方差分析, 采用ANOVA方法对实验数据进行差异显著性分析(检验标准为, p< 0.05 )。 * 表示p< 0.05, * * 表示p< 0.01。 实验结果表示方式为平均值± 标准差。
通过对去离子水中培养的细叶蜈蚣草进行叶绿素a荧光的探测, 经统计分析后, 发现反映植物光合作用的一系列荧光参数并没有发生明显的变化且显著性水平p均大于0.05。 从而说明同一根细叶蜈蚣草不同部分的光合作用情况并没有明显的差别。
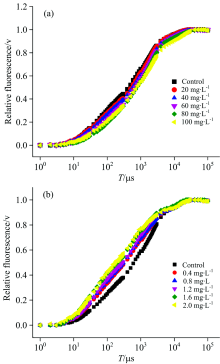
细叶蜈蚣草在经过ZnO NPs和Zn2+处理6 d之后, 光合作用的变化如图2所示, 我们可以看到O, J, I和P点大致发生在20 μ s, 2, 30和400 ms处。 在图2(a)中可以明显看出, 细叶蜈蚣草经过ZnO NPs处理之后, 初始荧光的斜率和J点的相对可变荧光强度随着浓度的增加有减小的趋势。 在图2(b)中, 当细叶蜈蚣草经过Zn2+处理之后, 初始荧光的斜率和J点的相对可变荧光强度随着浓度的增加有增大的趋势。
通过JIP测定计算出相应的荧光参数来分析ZnO NPs和Zn2+对光系统Ⅱ 的影响。 从图3(a)中可以看出, 当ZnO NPs的浓度处于20~80 mg· L-1, 光系统Ⅱ 关闭的净速率(MO)和J点的叶绿素a相对可变荧光强度(VJ)有明显降低的趋势(p< 0.05), 当浓度处于80 mg· L-1时, MO降低了33.4%, VJ降低了20.5%, 但是当浓度达到100 mg· L-1, MO和VJ降低的趋势并不明显(p> 0.05)。 这可能是由于ZnO NPs处于高浓度时, 团聚增强, 从而影响了其对细叶蜈蚣草的作用[8, 18]。 在图3(b)中, 当Zn2+浓度处于0.4~2.0 mg· L-1时, MO和VJ会随着浓度的增加有明显增加的趋势(p< 0.05), 当Zn+浓度处于2.0 mg· L-1时, MO增加了89%, VJ增加了47.6%。
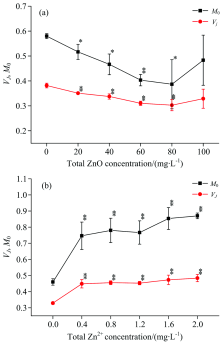 | 图3 ZnO NPs(a)和Zn2+(b)对光系统Ⅱ 关闭的净速率和J点的叶绿素a相对可变荧光强度的影响Fig.3 Effect of ZnO NPs (a) and Zn2+ (b) on the net rate of PSⅡ closure and chl-a relative variable fluorescence at J-step |
图4描述了经过ZnO NPs和Zn2+处理之后, 单位反应中心吸收的光能(ABS/RC)、 捕获的光能(TR0/RC)、 用于电子传递的能量(ET0/RC)和用于热耗散的能量(DI0/RC)都有不同程度的变化。 在图4(a)中, ABS/RC, TR0/RC和DI0/RC随着ZnO NPs的浓度增加有降低的趋势。 当ZnO NPs浓度处于40和60 mg· L-1时, ABS/RC降低明显(p< 0.05); TR0/RC只在浓度处于60 mg· L-1时有明显的降低(p< 0.05); 当ZnO NPs的浓度处于20~80 mg· L-1时, DI0/RC有明显的降低(p< 0.05)。 但是经过ZnO NPs处理后, ET0/RC几乎保持恒定, 没有发生明显变化(p> 0.05)。 在图4(b)中, ABS/RC, TR0/RC和DI0/RC随着Zn2+浓度的增加有明显的增加的趋势(p< 0.05); 而ET0/RC仍然几乎保持恒定, 并没有发生明显的变化(p> 0.05)。 当Zn2+浓度处于2.0 mg· L-1时, ABS/RC增加了45.8%, TR0/RC增加了28.6%, DI0/RC增加了107.7%。
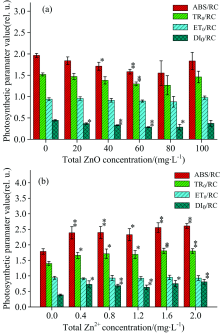 | 图4 经过ZnO NPs(a)和Zn2+(b)处理后, 细叶蜈蚣草光系统Ⅱ 的能量流发生的变化Fig.4 Change in the energy fluxes within PSⅡ for Egeria najas exposed to ZnO NPs (a) and Zn2+(b) |
图5描述了经过ZnO NPs和Zn2+处理之后, 细叶蜈蚣草光系统Ⅱ 能量利用率的变化。 在图5(a)中, 随着ZnO NPs浓度的增加, 最大光化学量子效率(Φ P0)、 捕获的激子中用来推动电子传递的效率(Ψ 0)和电子传递的量子产额(Φ E0)有上升的趋势, 浓度在20~80 mg· L-1之间有明显的上升趋势(p< 0.05), 当浓度处于80 mg· L-1时, Φ P0, Ψ 0和Φ E0分别上升了5.6%, 12.8%和19%。 在图5(b)中, 随着Zn2+浓度的增加, Φ P0, Ψ 0和Φ E0有明显的下降的趋势(p< 0.05)。 当Zn2+浓度在2.0 mg· L-1时, Φ P0, Ψ 0和Φ E0分别下降了11.9%, 23.1%和32.3%。
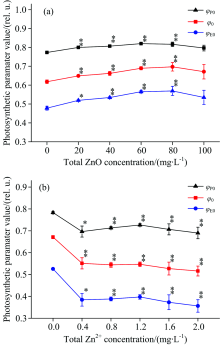 | 图5 经过ZnO NPs(a)和Zn2+(b)处理后, 细叶蜈蚣草光系统Ⅱ 能量利用率的变化Fig.5 Changce of energy fluxes ratios of PSⅡ in Egeria najas exposed to ZnO NPs (a) and Zn2+(b) |
图6描述了经过ZnO NPs(a)和Zn2+(b)处理后, 细叶蜈蚣草单位面积含有活性反应中心的数量(RC/CS)发生的变化。 在图6(a)中, 随着ZnO NPs浓度的增加, RC/CS几乎保持恒定, 没有发生明显的变化(p> 0.05)。 在图6(b)中, 随着Zn2+浓度的增加, RC/CS有明显的下降趋势(p< 0.05), 当浓度在2.0 mg· L-1时, RC/CS降低了66.1%。
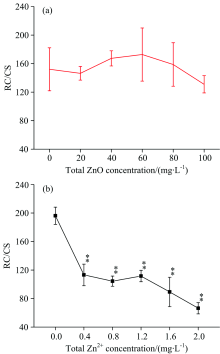 | 图6 经过ZnO NPs(a)和Zn2+(b)处理后, 细叶蜈蚣草单位面积含有活性反应中心的数量发生的变化Fig.6 Change of the amount of active PSⅡ reaction centers per cross section for Egeria najas exposed to ZnO NPs (a) and Zn2+(b) |
通过脉冲瞬态荧光动力学曲线的测量, 我们可以得到光系统Ⅱ 吸收光能的耗散分配的几个参数, 其中包括光化学能量耗散的方式、 调节性能量耗散方式和非调节性能量耗散方式。 图7描述了经过ZnO NPs(a)和Zn2+(b)处理后, 细叶蜈蚣草光系统Ⅱ 吸收能量的耗散过程的变化。 在图7(a)中, 随着ZnO NPs浓度的增加, 光系统Ⅱ 的实际光化学量子效率(ϕ 'PSⅡ )有增加的趋势, 当浓度处于40~100 mg· L-1时, 增加的趋势比较明显(p< 0.05); 而调节性能量耗散量子产量 (ϕ 'NPQ)和非调节性能量耗散量子产量(ϕ 'NO)有降低的趋势, 但降低趋势不明显。 在图7(b)中, 随着Zn2+浓度的增加, ϕ 'PSⅡ 降低明显(p< 0.05), ϕ 'NO升高明显(p< 0.05), 而ϕ 'NPQ有先增加后降低的趋势。
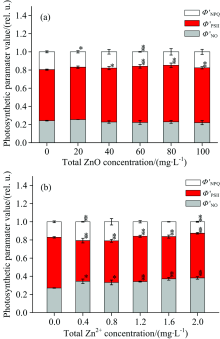 | 图7 经过ZnO NPs(a)和Zn2+(b)处理后, 细叶蜈蚣草光系统Ⅱ 吸收能量的耗散过程的变化Fig.7 Change of energy dissipation processes for PSⅡ in Egeria najas exposed to ZnO NPs (a) and Zn2+ (b) |
经过快速叶绿素荧光诱导动力学曲线和脉冲瞬态荧光动力学曲线的测量以及相应光合作用荧光参数的统计分析, 可以得出ZnO NPs和Zn2+对细叶蜈蚣草光合作用的影响。 当细叶蜈蚣草经过ZnO NPs处理后, 光系统Ⅱ 关闭的净速率和J点的叶绿素a相对可变荧光强度有明显的下降趋势, 最大光化学量子效率、 电子传递的量子产额、 捕获的激子中用来推动电子传递的效率煌光系统Ⅱ 的实际光化学量子效率有明显的上升趋势, 这表明在电子传递和吸收光能的利用方面, ZnO NPs对细叶蜈蚣草的光合作用有促进的作用; 当细叶蜈蚣草经过Zn2+处理后, 通过分析光系统Ⅱ 受体侧的变化、 光系统Ⅱ 单位反应中心能量流的变化和光系统Ⅱ 能量耗散的变化, 得到Zn2+抑制了细叶蜈蚣草光合作用的影响。
已有研究表明, ZnO NPs会对植物产生有毒的影响。 这些影响可能来源于氧化锌纳米粒子产生的活性氧(ROS)对细胞产生氧化胁迫, ZnO NPs悬浮液中Zn2+的释放以及氧化锌纳米粒子对细胞造成的物理损伤[19]。 Lin等[18]用ICP的方法测得100 mg· L-1的ZnO NPs悬浮液中Zn2+的浓度大约在1 mg· L-1。 Shaymurat等[20]对浓度在10~50 mg· L-1的ZnO NPs悬浮液中的Zn2+浓度进行了检测, 结果表明, 其浓度为0.353~1.936 mg· L-1。 所以本实验将Zn2+溶液的浓度配置成0.4, 0.8, 1.2, 1.6和2.0 mg· L-1。 分别用ZnO NPs和Zn2+对细叶蜈蚣草(Egeria najas)进行处理, 通过快速荧光动力学曲线和脉冲瞬态荧光动力学曲线的测量, 分析比较二者对细叶蜈蚣草光合作用的影响。
首先, OJIP曲线反映了光系统Ⅱ 电子受体库的一系列变化。 很多实验结果和理论模拟已经表明, J点与
其次, 通过脉冲瞬态荧光动力学曲线的测量, 我们可以发现, 光系统中的电子传递经过光合机构的一系列调控, 进入了平稳状态, 即叶绿素a荧光达到了稳态。 这些调控机制包括叶黄素循环和卡尔文循环等。 结合图6和图7, 经ZnO NPs处理后, 反应中心并没有失活, 实际光化学量子效率(ϕ 'PSⅡ )增加而调节性能量耗散量子产量(ϕ 'NPQ)和非调节性能量耗散量子产量(ϕ 'NO)有不同程度的减少, 说明ZnO NPs促进了光系统Ⅱ 反应中心将吸收的光能用于光合电子传递的效率; 经过Zn2+处理后, 一些光系统Ⅱ 反应中心失活, 而非调节性能量耗散量子产量(ϕ 'NO)的增加也反映了光系统Ⅱ 反应中心受到了损伤, 可见这两者的结果是相一致的, 而非调节性能量耗散量子产量(ϕ 'NO)出现先增加后降低的趋势, 这可能是由于调节性能量耗散这种保护机制不能应对更高浓度的锌离子。 实际光化学量子效率(ϕ 'PSⅡ )的减少就说明了Zn2+抑制了光系统Ⅱ 反应中心将吸收的光能用于光合电子传递的效率。
用去离子水、 ZnO NPs和Zn2+分别培养细叶蜈蚣草(Egeria najas), 然后对其进行快速叶绿素荧光诱导动力学曲线和脉冲瞬态荧光动力学曲线的测量。 经过去离子水培养后, 细叶蜈蚣草不同部分光合作用情况没有明显差异。 经过ZnO NPs处理后, ABS/RC和TR0/RC降低, 表明ZnO NPs抑制了细叶蜈蚣草叶绿素a的合成, 从而影响了其对光能的吸收; MO, VJ降低表明ZnO NPs增强了光系统Ⅱ 反应中心之间的连通性并促进了光系统Ⅱ 受体侧的电子传递; DI0/RC的降低, Φ P0, Ψ 0, Φ E0和ϕ 'PSⅡ 的上升, 表明ZnO NPs促进了光系统Ⅱ 对吸收光能的利用。 所以ZnO NPs在某些方面促进了细叶蜈蚣草的光合作用。 经过Zn2+处理后, ABS/RC, TR0/RC和ϕ 'NO增加, 表明部分光系统Ⅱ 反应中心失活, 这与RC/CS随Zn2+的浓度的升高而减少一致。 MO, VJ上升, 表明Zn2+降低了光系统Ⅱ 反应中心之间的连通性, 并且抑制了光系统Ⅱ 受体侧的电子传递。 DI0/RC的升高, Φ P0, Ψ 0, Φ E0和ϕ 'PSⅡ 的降低, 表明Zn2+抑制了光系统Ⅱ 对吸收光能的利用。 因此Zn2+抑制了细叶蜈蚣草的光合作用。
很多研究已经表明, ZnO NPs对植物的影响除了来自ZnO纳米粒子自身的性质, 还有可能来自ZnO NPs悬浮液中Zn2+的释放。 从本工作结果来看, 尽管Zn2+对细叶蜈蚣草的光合作用有明显的抑制, 但暴露于ZnO NPs悬浮液中的细叶蜈蚣草的光系统Ⅱ 反应中心电子传递效率依然得到了增强, 从而促进了其光合作用。 这可能是由于ZnO NPs对光合作用的促进要强于其释放的Zn2+对光合作用的抑制。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|