作者简介: 赵明月, 1993年生, 华东理工大学和中国科学院上海硅酸盐研究所联合培养硕士研究生 E-mail: mingyuez@aliyun.com
通过将氢化物发生装置与液体阴极辉光放电发射光谱仪相耦合, 建立了一种定量检测海水中痕量硒、 砷、 汞的方法。 实验对氢化物发生的载酸种类和浓度、 还原剂浓度以及液体阴极辉光放电装置的放电电压、 电解质种类和流速等工作条件进行了优化, 确定了联用仪器定量分析硒、 砷、 汞的最佳工作条件:氢化物发生载酸为5%的HCl, 还原剂为1.5%的NaBH4, 液体阴极辉光放电装置的放电电压为1060V, 电解质溶液为pH 1的HCl, 电解液流速为2.2 mL·min-1。 分别选取204.0, 228.8和253.7 nm作为硒、 砷、 汞的分析谱线, 在上述最佳工作条件下对硒、 砷、 汞的系列混合标准溶液进行测定, 硒、 砷、 汞的质量浓度在2100 μg·L-1范围内与其发射强度呈线性关系, 线性相关系数分别为0.999 2, 0.999 4和0.998 5, 其检出限分别达到0.54, 0.92和1.91 μg·L-1, 浓度为0.1 mg·L-1的硒、 砷、 汞的信号值相对标准偏差均小于3%。 与单一的液体阴极辉光放电发射光谱相比, 硒、 砷、 汞的检出限分别降低了3个、 4个、 2个数量级。 选取国家土壤标准物质GBW07405对联用仪器检测结果的准确度进行了验证, 其检测值与参考值一致; 将该方法应用于中国黄海沿岸实际海水样品中痕量硒、 砷、 汞的定量分析, 分析结果与电感耦合等离子体质谱法一致, 用标准加入法测得其加标回收率在94.9%~105.3%之间。 氢化物发生-液体阴极辉光放电发射光谱能够实现快速、 准确地对海水中痕量硒、 砷、 汞的高灵敏在线定量检测。
In this paper, the trace amounts of selenium, arsenic and mercury in seawater were quantitatively detected by coupling hydride generation (HG) device with solution cathode glow discharge optical emission spectrometry (SCGD-OES). Instrument conditions were optimized, and the optimal instrument conditions for quantitative analysis of selenium, arsenic and mercury were determined: 5% HCl as the carrier acid for subsequent experiments, 1.5% NaBH4 as the reducing agent, the SCGD parameters of the electrolyte, discharge voltage, and flow rate were maintained at pH 1 HCl, 1 060 V, and 2.2 mL·min-1, respectively. Element wavelengths of 203.4, 228.8 and 253.7 nm were selected as the analytical lines of selenium, arsenic and mercury, and the mixed standard solutions of selenium, arsenic and mercury were determined under the optimal working conditions simultaneously. The mass concentration of selenium, arsenic and mercury is linear with the emission intensity in the range of 2100 μg·L-1, and the linear correlation coefficients are 0.999 2, 0.999 4 and 0.998 5, respectively. The detection limits were 0.54, 0.92 and 1.91 μg·L-1. The relative standard deviations of the signal values of selenium, arsenic and mercury are less than 3% at a concentration of 0.1 mg·L-1. Compared with SCGD-OES, the detection limits of selenium, arsenic and mercury are reduced by three, four and two orders of magnitude, respectively. Soil reference material GBW07405 was selected to verify the accuracy of the results of the coupling instrument, and the measured value was consistent with the reference value. The method has been applied to the analysis of trace selenium, arsenic and mercury in seawater samples from the Yellow Sea coast of China and the analysis results are in agreement with those of ICP-MS. The recoveries of standard addition are between 94.9% and 105.3%. HG-SCGD-OES enables highly sensitive on-line quantitative detection of trace amounts of selenium, arsenic and mercury in seawater.
海水中的重金属通过降低海洋的初级生产力, 抑制生物的生化活动, 从而对海洋生态系统和人类健康产生重要影响[1, 2]。 海洋中存在的砷除了对水生生物产生很强的毒性外, 还可通过食物链不断储存积累, 最终进入人体, 对胃肠道、 肝脏、 肾脏、 心血管系统、 神经系统和皮肤产生毒性作用, 从而损害人体健康。 汞及其化合物是剧毒物质, 通过海产类食物进入人体后, 通过影响酶和其他蛋白质的功能和再生对人体造成各种损害。 过量的硒会引起头发干燥易断, 指甲脱落受损, 皮肤损伤和神经系统异常等中毒反应, 严重时会导致死亡。 目前, 对海水中硒、 砷、 汞的检测方法包括原子吸收光谱法(AAS)[3]、 电感耦合等离子体发射光谱法(ICP-OES)[4]、 电感耦合等离子体质谱法(ICP-MS)[5]、 原子荧光光谱法(AFS)[6]等。 由于这些仪器功率高, 体积大, 运行需要消耗大量气体等限制因素使其运行成本大且难以实现现场检测。 且海水中这三种元素的低含量和海水基体的复杂性为痕量检测带来了困难。 液体阴极辉光放电发射光谱法(solution cathode glow discharge-optical emission spectrometry, SCGD-OES)与上述技术相比, 具有设计简单, 运行成本低, 功耗和气体消耗低等优点[7]。 在最近的研究中, 大气压辉光放电已成功地用于自来水、 土壤和湖泊水域等[8, 9, 10, 11, 12, 13, 14, 15]。 氢化物发生法(hydride generation, HG)通过对待测元素的分离富集来降低基体对光谱的干扰, 提高对海水类高盐复杂基体中痕量元素定量分析的灵敏度和准确度。 仪器联用较单种仪器在检测性能方面具有显著优势, 本研究将氢化物发生装置与液体阴极辉光放电光谱联用, 定量测定了海水中硒、 砷、 汞, 旨在建立一种高效定量测定海水中痕量硒、 砷、 汞的方法, 实现对海水中痕量重金属的现场在线检测。
VGA-77氢化物发生器(HG, 美国安捷伦公司), 蠕动泵(BT100-1L, 保定兰格恒流泵有限公司), 高压电源(HSPY-600, 北京汉晟谱源有限公司), 透镜(OLB25-050, 北京卓立汉光仪器仪表有限公司), 三维平台(APFP-XYZ, 北京卓立汉光仪器仪表有限公司), 光纤(Xtreme, 美国海洋光学有限公司), 微型光谱仪(Maya 2000Pro, 波长范围189413 nm), Milli-Q® 水系统(Millipore, Bedford, MA, USA), 电感耦合等离子体质谱仪(ICP-MS, X series Ⅱ , 赛默飞世尔科技公司)。
硒、 砷、 汞标准溶液(1 000 mg· L-1, 钢铁研究总院国家钢铁材料测试中心), NaCl, Na2SO4, NaHCO3, NaOH, NaBH4, HNO3(96%), HCl(37%), H2SO4(98%), 硫脲(≥ 99.0%), 抗坏血酸(≥ 99.7%) (上海国药集团化学试剂有限公司), MgCl2, CaCl2, KCl, KBr, SrCl2, NaF(阿拉丁), 土壤成分分析标准物质(GBW07405, 国家标准物质中心), 海水(中国黄海沿岸)。
配制盐度3.5%的人工模拟海水, 配方[16]见表1, 将实际海水样品加2%的HCl酸化固定后用0.45 μ m的滤纸过滤, 存放在4 ℃冰箱中待用。
| 表1 人工海水的组成成分 Table 1 Chemical composition of artificial seawater |
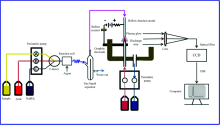
HG-SCGD-OES装置如图1所示。 准确量取1 mL硒、 砷、 汞标准溶液(1 000 mg· L-1), 并用准备好的人工海水稀释1 000倍。 由于样品中硒和砷部分以Se(Ⅵ ), As(Ⅴ )形式存在, 因此在氢化反应前, 要对Se(Ⅵ )和As(Ⅴ )分别进行如下预还原操作:硒的还原剂为5 mol· L-1盐酸, 水浴加热30 min; 砷的还原剂为20 g· L-1硫脲和10 g· L-1抗坏血酸, 还原稳定60 min(本实验中所有含硒、 砷样品均进行如上预还原操作)。 将样品溶液、 载酸和还原剂产生的氢化物导入到SCGD阳极中, 通过毛细管输入pH 1的酸电解质溶液作为SCGD阴极。 废液通过废液管被蠕动泵抽入到废液瓶中。 在常压环境下对两个电极施加高压, 以实现大气压液体阴极辉光放电。 硒、 砷、 汞的气态氢化物通过阳极钛管进入微等离子体中被激发并产生光信号。 将微等离子体、 透镜和光纤探头同轴放置, 调节三者之间的距离, 使能够最大量的收集到放电产生的发射光信号。 通过微型光谱仪的入口狭缝对光信号进行耦合, 由电荷耦合器件(charge coupled device, CCD)进行检测与放大, 最后用光谱配套软件处理。 在数据采集前, SCGD需稳定2 min, 积分时间设为500 ms。
连续进样氢化物发生装置在之前的研究中已做了详细的介绍[17], 本实验以1 mg· L-1 Se, As, Hg溶液为样品溶液, 以制备的人工模拟海水为空白样品。 CCD可以同时捕获Se(204.0 nm), As(228.8 nm), Hg(253.7 nm)的发射谱线。 根据之前的研究[18, 19], 将SCGD 的操作条件设置为: 阳极尖端和阴极液面之间的距离为3.5 mm, 放电电压为1 060 V, 电解质为pH 1的HNO3, 流速为2.4 mL· min-1, 来对HG的操作参数, 如载酸的种类、 浓度、 NaBH4的浓度等进行优化。
2.1.1 载酸的种类选择
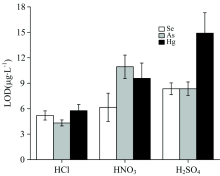
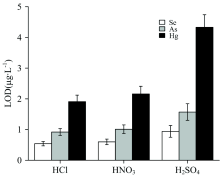
研究4%的HNO3, HCl, H2SO4对氢化物生成的影响。 采用2.0%(m/V)的NaBH4 溶液作为还原剂, 以氩气为载气, 研究了酸种类对检出限(limit of detection, LOD)的影响。 LOD根据公式计算得出, 其中SD是11次连续测量空白样品信号值的标准偏差, k是标准曲线的斜率。 图2显示了在不同酸种类下硒、 砷、 汞的 LOD。
结果表明, 对于硒、 砷、 汞三种元素, 当HCl作为载酸时, 氢化物生成效率最高, 信号强度值最大, 检出限最低。 因此, 选择HCl作为氢化物发生时的载酸。
2.1.2 载酸的浓度选择
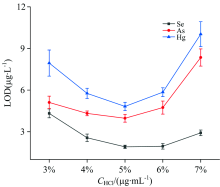
对浓度在1%~5%之间的HCl对氢化物生成的影响进行了研究。 采用2.0%(m/V)的NaBH4溶液作为还原剂, 以氩气为载气。 除背景信号外, 不同的酸浓度也影响着元素的发射强度, 因此, 评估了酸的浓度对LOD的影响。 图3显示了在不同盐酸浓度下硒、 砷、 汞的 LOD。
结果表明, 当HCl浓度较低时, 分析元素不能完全转化为氢化物, 从而导致信号变弱。 当HCl浓度较高时, 随着酸浓度的增加, 气态氢化物中还原氢增加, 目标氢化物被稀释, 导致信号减弱。 结果表明, 当HCl浓度为5%时, 信号强度达到最大值, LOD最低。 因此, 选择5%的HCl作为氢化物发生时的载酸。
2.1.3 NaBH4的浓度选择
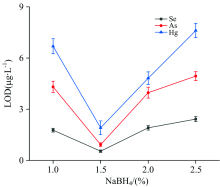
NaBH4的浓度对元素的氢化效率有较大影响。 在以5%HCl为载酸的情况下, 研究了浓度为1.0%3.5%的NaBH4对硒、 砷、 汞氢化物检出限的影响, 结果如图4所示。 当NaBH4浓度较低时, 样品中的硒、 砷、 汞不能有效转化为氢化物。 当浓度过高时, 由于分解反应会产生大量的氢气, 气液分离器中大量气泡会稀释氢化物, 影响微等离子体的稳定性。 此外, 还会造成试剂浪费。 实验结果表明, NaBH4浓度为1.5%时各元素检出限达到最低。 因此, 选择了1.5%的NaBH4作为硒、 砷、 汞氢化物发生的还原剂。
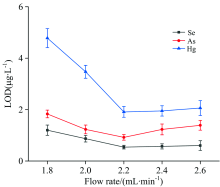
液体阴极辉光放电装置中, 以空心钛管(长35 cm, 外径2.5 mm, 内径1 mm)作为阳极, 它将氢化物发生器产生的气体从玻璃毛细管(内径0.38 mm, 外径1.1 mm)输送到等离子体放电区域。 溢流电解质为阴极, 电极间距为3.5 mm, 限流电阻为1.2 kΩ 。 氢化物发生装置以5%HCl为载酸, 以1.5%NaBH4(溶剂为0.5%NaOH)为还原剂, 对SCGD的放电电压、 电解质种类和流速等操作参数进行了优化。 实验结果如图5— 图7所示。
以硒、 砷、 汞的检出限作为试验指标, 在一定范围内, 检出限随着电压和电解质流速的增加呈现先降低后增加的趋势, 在电压为1 060 V, 电解液流速为2.2 mL· min-1时, 检出限达到最低。 分别以pH 1的HCl, HNO3, H2SO4作为电解液, 考察电解质种类对检出限的影响, 结果表明, 在以HCl为电解质时检出限达到最低。 最终选择的条件为:放电电压为1 060 V, 电解液为pH 1的HCl, 流速为2.2 mL· min-1。 基于以上HG和SCGD参数的优化, 确定了HG-SCGD-OES联用仪器的实验操作条件, 如表2所示。
| 表2 小型化HG-SCGD-OES的优化后操作条件 Table 2 Typical operating conditions of miniaturized HG-SCGD-OES |
在最佳操作条件下, 对本方法的分析性能进行测试。
用3.5%的人工模拟海水配制2, 5, 10, 20, 50和100 μ g· L-1的硒、 砷、 汞混合标准溶液, 人工模拟海水作为标准空白溶液, 连续11次测定标准空白溶液和标准系列的信号强度, 以硒、 砷、 汞等浓度作为横坐标, 信号强度为纵坐标作标准曲线, 以特征波长处的峰高对目标元素进行定量分析。 仪器的分析性能详见表3。
| 表3 HG-SCGD-OES的分析性能(n=11) Table 3 Analytical Response Characteristics of the HG-SCGD-OES (n=11) |
结果表明, 硒、 砷、 汞的标准曲线在2100 μ g· L-1范围内具有较为满意的线性关系, 且信号RSD均小于3%, 具有良好的稳定性。
将本研究构建的HG-SCGD-OES对硒、 砷、 汞的检出限与文献报道的同类仪器检出限对比, 结果见表4。
| 表4 HG-SCGD-OES对硒、 砷、 汞的检出限与文献报道结果比较 Table 4 The LODs of the HG-SCGD-OES compared to other methods of Se, As and Hg |
由表4数据可知, 与液体进样SCGD-OES相比, 硒、 砷、 汞的检出限分别降低了3, 4和2个数量级, 说明氢化物发生进样方式可使仪器检测能力得到大幅提升。 与大型光谱分析仪器如电感耦物合等离子体光谱(ICP-OES)相比检出限亦降低一个数量级以上。 与化学增敏相比, SCGD-OES与氢化物发生方法相耦合得到的检出限更低。 与其他小型激发源, 如大气压辉光放电(APGD, DBD, CCP)相比, 液体阴极辉光放电也具有良好的优势。 虽然相比之前氢化物耦合液体阴极辉光放电光谱单元素检测结果检出限略高, 但本方法具有多元素同时分析的优势。
为了验证分析仪器检测结果的准确度, 选取土壤标准物质GBW07405对HG-SCGD-OES的分析性能进行验证。 用HG-SCGD-OES测定其中硒、 砷、 汞的含量, 结果如表5所示。 结果表明, HG-SCGD-OES的测试值与参考值一致, 说明HG-SCGD-OES的检测结果具有良好的准确度, 能够应用于痕量硒、 砷、 汞元素的检测。
| 表5 HG-SCGD-OES测定标准物质中硒、 砷、 汞的浓度 Table 5 Determination of the concentration of Se, As and Hg in the standard substance by HG-SCGD-OES |
将本方法应用于中国黄海沿岸实际样品的分析, 并与ICP-MS测定结果相比较。 采样位置(1, 2, 3, 4, 5)和测定结果如表6所示。 结果表明, HG-SCGD-OES对实际海水样品中硒、 砷、 汞三种元素定量分析的结果与ICP-MS法一致, 加标回收率在94.9%~105.3%之间, 说明该方法可以应用于对实际海水样品中痕量硒、 砷、 汞的检测。
| 表6 HG-SCGD-OES法测定黄海近岸海域硒、 砷、 汞含量 Table 6 Determination of the concentration of Se, As and Hg in coastal waters of the Yellow Sea by HG-SCGD-OES |
通过将氢化物发生装置与液体阴极辉光放电发射光谱仪相耦合, 实现了对海水中痕量硒、 砷、 汞的在线检测。 氢化物发生装置和液体阴极辉光放电装置中操作参数进行优化后, 考察了仪器对硒、 砷、 汞的分析性能, 其检测灵敏度和检测稳定性均具有较为满意的表现。 选取国家标准物质对仪器检测结果的准确度进行了验证, 并对实际海水样品中痕量硒、 砷、 汞进行了定量检测, 取得较为满意的检测结果。 将HG和SCGD-OES相耦合, 不仅增强了对海水中硒、 砷、 汞元素的分析能力, 亦有望应用于对其他复杂基体环境样品中的多种痕量元素的常规分析。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|