作者简介: 刘 睿, 1982年生, 四川大学化学学院副教授 E-mail: liur@scu.edu.cn
细胞和组织的很多特定功能都由其在不同的生理条件下的生物分子含量决定, 极少数分子的改变就有可能影响细胞生物功能并触发疾病生理过程, 因此高灵敏的生物分子检测技术在疾病机理研究和疾病早期诊断方面具有重要作用。 金属稳定同位素和放射同位素化学性质相近, 借鉴放射同位素标记的成功经验, 通过金属稳定同位素标记多组分生物分子, 可以用原子质谱高灵敏地检测多组分生物分子。 作为灵敏准确的金属元素检测工具, 电感耦合等离子体质谱检出限低、 基体效应低、 线性范围广、 同位素谱线分辨率高, 因此适用于金属元素标记生物分子检测。 金属稳定同位素标记已经被广泛应用到蛋白质、 核酸、 酶活性、 生物小分子、 甚至单个细胞的检测中, 取得了一些可喜的进展, 并展现了广阔未来应用前景。 金属稳定同位素标记生物分析方法有三个特性: 高灵敏度-大多数金属的稳定同位素有较高的标记灵敏度, 并且可以通过纳米材料标记等方法实现信号放大; 多组分同时分析-质谱仪同位素谱线高分辨率提供了多组分分析能力; 高准确度-同位素稀释法提供了可溯源到SI国际单位制的高准确度检测结果。 为了更好的推动相关研究, 简要介绍金属稳定同位素标记生物分析的进展, 主要内容包括以下几个部分: 金属稳定同位素检测工具-无机质谱、 金属稳定同位素标记高灵敏度分析、 金属稳定同位素标记多组分同时分析、 金属稳定同位素标记高准确度分析、 金属稳定同位素标记单细胞分析的进展。
Highly sensitive techniques for biomolecules detection play important roles in the elucidation of molecular mechanisms and early diagnosisof many diseases, because many specific functions of cells and tissues are determined by biomoleculescontent under different physiological conditions, while even a few molecules may be sufficient to trigger pathophysiological processes and affect the biological functions of cells. Metal stable isotopes are similar with radioactive isotopes in chemical properties. After labeled with metal stable isotopes, multiple biomolecules can be detected simultaneously by elemental mass spectrometry with high sensitivity. As an accurate detector for inorganic elements, the advantages of ICPMS include low detection limit, low matrix effect, wide dynamic range, and high spectral resolution for isotopes, which is applicable for metal stable isotope tagging-based bioassay. Metal stable isotope tagging has been successfully applied for the detection of proteins, nucleic acids, enzyme activity, small biomolecules, andeven single cells, demonstrating great potential in bioassay. Despite a series of excellent reviews about metal stable isotope tagging have been presented recently, most of them were not in Chinese. Herein, to promote the related research, we briefly introduce the progress of metal stable isotope tagging-based bioassay in this review. The main contents include: metal stable isotope detection tool-elemental mass spectrometry, sensitive bioassay, multiple biomolecules simultaneous analysis, accurate bioassay, and single cell analysis based on metal stable isotope tagging. Metal stable isotope tagging has three distinct characteristics: high sensitivity-most metal stable isotopes possess high tagging sensitivity, and signal amplification can be achieved by metal nanomaterial tagging etc.; simultaneous multiplex analysis- high resolution isotope line of mass spectrometer provides multiplex analysis capability; high accuracy-isotope dilution method provides traceability to International System of Units.
细胞和组织的很多特定功能都由其在不同的生理条件下的生物分子含量决定, 极少数分子的改变就有可能影响细胞生物功能并触发疾病生理过程, 因此高灵敏的生物分子检测技术在疾病机理研究和疾病早期诊断方面具有重要作用。 由于缺少可以被高灵敏检测的基团, 生物分子的直接高灵敏检测往往非常困难。 20世纪50年代末, 放射性同位素标记被提出并应用于血清中胰岛素的放射免疫分析法测定, 放射性同位素标记的抗体可以被闪烁计数器高灵敏的检测[1]。 放射性同位素标记可靠、 准确、 灵敏度高, 但是由于身体危害、 废物处理等问题, 促成了其他检测方法的发展。 各种非放射性同位素标记分析法被提出, 包括酶联免疫分析法、 荧光分析法、 时间分辨荧光分析法、 化学发光分析法、 电致化学发光分析法、 电化学分析法等, 并在过去的半个世纪里获得了巨大的成功。 然而, 分子光谱是带状谱线, 分子中电子能级的跃迁同时伴随着振动能级和转动能级的跃迁, 谱线宽度一般为几十纳米甚至上百纳米。 由于所获得的信号谱线的相互重叠干扰, 多种生物分子同时标记定量检测往往成为一个很大的挑战[2]。
原子质谱是锐线谱线, 并且金属稳定同位素和放射同位素化学性质相近, 是否可以通过金属稳定同位素标记多组分生物分子, 用原子质谱同时检测多组分生物分子确实可以。 无机质谱近年来被广泛用于测定各种金属和非金属元素[3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14], 其优点包括检出限低(pg· mL-1级别)、 基体效应低、 线性范围广(9个数量级)、 同位素谱线分辨率高等, 因此适用于金属元素标记生物分子检测。 自从金属稳定同位素标记被清华大学张新荣教授课题组提出以来[15], 方法已经被广泛应用到蛋白质、 核酸、 酶活性、 生物小分子、 甚至单个细胞的检测中, 取得了一些可喜的进展, 并展现了未来广阔应用前景。 近年来, 国内外科学家们已经对该方法做了很好的综述[16, 17, 18, 19, 20, 21, 22, 23, 24], 并且作者也曾参与总结此领域的发展[2, 25], 但是相关中文综述却较少[26, 27, 28]。 因此, 为了更好地推动相关研究, 本文将简要介绍金属稳定同位素标记生物分析的进展。
在无机元素质谱分析中, 电感耦合等离子体质谱(ICPMS)是目前最广泛应用的分析仪器。 ICPMS发明于20世纪80年代早期[29], 并由Perkin Elmer公司首先在1983年推出第一台商品化的仪器。 样品到达6 000~8 000 K高温等离子体区域时, 高温等离子体提供足够的能量使电子从原子中脱离而成为离子, 大量正离子的产生给予了ICPMS超痕量分析的能力。 如图1所示, ICPMS可以高灵敏和高分辨的检测元素周期表中的大部分元素及其同位素。
大多数金属稳定同位素在ICPMS中有非常高的灵敏度, 检出限低于pg· mL-1水平。 张新荣教授课题组2001年提出了基于稀土元素铕大环化合物标记和ICPMS检测的免疫分析方法, 用于促甲状腺激素[15]和总甲状腺素[30]的检测。 稀土大环化合物用于生物大分子的标记检测有以下优势: 稀土元素在生物体内空白较低; 电离能相近且在ICPMS中离子化效率高; 化学性质相似、 便于合成和标记[31]。 为了实现更高灵敏度, 加拿大多伦多大学Winnik教授等合成了一种多聚大环高分子化合物[32], 每个分子上有30~70个稀土元素标记物单元, 从而实现灵敏度的增强[33]。 金属纳米粒子中含有大量金属原子, 因此, 使用金属纳米粒子标记来取代稀土元素大环化合物, 可以有效提高检测灵敏度[34, 35]。 纳米金[36, 37]、 纳米银[38]、 纳米铜[39]、 掺Cs的磁性纳米粒子[40], CdSe[41], CdTe[42], CdS[43], PbS[44], HgS[45]等纳米粒子都已被应用于金属稳定同位素标记生物分析中。 将纳米粒子标记与信号放大技术相结合, 可以进一步降低检出限和提高检测灵敏度。 常采用的免疫信号放大系统包括免疫金银放大[46, 47]、 生物素-亲和素放大[48]、 脂质体放大、 酪胺信号放大[50]等, 核酸信号放大系统常采用聚合酶链反应放大、 滚环放大[50, 51]、 链式杂交反应放大[52, 53, 54]等。 例如, 纳米金粒子可以催化银离子和对苯二酚之间的氧化还原反应, 从而在表面形成一层厚厚的银外壳, 成长为一个大的复合纳米粒子。 经过15 min的免疫金银放大过程, 检测灵敏度提高了60倍[46]。 以人CEA抗原作为检测模型, 方法检出限达到0.03 ng· mL-1, 对人血清样品的检测结果与化学发光免疫分析结果吻合。 使用链式杂交反应(图2), 可以实现DNA[52]和miRNA[55]的无酶放大高灵敏度分析。 此外, 双链DNA[56]或含有PolyT[57]的单链DNA能够作为模板有效地原位催化铜还原形成纳米铜粒子[58], 经过链式杂交反应放大以后可以实现目标DNA的无标记检测[56]。 在细胞高灵敏度定量分析方面, 武汉大学胡斌教授课题组实现了基于金属纳米材料标记及信号放大的血液中的细胞定量[59], 检出限低至15个细胞[60], 并可实现荧光和质谱的双模式检测(图3)[61]。
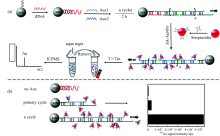 | 图2 基于链式杂交反应放大的DNA高灵敏检测方法 (a): 链式杂交放大反应过程; (b): 可行性实验结果[52]Fig.2 High sensitivity assay for DNA based on hybridization chain reaction amplification (a): Hybridization chain reaction process; (b): The experimental results of the feasibility study[52] |
采用单个纳米颗粒模式ICPMS检测, 有望实现单分子分析[62]。 瞬态信号脉冲的频率与可检测到的纳米粒子个数直接相关, 因此纳米粒子标记的生物分子浓度可以通过瞬态信号的频率定量。 通过测量197Au脉冲信号的频率可进行甲胎蛋白(AFP)[63]和免疫球蛋白(IgG)[64]定量分析。 方法检测金纳米粒子标记抗体的检出限为0.02 pg· mL-1[64]。 这种计数模式的单纳米颗粒分析方法在单生物分子检测方面具有很大的潜力, 并且不需要任何信号放大的操作[65]。 在均相溶液中, 纳米颗粒的频率可以用来监测纳米粒子聚集引起的抗原抗体复合物的形成或杂交产物的形成。 例如, 合成纳米金粒子, 制成两组单链DNA探针[66]。 然后, 目标物DNA与金纳米粒子探针在缓冲溶液中进行杂交。 DNA杂交会形成二聚体, 三聚体, 甚至更大的金纳米颗粒聚集体。 纳米粒子的聚集导致信号脉冲的个数减少, 并且每个信号脉冲的强度增大。
多组分生物分子同时分析是一个重要的研究方向。 多组分同时分析具有诸多优势, 如样品消耗低、 分析时间短、 减少重复繁琐的程序、 单个测试成本低等。 文献已报道的多组分生物分析方法面临两个重要挑战: 有限的光谱分辨能力限制了现有分子光谱分析方法的多组分同时分析能力; 难以找到大量合适的标记物用于编码识别并由同一检测技术分辨和检测, 且具有相似的灵敏度。 然而, 超过100种金属稳定同位素可以被ICPMS检测, 并具有较高灵敏度。 这些金属元素及其稳定同位素, 特别是在生物体内和自然环境中浓度低的同位素, 是金属稳定同位素标记分析的理想标记物。 加拿大多伦多大学Tanner教授课题组使用金纳米粒子和铕元素大环化合物标记, 用于IgG和FLAG-BAP两种蛋白的同时检测[67]。 使用0.5 mL的样品量, 测定两种蛋白质的浓度线性响应范围为2~100 ng· mL-1。 使用Eu3+和Sm3+标记, 可以实现人血清样品中AFP和HCG(人绒膜促性腺激素)的同时测定[68]。 测定AFP和HCG的线性范围分别为4.6~500和5.0~170 ng· mL-1, 检出限为1.2和1.7 ng· mL-1。 如图4所示, 使用141Pr, 151Eu, 152Sm, 153Eu, 158Gd, 163Dy, 165Ho, 166Er, 168Er, 169Tm, 170Er, 175Lu标记, 可以实现人血清中12种疾病蛋白质标志物的同时检测, 并且实验结果与临床常用的时间分辨荧光免疫法数据很好地吻合[69]。 方法使用抗体标记的磁珠作为免疫反应载体, 可以根据需要为不同的疾病选择需要同时检测的参数, 通过组合式免疫反应为个体化医疗提供分析手段[70, 71]。 通过89Y, 139La, 140Ce, 141Pr, 146Nd, 147Sm, 153Eu, 158Gd, 159Tb, 163Dy, 165Ho, 166Er, 169Tm, 172Yb, 175Lu标记同样可以实现15种DNA片段的同时检测, 检出限为pmol级别[72]。 通过设计自动酶切机制, 可以实现多组分miRNA的同时fmol级别高灵敏检测[73]。 厦门大学王秋泉教授课题组通过设计合成一种含有镧系离子的多肽-纳米粒子蛋白酶探针, 实现了多种蛋白酶活性的同时检测[74]。
同位素稀释绝对定量生物分子可以提供临床、 环境和药物开发实验室研究数据准确性和可追溯性[75]。 通过测量重和轻同位素的强度比, 可以进行绝对定量。 在采用同位素稀释法定量之前, 金属稳定同位素与被分析生物分子的化学计量比必须是已知的[76]。 稳定同位素编码的亲和标签是蛋白质和多肽绝对定量的一个重要工具。 蛋白质和多肽的绝对定量首先由德国柏林洪堡大学Linscheid教授课题组实现[77], 通过稀土同位素标记、 色谱分离和同位素稀释质谱检测, 实现了猪眼模型中蛋白和多肽绝对定量。 除了含有镧系元素的标签[78, 79, 80], 其他杂原子如二茂铁[81]、 碘[82]、 镓[83]、 联吡啶钌[84]和汞[85]等, 也被用于金属同位素标记的准确定量方法研究中。 由于以质量为基础的质谱信号与金属同位素的化学形态几乎是无关的, 生物分子的绝对量可以通过金属元素溶液来标定[86]。 使用Y元素标记捕捉抗体, Sm元素标记报告探针, 可以通过Sm和Y元素稳定同位素的信号比值来实现血清中β 2-MG抗原的准确免疫分析[87]。 DNA也可以用金属稳定同位素标记的方法实现绝对定量。 首先分别设计稀释探针, 捕获探针和报告探针[72]。 稀释探针标记富集的同位素, 可以直接与固定在磁性微球上的捕获探针反应。 标记天然稀土元素同位素的报告探针通过靶DNA杂交与稀释探针连接。 在恒定量的稀释探针和过量报告探针的条件下, 目标DNA由杂交复合物上报告探针/稀释探针比值决定。 因此, 可以根据同位素比值计算出目标DNA的含量。 利用标记的161Dy和168Er浓缩同位素稀释探针, 可以实现多个目标DNA的同时绝对定量分析, 获得了较高的化学计量精度。
单细胞水平上的多种生物标志物的同时检测可以清楚明确地鉴定细胞的功能和表型[88, 89, 90]。 荧光流式细胞仪是临床研究中的重要方法, 在基因组学和蛋白组学研究中有重要意义, 可以更好地解释基因、 蛋白以及小分子之间的相互作用。 由于信号重叠和细胞自体荧光的问题, 需要繁复的光谱校正来实现荧光细胞仪的多组分同时分析。 Tanner教授课题组设计了基于飞行时间ICPMS的质谱流式细胞仪[91]。 常用的ICPMS仪器一般使用四级杆分析器, 其在切换测定不同的同位素时需要50~300 μ s稳定时间。 此稳定时间和单个细胞或者颗粒在Ar等离子体中的滞留时间相当。 因此, 扫描型的质谱仪器如四级杆质谱和扫描扇形磁场质谱难以用于单细胞多组分同时测定, 而飞行时间质谱仪可以提供迅速同时的多元素检测。 质谱细胞仪被认为是开启后荧光时代的新型流式细胞仪。 美国斯坦福大学的Nolan教授课题组使用质谱细胞仪同时测量单细胞中34种参数(31种抗体、 活性、 DNA含量和细胞大小)[92], 研究了健康人骨髓造血细胞的多样性。 参照细胞表面抗原表达的数据, 得出了药物抑制和细胞信号反应的谱图。 如图5所示, 该课题组最近详细描述了使用48种金属稳定同位素(38种稀土金属、 铟的2个同位素、 钇的1个同位素、 钯的6个同位素和铋的1个同位素)标记单克隆抗体的操作方法[93], 为后续的研究提供了重要的参考。 该方法对于疾病机理研究、 造血、 免疫、 药物筛选等领域都具有重要意义。 与激光烧蚀[94]和二次离子源[95]联用, 无机质谱可以用于微阵列定量[96]、 免疫组织成像和单细胞分析[97, 98, 99]。
 | 图5 质谱流式细胞仪中使用的金属稳定同位素标记物[93], 包括15种稀土元素 (Y以及从La到Lu, Pm除外), 4种贵金属 (Rh, Pd, Ir和Pt), 2种后过渡金属 (In和Bi)和1种卤素(I)Fig.5 Metal stable isotope tags applied in mass spectrometry, including 15 rareearth elements[93] (Y, and from La to Lu, except Pm), 4 noble metals (Rh, Pd, Ir, and Pt), 2 post-transition metals (In and Bi), and 1 halogen (I) |
总结了基于金属稳定同位素标记的生物分析方法的发展情况。 金属稳定同位素标记生物分析方法有三个特性: 高灵敏度-大多数金属的稳定同位素有非常高的灵敏度, 可以在pg· mL-1以下水平检测, 并且可以容易地实现更高灵敏度标记检测(聚合物、 纳米颗粒、 信号放大、 单颗粒分析等); 多组分同时分析-质谱仪同位素谱线高分辨率提供了生物分子的多组分分析能力; 高准确度-同位素稀释法提供了高的精度和准确度, 其检测结果可溯源到SI国际单位制, 可用于实验室间比对和质量控制。 金属稳定同位素标记在生物分析化学研究仍有很大的发展空间, 有待分析化学和生命科学研究人员的进一步携手共同探索。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|
| [79] |
|
| [80] |
|
| [81] |
|
| [82] |
|
| [83] |
|
| [84] |
|
| [85] |
|
| [86] |
|
| [87] |
|
| [88] |
|
| [89] |
|
| [90] |
|
| [91] |
|
| [92] |
|
| [93] |
|
| [94] |
|
| [95] |
|
| [96] |
|
| [97] |
|
| [98] |
|
| [99] |
|