作者简介: 孙绮旋, 女, 1995年生, 东北大学理学院化学系博士研究生 E-mail: 1810034@stu.neu.edu.cn
原子光谱/元素质谱是元素分析的强有力手段, 其在生命分析领域的应用也越来越广泛。 在单细胞元素分析方面, 相关研究工作主要关注元素在单细胞中的分布和形态变化; 在元素标记策略分析领域, 利用原子光谱(atomic spectrometry, AS)和电感耦合等离子体质谱(inductively coupled plasma mass spectrometry, ICP-MS)实现对小分子、 核酸、 蛋白质等目标分析物的高灵敏检测是研究热点; 在金属药物分析领域, ICP-MS为研究金属药物在生物体中的摄入、 分布、 代谢和排泄等过程提供了便利, 也为进一步阐明药物作用机理以及金属药物的设计和改进提供了数据支持; 在生物元素成像领域, ICP-MS与激光剥蚀技术(laser ablation, LA)联用, 可以对生物样品进行原位分析和微区分析, 结合有机质谱实现元素相关生物过程的分子机制研究; 与相关分离方法联用, 原子光谱和元素质谱还可以对生物组织中元素进行形态分析, 研究其在相关过程中的生物转化过程。 本文从单细胞元素分析、 元素标签标记策略、 金属药物转运与代谢以及生物组织中元素分布分析等方面, 评述了原子光谱和ICP-MS在生命分析中的应用实例, 并对该领域的发展前景进行了展望。
Atomic spectrometry and elemental mass spectrometry are very powerful techniques for elemental analysis, which have been widely applied in bio-analytical chemistry. In single cell analysis field, research work focuses on element distribution and bioavailability in individual cells with the aid of inductively coupled plasma mass spatrometry (ICP-MS); In the field of elemental label strategy, high sensitive methods are explored for the measurement of small molecules, nuclear acids, proteins and other biological targets; For metal drug analysis, ICP-MS is applied for the investigation on uptake, distribution, metabolism and excretion of metal drugs in organisms, which provides important information for further biomedical research and metal drug design; Considering bio-imaging, laser ablation (LA) ICP-MS is employed for in-situ analysis and micro-analysis of biological samples, providing information for molecular mechanism of relevant biological process; elemental speciation analysis in plant/animal tissues is realized by combining atomic spectrometry or ICP-MS with separation techniques. In this paper, these applications are reviewed including single-cell elemental analysis, elemental label strategy, metal drugs transport and metabolism, and elemental distribution analysis in biological tissues. The development and the prospective of atomic spectrometry and inductively coupled plasma mass spectrometry in biological chemistry are discussed.
原子光谱/元素质谱具有试剂消耗量少、 灵敏度高、 基体效应小等优点, 在环境分析、 食品分析、 功能材料、 医学领域以及生命分析领域都占据非常重要的地位。 近年来, 原子光谱在样品前处理、 仪器装置研发以及仪器联用等各个方面不断发展[1, 2, 3, 4, 5, 6]。 随着材料科学的发展, 将基于新材料的固相萃取法与原子光谱联用, 大大降低方法的检出限以及干扰物质的影响[7, 8]。 在原子光谱仪器研制方面, 尖端放电微等离子体、 辉光放电微等离子体以及介质阻挡放电技术的出现为原子光谱样品的激发和引入提供了新的可能[9, 10, 11]。 液相色谱和毛细管电泳等分离仪器与原子光谱联用很容易实现目标物的分离分析[12, 13]。 随着各个学科的不断交融发展, 原子光谱在金属离子与生物分子之间的相互作用及元素形态分析等领域也发挥着不可或缺的作用[13, 14, 15, 16]。 1983年第一台商用ICP-MS问世, 凭借其优越的分析性能发展成为元素分析技术领域的一个重要组成部分。 生物样品中目标物通常含量较低, 一般的技术手段可能无法满足检测要求, 而ICP-MS则能够获得不错的检测结果。 在时间分辨模式下, 通过调整进样速率、 细胞悬浮液密度以及积分时间等参数, 能够得到大部分单细胞的信号, 实现对单个细胞中痕量元素的分析[17, 18, 19, 20]。 利用元素标记策略可以实现生物样品中的小分子, 核酸, 蛋白质等物质的检测以及细胞的分选和计数[21, 22, 23, 24, 25]。 金属药物在机体中的转运和转化过程以及相关生化反应的研究可以通过监测目标金属元素的信号, 对金属药物的行为进行分析[26, 27, 28]。 与高效液相色谱和激光剥蚀等技术联用可以对植物动物组织进行元素形态分析和成像分析[29, 30, 31]。 本文综述了原子光谱和ICP-MS在生命分析中的应用实例并对相关研究的未来发展方向进行了展望。
原子光谱分析技术在生物分析中的研究已经受到关注, 其应用前景以及特有的优势也在不断挖掘中。 2016年, Chen等[14]利用两端带有几个胸腺嘧啶的寡核苷酸链(DNA)探针与Hg2+形成的T-Hg2+-T发夹结构结合冷蒸汽发生原子荧光光谱法(cold vapor generation atomic fluorescence spectrometry, CVG-AFS)(图1), 建立了一种无标记免分离检测蛋白质和DNA的方法。 当富含胸腺嘧啶的单链DNA存在时, 发夹结构被破坏, Hg2+被释放。 SnCl2将汞还原成汞蒸气并从样品基质中分离出来, 进入原子荧光检测。 由于原子荧光光谱对汞的检测灵敏度非常高, 通常可以达到低于0.01 μ g· L-1的检出限, 因此该方法对目标蛋白质或DNA的检测灵敏度较高。 该方法对单链DNA、 蛋白质和双链DNA的检出限分别为0.2, 0.08和0.3 nmol· L-1。
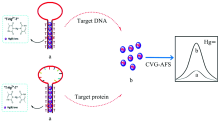 | 图1 基于CVG-AFS的无标记免分离单链DNA检测示意图[14]Fig.1 Schematic illustration of the label-free and separation-free ssDNA bioassays based on CVG-AFS[14] |
金属/类金属纳米粒子标记也是在DNA生物测定中常用的一种策略。 利用CdS量子点标记发生常规夹心型杂交反应的目标DNA后, 加入硝酸溶解量子点可以释放出镉离子[15]。 Hu等利用这种方式, 建立了用氢化物发生原子荧光法检测Cd间接定量目标DNA的超高灵敏度方法, 该方法实现了对HIV DNA的高灵敏检测, 检出限可低至0.8 amol· L-1。
另外, Deng等[16]利用毛细管电泳在线偶联电热原子吸收光谱对生姜中的硒进行形态分析。 该方法可用于生姜根茎提取液中的四种形态硒的完全分离, 对SeMet, SeCys2, Se(Ⅳ )和Se(Ⅵ )的检出限分别为1.7, 2.2, 0.89和0.97 ng· mL-1。 结果表明, 在生姜叶表面喷洒0.02 mg· mL-1的硒酸盐与0.02 mg· mL-1的亚硒酸盐混合液后, 生姜会吸收这两种无机形态的硒, 并将在生长过程中将其转化为有机硒。
对生物样品中低含量矿物元素的分析通常用AS和ICP-MS进行。 常用方法是用酸消化细胞后再测定, 结果显示为细胞群体的平均值。 这种做法不能体现细胞之间的数据差异, 丢失单个细胞中元素含量的信息, 而这些丢失信息可能对于阐明元素的生物学影响至关重要。 单个生物细胞的元素分析如今是一个极具挑战性的课题, ICP-MS在单细胞水平的元素分析甚至形态分析中的优势逐渐突显。
Li等[17]将灌注色谱与ICP-MS联用快速监测了金属元素U进入细菌的过程。 将细菌(Bacillus subtilis)用U+孵育, 细菌密度约为108个· mL-1的细菌悬浮液以0.2 mL· min-1的采样速率引入ICP-MS, 设置的时间分辨率为4 ms, 可以明显看到单个细菌对应的U+质谱信号。 探讨了细菌破裂与否对测到的铀信号的影响。 结果表明, 所得到的U+质谱峰信号是由进入ICP的完整细菌中的U产生的。
Ho等[18]利用基于时间分辨(time-resolved, TR)方式的ICP-MS, 对单个小球藻(Chlorella vulgaris)中的元素进行了分析并同时进行细胞计数。 采用悬浮进样的方式将细胞密度为106个· mL-1的小球藻悬浮液直接引入ICP, 检测到单个细胞中的主要元素Mg元素含量为108 atoms· cell-1, 微量元素Cu和Mn的含量为5× 106 atoms· cell-1。 细胞计数是通过计算一段时间内Mg的峰信号的数目进行的, 并且得到了与细胞计数板相同的不确定度。 待测元素在ICP-MS中产生的峰值强度与其在细胞中的含量有关。 通过金属氧化物颗粒进行校准确定单细胞中金属元素的含量。
Wang等[19]发展了一种利用TR-ICP-MS检测单细胞中必需矿物元素的方法, 并用于研究两种癌细胞(HeLa和A549)和一种正常细胞(16HBE)中铁、 铜、 锌、 锰、 磷和硫的元素含量以及分布情况。 为了消除质谱多原子干扰, 也为了获得更好的信噪比, 检测采用动态反应池模式, 以氨气为反应气检测56Fe, 68Zn, 63Cu和55Mn, 以氧气为反应气检测47PO和48SO。 细胞密度为2× 105个· mL-1, 停留时间为5 ms, 为每种测定质量数优化最佳四级杆参数和反应气流速等条件。 实验结果很好地表现出细胞异质性, 并且说明了在癌细胞和正常细胞中元素的含量和分布具有差异。
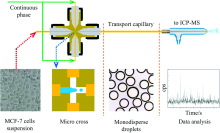
Wei等利用TR-ICP-MS, 研究了单细胞对两种形态的铬的摄取以及其在细胞中分布情况[20]。 分别用不同浓度的Cr(Ⅲ )和Cr(Ⅵ )溶液孵育细胞, 然后在时间分辨模式下, 悬浮进样检测53Cr的信号。 当滞留时间为10 ms, 细胞密度为3× 105个· mL-1, 采样速率为0.5 mL· min-1时, 理论上同时测到大于两个细胞及以上的概率为0.04%。 实验结果表明, 细胞对Cr(Ⅲ )和Cr(Ⅵ )的摄入方式有所不同, 细胞中Cr(Ⅲ )的含量随着培养浓度的增加线性增加, 而Cr(Ⅵ )的含量随着培养浓度的增加呈指数型增加。 此外, 与Cr(Ⅲ )相比, 相同条件下细胞会摄入更多的Cr(Ⅵ ), 这可能与细胞膜上的某些还原位点有关。 对细胞中铬元素的定量分析结果表明, 群体细胞平均值的方式测定结果与单个细胞测定结果基本一致, 但是, 时间分辨模式下检测的结果更能体现单个细胞间的行为差异。 在此基础上, 为了优化单细胞进样方式, 他们还开发了一种十字交叉型微液滴发生器来进行单细胞封装(图2)[32], 该体系下单个液滴中捕获到两个细胞的概率低于0.005%。
用元素标记抗体或者适配体后, 通过ICP-MS来检测核酸和蛋白质以及其他目标物的方法具有很广泛的应用。 这种方法受生物基体的影响小, 很容易实现信号放大, 利用镧系元素标记还可以获得极低的检出限。
Zhao等[21]提出了一种具有高灵敏度的夹心测定法来检测α -凝血酶, 利用两种适配体形成夹心结构来提高特异性, 结合金纳米粒子用来放大信号。 对人α -凝血酶的检出限为5 fmol, 动态线性范围有三个数量级。 他们还用抗体特异性识别, 结合金纳米粒子标记放大信号并利用ICP-MS进行检测, 对大肠杆菌(E. coli O157:H7)进行了快速灵敏的测定[22]。 用标准溶液来校准金纳米粒子的数量和浓度。 在1 mL的样品中至少能检测到500个E. coli O157:H7, 每次检测可在40 min内完成。
Zhang等[23]报道了一种基于免疫磁分离和元素标记来检测生物体液中低水平肿瘤细胞的方法。 以Jurkat T细胞为模型, 首先用抗CD3抗体修饰的磁珠(捕获探针)将其从细胞混合物中快速分离, 然后用与抗CD3抗体缀合的金纳米粒子(标记探针)标记分离出的T细胞, 用ICP-MS检测。 这两种探针对Jurkat T细胞具有很高的亲和性和特异性, 对CD2 /CD3 阴性的细胞没有结合作用。 此外, 这种方法还可以用于同时检测细胞表面的生物标志物。
Tang等[24]设计了一种新颖的可光切割的磁性纳米粒子钆标记物, 在与蛋白酪氨酸磷酸酶(PTP-1B)作用后通过高效液相色谱和非特异性同位素稀释ICP-MS来对磷酸化酪氨酸蛋白进行绝对定量(图3)。 该方法的检出限低至30 amol· L-1, 相对标准偏差小于5.70%。 这种方法可以用于其他更多蛋白质翻译后修饰的绝对定量产物。 此外还报道了唾液酸成像和定量的分析平台[33]。 用一种带有叠氮基的甘露糖胺(Ac4ManNAz)作为代谢底物, 在细胞表面生成叠氮化唾液酸, 就可以通过点击反应, 用荧光报告分子或者元素报告分子对唾液酸进行成像和定量分析。
 | 图3 光切割磁性纳米粒子钆标签在蛋白酪氨酸磷酸酶辅助下通过HPLC/71Ga-SUID ICPMS定量检测磷酸酪氨酸[24]Fig.3 Photocleavable MNP-based Ga-Tag for tagging, enrichment, and UV-release of phosphorylated and phosphate bearing molecules/ions and specific pY quantification using HPLC/71Ga-SUID ICPMS under the assistance of a protein tyrosine-specific phosphatase PTP-1B[24] |
Han等[25]基于元素标记策略开发了多组分核酸的检测方法, 利用DNA杂交反应进行特异性识别, 稀土元素用于多重标记, 磁性微球用于快速分离, ICP-MS用于超灵敏检测。 通过Y, La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb和Lu的元素标记同时检测了15种与临床疾病(包括癌症、 遗传病和病毒性疾病)相关的DNA序列, 并用同位素稀释法实现了两种目标DNA的同时绝对定量。
Liu等构建了一种基于超小型上转换纳米粒子DNA缀合探针检测miRNA的高灵敏方法[34]。 设计了发夹结构DNA H1和H2, 并将超小镧系元素上转换纳米粒子(UCNP)与能识别目标miRNA的H1结合, 在目标miRNA的存在下, H1与miRNA进行杂交打开发夹结构, 剩余裸露的H1链又会打开H2的发夹结构, 如此实现目标物引发的链式杂交和UCNP的积累。 目标miRNA与上转换纳米粒子中的镧系元素含量有线性关系, 通过ICP-MS检测上转换纳米粒子中的89Y可以实现对目标miRNA的高灵敏检测。 该方法检测miRNA的线性范围为0.150 0 fmol· L-1, 检出限为41 amol· L-1。
对金属药物评价的一个重要方面是讨论其在体内(包括血浆和细胞内)转运和代谢对机体产生的影响。 在研究金属药物体内过程的许多方法手段中, ICP-MS是一种很好的选择。
Tsang[26]通过TR-ICP-MS在单细胞水平检测了幽门螺杆菌(Helicobacter pylori)对含铋抗溃疡药物的摄取情况。 通过柠檬酸铁与胶体次枸橼酸铋(CBS)的竞争实验来探讨铁离子对含铋药物摄入的潜在影响, 结果表明细菌对CBS的摄取随着Fe(Ⅲ )浓度的升高而降低, 并且Fe(Ⅲ )对细菌的生长有促进作用。 该工作通过金属药物摄取的动力学实验来研究细胞摄入含铋药物与细胞存活率之间的相关性, 结果表明幽门螺旋杆菌在CBS摄入后大概在3小时达到峰值的一半, 摄取少量的铋(< 50%)会刺激幽门螺旋杆菌的生长, 更大量的摄入后其生长会受到抑制。 随着CBS培养液浓度的增加, 检测到的209Bi信号的数量变化也与幽门螺杆菌的生长趋势一致。
Zheng等[27]利用ICP-MS分析了单个癌细胞(Hela)和正常细胞(16HBE)对顺铂和Gd@C82(OH)22的摄入量。 根据时间分辨模式下测得的信号, 发现两种抗癌药物在细胞中有着不同的分布规律。 研究了不同的暴露时间和剂量下细胞中Gd@C82(OH)22和顺铂的浓度, 结果显示Gd@C82(OH)22比顺铂的生物利用度更高, 毒性更低。
Zhou等[28]利用TR-ICP-MS研究了单个NB4和HL60细胞对含砷药物的摄入量以及对细胞分化、 凋亡和死亡比例的影响, 在单细胞水平评价了As2O3的细胞毒性。 将顺铂作为活性染料测定As2O3孵育后的细胞死亡率, 用两种镧系元素(V-DOTA-Nd和anti-CD11b-DOTA-Dy)标记细胞膜, 作为细胞凋亡和分化的两种标志物。 用流式细胞仪检测了用As2O3处理后的细胞的凋亡状态, 结果与用TR-ICP-MS得到的细胞凋亡率一致。 采用全反式维甲酸处理细胞后分别用流式细胞仪和TR-ICP-MS得到的分化细胞比率为17%和24%, 这与其通过诱导白细胞分化来治疗急性早幼粒细胞白血病的特点一致。 相比之下, As2O3诱导的细胞分化率很低, 说明As2O3不是通过诱导细胞分化来杀死癌细胞。 该研究讨论了单个白血病细胞(NB4和HL60)在细胞周期的不同时期对砷类药物(ATO和ZIO101)的摄入和细胞毒性的关系[35], 并且用流式细胞技术分析了单个细胞对含砷药物的摄入量与相关转运蛋白(AQP9和xCT)的表达量之间的关系见图4。 单细胞ICP-MS数据表明细胞在G2/M期对两种砷类药物的摄入量最大, 在S期最小。 与ZIO-101相比, 不同时期的细胞对ATO的摄入量差别更加明显。 流式细胞分析结果表明AQP9这种ATO的转运蛋白在不同时期的表达量与砷类药物摄入量并不完全呈正相关, 说明细胞摄入这两种药物可能还需要其他的转运蛋白。 此外, 在细胞毒性方面, ATO和ZIO-101对NB4细胞的细胞毒性也有细胞周期依赖性。
利用LA-ICP-MS可以得到组织样品中的元素分布等非常重要的信息, 与分离仪器联用可以实现元素的形态分析, 进一步阐明相关生物过程的机理。
Reifschneider等[29]开发了一种基质匹配的LA-ICP-MS生物成像方法来评估人体肝癌组织和正常肝组织摄入标记10B的p-硼苯丙氨酸果糖(BPA-f)后的药代动力学分布。 该方法使用波长为213 nm的Nd:YAG激光器, 得到5 ng· g-1的检出限和50 μ m的空间分辨率。 使用富集了10B的全血样品进行外部校准来保证定量结果的准确性。 LA-ICP-MS定量分析的结果和放射实验得到的结果一致。 之后他们利用元素质谱(LA-ICP-MS)和分子质谱(MALDI-MS)研究了黑腹果蝇幼虫和F1代成虫在生长发育不同阶段对砷脂的摄入情况[30]。 用亚砷酸盐(3.2 μ g As· g-1)喂养的幼虫整体砷的分布比较均匀, 大部分积累量为1 μ g As· g-1。 用同浓度的1-二甲基胂基十五烷(AsHC 332)喂养幼虫后, 不同部位的砷积累量范围为5~15 μ g As· g-1。 F1成虫的成像试验确定了不同器官富集砷的特异性。 用亚砷酸盐喂养F1代成虫后, 在其胃肠道部位检测到积累量为3 μ g As· g-1, 背侧间接飞行肌处积累量小于1 μ g As· g-1。 用AsHC 332喂养的F1成虫, 在其整个腹部测到了高达10 μ g As· g-1的积累量, 其胸部肌肉组织以及大脑处砷积累量为5 μ g As· g-1。 结果表明, 黑腹果蝇对无机砷和有机砷的摄入和积累有很大差异, 这项工作也是在AsHC喂养模型生物的大脑中第一次检测到砷。
Maria等[31]提出将高效液相色谱和非对称场流(AF4)与ICP-MS联用来研究壳聚糖修饰的硒纳米粒子(CS-SeNPs)在萝卜(Raphanussativus)中的积累和生物转化。 将样品经微波消解后由ICP-MS测得总硒含量, 用结合高效波相色谱分离鉴定及定量样品中各种形态的硒, 方法准确度用富硒小麦粉标准品(ERM BC210a)进行了验证。 用AF4-ICP-MS 对萝卜根系中CS-SeNPs的尺寸进行了表征。 通过TEM测定的萝卜根系中CS-SeNPs的大小分布与AF4-ICP-MS获得的大小分布一致。 用亚硒酸盐和CS-SeNPs孵育后的萝卜组织提取物中, 硒的主要成份是MeSeCys和SeMet。 CS-SeNPs在萝卜中累积, 经过和亚硒酸盐相似的代谢途径转化为有机硒。
Holzlechner等[36]用LA-ICP-MS和MALDI-MS分析了恶性胸膜间皮瘤样品(使用顺铂治疗的患者), 得到了铂以及组织中其他元素的定量和分布信息, 并分析了铂的分布和某些脂质的关系, 所有成像具有40 μ m的横向分辨率。 通过酸消解法验证LA-ICP-MS对组织切片中铂的定量结果, 串联质谱验证了不同脂质类别的出现。 作者首次运用基于随机森林(RDF)算法识别了MALDA数据集中与磷或者铂分布规律相关的大量脂类分布。
Maria等[37]将抗体与金纳米簇缀合(AuNCs)标记的视网膜上的金属硫蛋白(MT1/2)结合, 通过LA-ICP-MS对其进行成像和定量分析。 标签中AuNCs与抗体的化学计量比是1:1, AuNCs具有信号放大作用(一个AuNC含有约579个金原子), 可由LA-ICP-MS得到5 μ m厚切片的MT1/2分布, 并用明胶基质匹配的标准品校准对197Au金进行定量, 得到MT1/2检出限为0.5 ng· g-1。 使用商用试剂盒验证了方法的可行性。
原子光谱/元素质谱在生命分析化学中有非常重要的地位, 但同样也有很多需要解决的问题。 用于单细胞分析时, 雾化效率和引入技术以及标准物质的确定等方面, 是该研究领域的一个热点; 用于生物分子分析时, 如何实现小丰度目标物的放大, 以及如何实现有效和稳定的元素标签标记等方面是重要的研究方向; 此外, 金属组学与代谢组学相关的研究工作领域原子光谱的应用潜力也有待开发。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|