作者简介: 李贞霞, 女, 1973年生, 河南科技学院园艺园林学院副教授 e-mail: 842291829@qq.com
番茄红素因其抗氧化活性强, 具有多种养生保健功效, 日益受到重视, 但番茄红素的提取测定方法繁琐复杂, 很难广泛应用。 采用分光光度法, 以石油醚、 丙酮、 甲醇为溶剂, 二氯甲烷为助溶剂, 先从吸收光谱差异入手, 确定最大吸收波长, 再于最大吸收波长处, 以不同浓度的番茄红素标准液测定其吸光度值, 制作标准曲线, 得到回归方程, 并考察二氯甲烷的量, 浸提时间等对番茄红素提取效果的影响, 探索分光光度法测定番茄红素的简单快速的分析方法。 实验结果表明, 以石油醚为溶剂, 波长474 nm, 加入5 mL的二氯甲烷助溶, 浸提时间为40 min时, 是用分光光度法测定番茄红素的最佳方法。
In recent years, lycopene has been paid more and more attention due to its strong antioxidant activity and various health care functions. However, lycopene extraction and determination methods are complicated and difficult to be widely applied. In this study, using spectrophotometry, petroleum ether, acetone and methanol as solvent, methylene chloride as co-solvent, starting with the absorption spectrum differences to determine the maximum absorption wavelength, then, the absorbance of lycopene standard liquid with different solubility was determined at the maximum absorption wavelength and the standard curve was established to obtain the regression equation. The effect of the amount of dichloromethane and the extraction time on the lycopene extraction efficiency was investigated, and the simple and rapid determination method of lycopene by spectrophotometry was explored. The experimental results showed that the best method for the determination of lycopene by spectrophotometry is petroleum ether as solvent, wavelength 474 nm, addition of 5 mL of dichloromethane for solubilization and extraction time of 40 min.
番茄红素(Lycopene)是一种脂溶性的天然色素成分[1], 在化学结构上是一种重要的不含氧的类胡萝卜素, 是β -胡萝卜素的同分异构体, 其分子式为C40H56, 相对分子质量为536.85, 纯品为针状深红色晶体[2], 主要存在于番茄、 西瓜、 葡萄柚、 木瓜等蔬菜和水果中, 也存在于岩藻等藻类体内[3]。 番茄红素具有很强的抗氧化效果, 有较强清除自由基的能力[4], 对防治前列腺癌、 肺癌、 乳腺癌、 子宫癌等有显著效果, 还有预防心脑血管疾病、 提高免疫力、 延缓衰老等功效[5, 6]。 目前番茄红素已在50多个国家和地区广泛应用于保健食品、 医药与化妆品行业。
番茄红素可溶于乙醚、 石油醚、 正己烷、 丙酮, 难溶于甲醇、 乙醇, 不溶于水。 目前文献报道的番茄红素的检测方法主要有分光光度法、 高效液相色谱法、 纸色谱法及薄层色谱法、 超临界流体色谱法等[7]多种方法。 但是, 这些方法有的程序复杂, 分析时间长, 不易定量, 精密度差; 有的方法则因实验设备和条件所限, 往往难以在一般实验室进行测定。 因此, 在研究了前人关于测定番茄红素的方法的基础上, 从番茄红素的吸收图谱差异入手, 探索了一种简单实用的番茄红素测定方法。
番茄红素(购自上海源叶生物科技有限公司); 石油醚、 丙酮、 甲醇、 二氯甲烷均为国产分析纯 ; TU-1901型双光束可见-紫外分光光度计; CT15RT型高速台式冷冻离心机; 海天牌番茄酱。
1.2.1 不同溶剂对番茄红素吸收的影响
取3个小烧杯, 称取3份番茄红素标准品1 mg, 倒入小烧杯中, 加入6%的二氯甲烷助溶, 将溶解后的番茄红素分别倒入3个50 mL的容量瓶中, 用石油醚、 丙酮、 甲醇三种溶剂分别定容至刻度, 制成番茄红素标准溶液。 用分光光度计在400~600 nm范围内扫描图谱。
1.2.2 番茄红素不同溶剂中标准曲线的制作
吸取番茄红素标准溶液0.5, 1.0, 1.5, 2.0, 2.5, 3.0 μ g· mL-1, 然后用石油醚定容至50 mL, 注入1 cm厚的比色皿中, 以石油醚做参比液, 在最大吸收波长474 nm处测定其吸光度值, 重复三次取平均值, 制作标准曲线。 丙酮、 甲醇按上述同样的方法操作, 得到吸光度值, 制作标准曲线。
1.2.3 二氯甲烷的量对番茄红素含量的影响
取5个50 mL的离心管, 分别编号1, 2, 3, 4和5, 称取10 g的番茄酱置于其中, 分别加入体积为2, 3.5, 5, 7和10 mL的二氯甲烷助溶, 再用石油醚定容至刻度, 静置30 min, 吸取上层清液, 离心, 然后再用分光光度计于474 nm处测吸光度值, 利用标准曲线计算番茄红素含量, 重复以上试验5次。 另两种溶液丙酮、 甲醇按上述同样的方法操作。
1.2.4 不同浸提时间对番茄红素含量的影响
取3个50 mL的离心管, 分别编号1, 2和3, 称取10 g的番茄酱置于其中, 加入体积为2 mL的二氯甲烷助溶, 再用石油醚定容至刻度, 分别静置20, 30和40 min, 吸取上层清液, 离心, 然后再用分光光度计于474 nm处测吸光度值, 重复以上试验三次。 另外两种溶液丙酮、 甲醇按上述同样的方法操作。
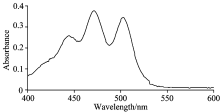
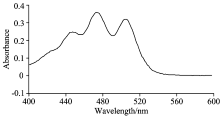
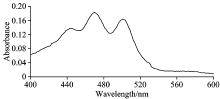
番茄红素在不同溶剂中的吸收图谱见图1— 图3。 由图可以看出, 番茄红素在三种不同的溶剂中均有类似的吸收峰, 但是峰的位置略有不同, 从465~505 nm之间都有两个较大吸收峰, 其中番茄红素在石油醚中的最大吸收峰在471 nm处, 丙酮中最大吸收峰在474 nm处, 甲醇中的最大吸收峰是470 nm处。 由文献[8]报道知番茄红素最大吸收峰的波长约为472~484 nm, 文献[9]报道番茄红素在波长474 nm处有最大吸收峰, 故后面选择474 nm作为测定波长。
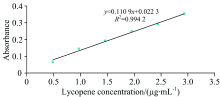
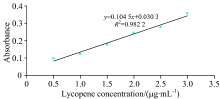
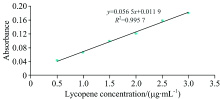
在474 nm处测定番茄红素纯品, 以吸光度值对番茄红素浓度作图, 得番茄红素标准曲线(见图4— 图6)。 由图可知, 以石油醚为溶剂所得回归方程为Y=0.110 9X+0.022 3, R2=0.994 2; 以丙酮为溶剂所得回归方程为Y=0.104 5X+0.030 3, R2=0.982 2, 以甲醇为溶剂所得回归方程为Y=0.056 5X+0.011 9, R2=0.995 7。 三条标线浓度均在0.5~3.0 μ g· mL-1范围内线性关系良好, 说明标准曲线准确度高, 可用来计算番茄红素含量。
采用Duncan新复极差法做多重比较(见表1)可知: 以石油醚为溶剂, 在加入5 mL的二氯甲烷助溶时, 番茄红素的提取效果最显著; 以丙酮为溶剂在加入7 mL的二氯甲烷助溶时, 番茄红素的提取效果最显著; 以甲醇为溶剂在加入10 mL的二氯甲烷助溶时, 提取效果最显著, 且番茄红素的含量随着二氯甲烷的量的增加而提高。 并且无论是加入多少体积的二氯甲烷助溶, 都是以石油醚的提取效果最好。
| 表1 不同溶剂中不同二氯甲烷的量对番茄红素含量的影响 Table 1 Effect of different dichloromethane content in different solvents on Lycopene Content |
采用Duncan新复极差法做多重比较见表2, 以石油醚为溶剂提取番茄红素时, 静置40 min的提取效果最显著, 以丙酮为溶剂提取番茄红素时, 静置20 min的提取效果最显著, 以甲醇为溶剂提取番茄红素时, 静置30 min的提取效果最显著, 并且随着静置时间的增加, 石油醚提取的番茄红素含量逐渐提高, 而丙酮提取的番茄红素含量逐渐降低, 甲醇提取的番茄红素含量在静置20和40 min时差异不显著。
| 表2 不同浸提时间对番茄红素含量的影响 Table 2 Effect of different extraction time on Lycopene content |
以石油醚、 丙酮、 甲醇作为溶剂均可提取出番茄红素, 其中以石油醚的提取效果最好, 丙酮次之, 甲醇的提取率最低, 这可能是由于甲醇为强极性溶剂, 番茄红素不易于溶解, 而石油醚与丙酮为有机溶剂, 番茄红素易溶于其中。 同时, 在实验过程中先加入二氯甲烷助溶, 可帮助提高番茄红素的提取率, 控制浸提时间可达到最佳提取效果。 实验结果表明, 以石油醚为溶剂, 加入5 mL的二氯甲烷助溶, 浸提时间为40 min时, 番茄酱中番茄红素的的提取率最好。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|