作者简介: 任国艳, 女, 1976年生, 河南科技大学食品与生物工程学院副教授 e-mail: renguoyan@163.com
白藜芦醇(Resveratrol, RES)属于非黄酮类多酚化合物, 存在于葡萄科、 百合科等多种植物体内, 是一种具有多种生物活性和药理作用的天然活性物质, 被广泛应用于食品和药品领域。 研究表明多酚在生物体消化吸收过程中, 会与消化酶(如胃蛋白酶、 胰蛋白酶等)相互作用, 使多酚类物质和消化酶的生物活性发生改变, 进而影响多酚物质和其他营养物质的消化吸收, 而RES与胃蛋白酶(Pepsin, PEP)的分子间相互作用机制未见报道。 采用荧光光谱、 紫外-可见吸收光谱、 红外光谱和分子对接模拟等技术研究不同温度下RES与PEP相互作用的结合特性, 为阐明RES和PEP的作用机制提供重要信息, 同时为RES在食品和药品领域的应用提供理论参考。 荧光光谱实验结果表明, PEP的荧光强度随着RES浓度的增加呈现出有规律的降低, 表明RES对PEP有荧光猝灭作用。 加入RES前后, PEP的紫外吸收光谱发生明显变化, 初步判断RES与PEP的相互作用属于静态荧光猝灭类型; 根据Stern-Volmer方程计算得到不同温度下最小猝灭速率常数 Kq值远大于猝灭剂对生物大分子的最大扩散碰撞常数2.0×1010 L·mol-1·s-1, 且猝灭常数( KSV)与温度呈负相关关系, 进一步验证了RES与PEP静态荧光猝灭类型结论。 化学计量结合的值数目大约等于1, 表明一个RES分子只能结合一个PEP分子。 根据Van’t Hoff 方程以及热力学方程计算得到结果显示, Δ G<0, 说明RES与PEP的结合过程可以自发进行; Δ H<0和Δ S<0, 表明RES与PEP之间结合作用力类型主要是氢键和范德华力。 RES与PEP相互作用的同步荧光光谱和三维荧光光谱图表明, 在RES的作用下, PEP的构象和微环境发生变化, 色氨酸或酪氨酸残基所处微环境极性增强, 疏水性减弱, 蛋白构象变得疏松。 红外光谱显示RES能使PEP的二级结构中α螺旋含量降低, β折叠含量增加, β转角和无规则卷曲变化不明显, 这可能会影响PEP的活性。 分子对接模拟实验结果显示RES与PEP中的残基Asp-32, Gly-34, Ser-35, Asn-37, Tyr-75, Gly-76, Thr-77, Ile-128, Ala-130及Gly-217有范德华力作用, 与残基Ile-128及Asp-215产生超共轭效应, 与残基Ser-36, Asn-37, Ile-128及Thr-218形成氢键, 各种作用力使RES与PEP形成较稳定的复合物。
Resveratrol (RES) is a non-flavonoid polyphenols found in many plants, such as Vitaceae and Liliaceae. It is a natural active substance with variety biological and pharmacological functions and widely used in food and pharmaceutical field. Studies have shown that polyphenols had an interaction with digestive enzymes (such as pepsin, trypsin, etc.) in the process of digestion and absorption of organisms, resulting in changes in the biological activity of polyphenols and digestive enzymes and affecting the digestion and absorption of polyphenols and other nutrients. However, the mechanism of interaction between RES and pepsin (PEP) has rarely been reported. The attempt of this paper was to investigate the binding characteristics between RES and PEP at different temperatures by fluorescence spectroscopy, UV-Vis absorption spectroscopy, infrared spectroscopy (FT-IR) and molecular modeling technique. The experimental results provided important information for elucidating the action mechanism of RES and PEP. Fluorescence data revealed that the fluorescence intensity of PEP decreased regularly with the increase of RES concentration, indicating that RES had a fluorescence quenching effect on PEP. After RES was added, the UV-vis spectra of PEP changed significantly. The Kq value (the minimum quenching rate constant) at different temperatures were all much larger than 2.0×1010 L·mol-1·s-1(the maximum diffusion collision constant of the quenching agent on biological macromolecules). Moreover, Stern-Volmer quenching constant ( KSV) gradually decreased with the increase in temperature. These results verified quenching mode between PEP and RES to be static. The value of the stoichiometric binding number approximately equals 1, suggesting that one molecule of RES combined with one molecule of PEP. The thermodynamic parameters indicated that RES could spontaneously bind with pepsin mainly through the hydrogen bonds and Van der Waals forces. Synchronous fluorescence and three-dimensional fluorescence results provided data concerning conformational and some micro-environmental changes of pepsin. According to the results from FTIR analyses of PEP, the content of β-sheet increased accompanying with significantly decrease of α-helix, and no obvious change of β-turn and random coil upon binding with RES. The presence of RES loosened the skeleton of pepsin. These secondary structure changes might lead to changes of the physiological function of pepsin, such as the enzyme activity. Finally, molecular docking further suggested that RES molecule binded within the active pocket of PEP mainly via the van der Waals forces and hydrogen bonds. There were the van der Waals forces between RES and residues Asp-32, Gly-34, Ser-35, Asn-37, Tyr-75, Gly-76, Thr-77, Ile-128, Ala-130 and Gly-217 of PEP, super conjugation between RES and residues Ile-128 and Asp-215 of PEP, and hydrogen bonds between RES and Ser-36, Asn-37, Ile-128 and Thr-218 of PEP. Various forces make RES and PEP form a more stable complex.
白藜芦醇(resveratrol, RES)属于非黄酮类多酚化合物, 广泛存在于葡萄科、 百合科等多种植物体内, 具有多种生物活性和药理作用, 是一种对人类健康有显著作用的天然活性物质。 RES分子有顺式和反式两种结构, 天然的RES多数以反式结构存在(如图1)。 研究表明RES具有潜在的防治心血管疾病、 防癌、 抗衰老及提高机体免疫力等作用[1]。 RES被机体摄入后, 经胃肠道消化、 吸收及代谢而发挥其功效。 大量研究表明, 多酚在生物体消化吸收过程中, 会与消化酶(如胃蛋白酶、 胰蛋白酶等)相互作用, 使多酚类物质和消化酶的生物活性发生变化, 影响多酚物质活性和其他营养成分的消化吸收。 而多酚对消化酶的抑制作用强弱与多酚含量和种类以及消化酶的种类密切相关[2], 目前, 关于RES与PEP的相互作用机制研究未见报道。
本文采用分子荧光光谱、 紫外光谱、 红外光谱(Fourier infrared spectrum, FTIR)及分子对接等多种方法和技术, 检测RES与PEP之间的猝灭常数和结合常数, 确定它们之间主要作用力类型, 考察PEP所处微环境和二级结构的变化, 探究分子间的相互作用形式及作用位点, 从分子结构层面分析RES对PEP空间结构及氨基酸残基微环境的影响, 旨在为阐明RES与PEP之间的作用机理提供重要信息。
Cary eclipse荧光光度计(安捷伦公司, USA); UV-2600紫外-可见分光光度计(岛津公司, Japan); VERTEX70红外光谱仪(布鲁克公司, Germany)。
PEP, 反式RES(上海生工生物工程股份有限公司, 中国); 溴化钾(天津科密欧化学试剂有限公司, 中国)为光谱纯; 其他试剂均为分析纯。 配制2.5× 10-4 mol· L-1 PEP溶液和1× 10-4 mol· L-1 RES溶液, 作为母液, 贮存在0~4 ℃条件下备用。
1.2.1 荧光光谱分析
精确配制RES和PEP溶液, 使RES与PEP的终摩尔比为0, 0.25, 0.5, 0.75, 1, 1.25, 1.5, 1.75, 2和2.25。 分别在298, 304和310 K的温度下反应10 min, 进行荧光光谱测定。 测定条件为: 激发和发射狭缝宽度均为10 nm, 扫描速度为600 nm· min-1, 波长扫描范围为300~500 nm(同步荧光与三维荧光光谱扫描范围为200~500 nm)。 测定项目为: λ ex=280 nm处的荧光发射光谱; 分别固定激发波长和发射波长间距Δ λ =15 nm和Δ λ =60 nm, 记录其同步荧光光谱; 测定RES溶液与PEP体系的三维荧光光谱。 实验所得的荧光强度均采用“ 内滤光效应” 式(1)进行校正[3]。
式中, Fobs为校正前的荧光强度, Fcorr为校正后的荧光强度; ODex为激发波长下的紫外可见吸收值, ODem为发射波长下的紫外可见吸收值。
1.2.2 荧光猝灭机理
设置不同温度, 检测加入RES后PEP的荧光光谱变化, 结合根据Stern-Volmer方程式(2)计算出的热力学参数[4], 揭示RES与PEP之间的荧光猝灭机制。
式(2)中, F0为没有加入RES时, PEP的荧光强度值; F为加入RES后PEP的荧光强度值; Kq为荧光猝灭速率常数; τ 0数值为10-8 s, 表示荧光分子平均寿命; [Q]为猝灭剂(RES)浓度; KSV为Stern-Volmer方程的猝灭常数。
1.2.3 紫外-可见分光光度法分析
不同浓度的RES溶液被分别加入到一定浓度的PEP溶液中, 进行全波长扫描, 扫描波长范围设置在185~700 nm内。
1.2.4 傅里叶变换红外光谱(FTIR)分析
将PEP, RES和RES+PEP溶液冷冻干燥, 按样品粉末与溴化钾粉末1∶ 100 (m/m)的比例混合, 压片。 在4 000~400 cm-1波数范围内对样品进行红外光谱扫描。
1.2.5 分子对接模拟技术
利用分子对接软件(Autodock 4.2.6)分析PEP(PDB ID: 5PEP)的活性区域, 建立尺寸为90 Å × 100 Å × 90 Å 的网格盒子, 盒子中心为(-17.802 Å , 40.376 Å , 86.848 Å )。 分子对接运行100次, 分析PEP与RES作用前后的作用力类型和结合位点, 软件使用的所有参数均为默认值(除文中特殊说明)。
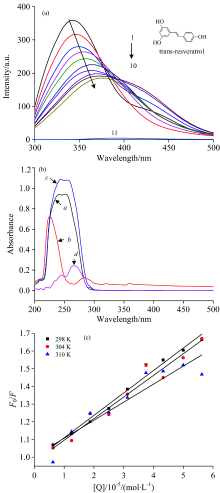
色氨酸和酪氨酸一直被用作蛋白质的内源荧光基团。 蛋白质的荧光光谱可以为蛋白质结构和动力学提供重要的信息。 PEP中含有五个色氨酸残基和十六个酪氨酸残基, 这些残基可以被用作内在的荧光团, 提供PEP与小分子物质相互作用构象变化的相关信息[5]。 RES对PEP荧光强度的影响如图1(a)所示, 当激发波长为280 nm时, RES在此处的荧光(曲线11)特别微弱, 可忽略不计, 而PEP在344 nm处有较强的荧光(曲线1), 因此PEP的荧光信息可通过光谱图直接反映。
从图1(a)中可以看出, 随着RES浓度的不断增加, PEP的荧光强度逐渐降低, 但降低的程度越来越小, 这表明RES与PEP发生了相互作用从而导致PEP内源荧光的猝灭。 在加入不同浓度的RES后, PEP的最大发射峰发生了红移, 表明RES的存在使PEP中的酪氨酸或色氨酸残基所处微环境发生变化[6]。 图1(b)展示了RES与PEP相互作用的紫外可见吸收光谱, 对比曲线b和d可以发现, 随着RES的加入, PEP的紫外吸收峰有明显的改变, 表明在RES作用下, PEP的构象发生改变, 可以初步判断出RES对PEP的猝灭机制为静态猝灭[7]。 为了进一步确定RES对PEP的荧光猝灭类型及机理, 将荧光猝灭数据代入Stern-Volmer方程进行分析, 可得到相关的猝灭参数(表1所示)及不同温度下的Stern-Volmer 曲线[图1(c)]。 从图1(c)中可以看出, F0/F与[Q]之间线性关系良好, 表明RES对PEP的猝灭类型是属于单一的静态猝灭或动态猝灭[8]。 由方程的斜率可计算得到猝灭常数KSV和Kq, 从表1中数据可以看出, 最小的猝灭速率常数Kq值远大于2.0× 1010 L· mol-1· s-1(猝灭剂对生物大分子的最大扩散碰撞常数), 且猝灭常数随着温度升高而降低, 再次验证了RES与PEP两者间相互作用表现为静态猝灭。
| 表1 RES与PEP体系荧光猝灭常数及线性相关系数 Table 1 Quenching rate constants and correlation coefficients of RES+PEP |
结合常数和结合位点数是研究小分子与蛋白质相互作用中重要的定量数据。 荧光光谱和紫外光谱实验结果表明RES与PEP作用类型为静态猝灭, 参考静态猝灭式(3)可以求出两者的结合常数[9]。
式(3)中, F0为PEP的荧光强度, F为加入RES后PEP的荧光强度; K为PEP与RES的结合常数; n为结合位点数; [Q]为RES的浓度。
以lg[(F0-F)/F]为纵坐标, lg[Q]为横坐标作双对数图, 两者间呈线性相关(表2中r值), 根据线性方程的斜率和截距计算不同温度下RES与PEP的结合常数K和两种反应物之间的结合位点数n, 结果见表2。
| 表2 RES与PEP反应过程热力学参数 Table 2 Thermodynamic parameters of RES+PEP reaction process |
从结合常数K可以看出两者具有较强的相互作用, 形成一个结合位点。 RES与PEP之间的作用力类型可根据反应的热力学参数(焓变Δ H, 熵变Δ S, 吉布斯自由能变Δ G)进行判断[10]。 当温度变化不大时, 反应的焓变(Δ H)、 熵变(Δ S)和吉布斯自由能变(Δ G)可由Van’ t Hoff方程(4)以及热力学方程(5)求出[11]。
式中, K为某温度下的结合常数; R为气体常数(8.314 J· mol-1· K-1)。
由表2可知, Δ G< 0, 说明RES与PEP的结合可以自发进行。 该体系的Δ H< 0和Δ S< 0, 可说明RES与PEP之间的作用力主要是氢键和范德华力, 但并不能排除其他作用力的存在。
2.2.1 RES与PEP的同步荧光光谱
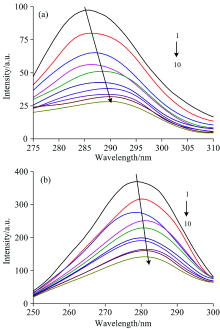
同步荧光光谱可提供荧光团附近微环境变化的相关信息。 在同步荧光光谱中, 当激发和发射的波长差Δ λ 设为15和60 nm时, 可以分别呈现出蛋白质中酪氨酸和色氨酸残基附近的分子结构特点。 RES与PEP相互作用的同步荧光光谱如图2所示, 从图中可以看出, 在两种波长差下, 随着RES的不断加入, PEP酪氨酸和色氨酸的发射峰强度均有所降低, 但下降的程度不同。 Δ λ =15 nm条件下, 随着RES浓度的提高, PEP特征荧光吸收峰不断猝灭, 且由286 nm红移至291 nm。 Δ λ =60 nm的特征荧光吸收峰亦猝灭, 由279 nm红移至281 nm。 这表明RES使PEP中色氨酸和酪氨酸残基附近的微环境发生改变, 极性略有增加, 疏水性减小, PEP结构变得疏松[12]。 这与荧光光谱所测结果一致。
2.2.2 RES与PEP的三维荧光光谱
三维荧光光谱技术可以完整地呈现出样品的荧光信息, 是描述荧光强度同时随激发、 发射波长都变化的荧光光谱, 比二维荧光图谱包含更丰富的信息。 图3显示PEP单独存在时[图3(a)]以及与RES相互作用的三维荧光光谱图[图3(b)]。 峰a(λ ex=λ em)是瑞利散射峰, 峰1主要展现PEP中色氨酸或酪氨酸残基的荧光光谱特征。 图3(a)中显示PEP溶液峰1的相对荧光强度为368.7, 当加入RES后, 其相对荧光强度下降至267.0, 并出现了新的峰2[图3(b)], 表明RES与PEP形成复合物, 并引起PEP构象的变化[13]。 加入RES前后, PEP溶液峰1的发射波长由340 nm红移到361 nm, PEP中色氨酸或酪氨酸所处环境疏水性减弱。 这进一步验证了荧光光谱和同步荧光光谱的结果。
 | 图3 PEP及RES+PEP的三维荧光光谱Fig.3 The three-dimensional fluorescence contour spectra of PEP (a) and RES+PEP (b) |
2.2.3 傅里叶变换红外光谱
蛋白质的红外光谱可以反映蛋白质构象的变化, 酰胺Ⅰ 带(1 700~1 600 cm-1范围内, 主要是C=O伸缩振动)和酰胺Ⅱ 带(1 600~1 500 cm-1范围内, 主要是C— N伸缩振动和N— H弯曲振动)红外吸收峰是蛋白质特征吸收峰, 通过对它们进行去卷积处理, 可以获得蛋白质二级结构的相关信息[14]。 对PEP加入RES前后红外图谱的1 700~1 500 cm-1部分分别进行去卷积处理(表3), 结果显示加入RES前后, PEP二级结构中, α 螺旋含量由21.19%变为17.23%, β 折叠含量由45.34%变为49.76%, β 转角含量由28.61%变为28.08%, 无规则卷曲含量由4.86%变为4.93%, 这一实验结果表明, RES对PEP的二级结构产生影响, 使其α 螺旋含量降低, β 折叠含量增高, β 转角和无规则卷曲变化不明显, 这可能由于RES与PEP之间主要通过氢键和范德华力产生相互作用, 这种作用会影响PEP的二级结构, 进而影响其活性。
| 表3 RES对PEP二级结构的影响 Table 3 The effect of RES on the secondary structure of pepsin |
为了更加直观的反映RES与PEP的结合状态, 利用分子对接技术对它们之间的相互作用进行模拟研究[15]。 从若干对接结果中选取结合位点出现最多的簇, 再从中选取结合能最低的构象进行分析, 所得结果如图4所示。 RES与PEP的结合位点位于PEP的凹槽, 即活性中心, 结合能为-29.59 kJ· mol-1。 RES与PEP中的残基Asp-32, Gly-34, Ser-35, Asn-37, Tyr-75, Gly-76, Thr-77, Ile-128, Ala-130及Gly-217有范德华力作用, 与残基Ile-128及Asp-215产生超共轭效应。 残基Ser-36, Asn-37, Ile-128及Thr-218与RES形成氢键, 各种作用力使RES与PEP形成较稳定的复合物。
利用荧光光谱法等多种光谱技术和分子对接技术研究RES与PEP的作用机制。 结果表明RES与PEP之间以1∶ 1结合并相互作用发生静态荧光猝灭, 该过程可自发发生。 PEP与RES结合有一个结合位点, 二者之间的作用力主要是氢键和范德华力。 在RES的作用下, PEP中色氨酸和酪氨酸所处的微环境发生变化, 极性增强, 疏水性减弱, 空间结构变得疏松; PEP的二级结构也发生变化, 其中α 螺旋含量明显降低, β 折叠含量明显增加; 分子对接结果进一步验证以上结果, 并直观反映了RES与PEP之间的相互作用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|