作者简介: 张秋兰, 女, 1979年生, 南昌大学化学学院副教授 e-mail: qlzhang@ncu.edu.cn
孔雀石绿(LMG)在治理鱼卵中霉菌和杀灭鱼体寄生虫等方面的效果显著, 广泛应用于水产运输和养殖。 孔雀石绿进入动物机体后, 通过生物转化代谢为脂溶性的隐色孔雀石绿(LMG), LMG的毒性超过MG; LMG能快速在组织中蓄积, 具有致癌、 致畸、 致突变等毒副作用。 白蛋白可与多种内源和外源化合物结合, 是血浆中含量最丰富的载体蛋白, 也是药物发挥作用的重要载体和靶标。 模拟pH 7.4的生理条件, 通过荧光光谱和圆二色谱法(CD)采集两种不同滴加方式的LMG与牛血清白蛋白(BSA)动态作用过程中的多维数据, 并应用化学计量学多元曲线分辨-交替最小二乘法(MCR-ALS)对多维波谱数据进行解析和描述, 从重叠严重的光谱数据中同时得到作用体系的定量和定性信息。 从解析得到的浓度趋势图中, 说明体系在LMG∶BSA=2∶1时达到动态平衡, 并可确认复合物LMG2-BSA的生成; 解析得到的与所测量的BSA荧光和CD图符合, 印证由MCR-ALS获得的浓度趋势图的可靠性和正确性; 通常由重叠光谱中无法辨别的LMG2-BSA复合物荧光光谱和CD谱图也可由数学解析获得, 进一步印证了复合物的存在。 原子力显微镜(AFM)测量结果表明BSA与LMG结合后, BSA的形貌发生改变, 表面粗糙度(RMS)由(1.24±0.28) nm增至(13.47±0.53) nm; 同时由CD实验结果可知LMG与BSA作用达到平衡时, α-螺旋结构的含量从46.5%降低到42.3%, 推测是BSA所处微环境和构象发生变化所致。 荧光探针实验发现经典site Ⅰ标记物华法林加入后, LMG-BSA的猝灭常数由2.65×106 L·mol-1降低为1.88×106 L·mol-1, 但加入site Ⅱ标记物布洛芬后, LMG-BSA的猝灭常数变化不明显, 由此推断LMG可能结合在蛋白质的亚域ⅡA, 即site Ⅰ位。 分子对接证实BSA的Ⅰ位有足够的空间容纳LMG, 且LMG与BSA之间的主要作用是疏水作用力。 该研究从分子水平了解LMG与生物大分子的作用机制, 并为LMG的毒副作用研究提供重要的信息。
Leucomalachite Green (LMG) is a major metabolite of malachite green (MG). It has a long residence period in edible fish tissues. At present, the use of MG has been banned in some countries for its increased risk of carcinogenesis, mutagenesis and other adverse effects to human health. However, MG is still widely used in aquaculture, aquatic transport and storage for its low price. The interaction between LMG and bovine serum albumin (BSA) under simulative physiological conditions was investigated by spectroscopy. Two spectroscopic approaches (fluorescence and circular dichroism) and two different experiments were used for monitoring the biological dynamic process. Qualitative and quantitative information was obtained with the resolution of the data matrices by chemometrics method - multivariate curve resolution-alternating least squares (MCR-ALS). Atomic force microscope (AFM) was executed in order to verdict the particle morphology and dimensions of the LMG-BSA conjugates. The root mean square (RMS) roughness of the individual BSA molecule was found to be (1.24±0.28) nm. The BSA molecule particle was observed to be looser on the mica substrate upon interaction with LMG. The RMS was changed to be (13.47±0.53) nm for the LMG-BSA interaction. The calculated result of circular dichroism (CD) spectra revealed that the α-helical content for the LMG-BSA complex was 42.5%, which has a slight decrease compared with the free BSA (46.3%). The results of AFM and CD spectra showed that the binding of LMG to BSA induced micro-environmental and conformational changes of BSA molecules. In order to identify the LMG-binding site on BSA, site marker competitive experiments were carried out, using drugs which were specifically bound to site Ⅰ (warfarin) and site Ⅱ (ibuprofen) on BSA. The binding constant of the system with warfarin (1.88×106 L·mol-1) was almost 70% of that without warfarin (2.65×106 L·mol-1), while the constants of the systems with and without ibuprofen had only a small difference, indicating that LMG was bound to site Ⅰ of BSA. The molecular docking gave more intuitive understanding of the binding of LMG and BSA. It was recognized that LMG binds within the sub-domain ⅡA pocket in domain Ⅱ of BSA. These values showed that hydrophobic forces were the main interactions in the binding of LMG to BSA and the stabilization of the complex. It can be expected that the study will have great significance in helping to further clarify the metabolism and distribution of LMG in vivo and the mechanism of toxicological effects and pharmacokinetics from molecular level.
孔雀石绿(MG)是有毒的三苯甲烷类化学物质, 属杀真菌、 细菌、 寄生虫药物, 在鱼组织内主要以代谢物隐色孔雀石绿(LMG)形式存在, 长期食用含LMG的鱼类可致癌[1]。 美国、 加拿大、 日本等国家及欧盟都将其列为水产养殖违禁药物[2]。 由于目前没有廉价有效的替代物, 孔雀石绿在水产养殖中的使用仍频繁发生, 现今的报道着重于提高MG和LMG检测限和灵敏度[3, 4, 5]。 血清白蛋白(SA)是血浆中含量最丰富的的载体蛋白, 外源物与SA的结合作用及亲和力大小也影响到其在动物体内的分散、 转运、 储存、 代谢、 清除以及毒副作用等[6]。 因此, 研究LMG与SA的作用对理解药物的作用机制具有重要意义[7]。 Zeng等[8]已用荧光光谱法和共振光散射研究LMG与牛血清白蛋白(BSA)的相互作用。 本文的研究重点为: (1) 采用原子力显微镜(AFM)和圆二色谱(CD)研究LMG对BSA构象的改变; (2) 通过多元曲线分辨-交替最小二乘法(MCR-ALS)来揭示LMG与BSA作用的动力学和热力学过程随时间和反应物浓度的变化情况; (3) 通过分子对接更直观地认识LMG与BSA的作用历程。
隐色孔雀石绿(Sigma-Aldrich Chemical Co, ≥ 98%)储备液: 以乙腈配成5.00× 10-3 mol· L-1的溶液; 牛血清白蛋白(BSA, 国药集团化学试剂有限公司)用二次水配制成2.0× 10-4 mol· L-1的储备液; 称取华法林(6.61 mg)和布洛芬(4.13 mg)(上海医药集团有限公司), 二次水溶解并定容至50 mL, 得到4.0× 10-4 mol· L-1的溶液。 PE LS-55荧光分光光度计, 1.0 cm比色皿, 激发狭缝10 nm和发射狭缝5 nm, 扫描速度1 200 nm· min-1; 圆二色谱仪(法国, Bio-Logic公司, 0.1 cm比色皿, 测量参数为: 持续氮气流的条件下, 狭缝1 nm, 扫描速率1 nm· s-1, 扫描3次取平均值, 响应时间0.25 s)和AJ-Ⅲ 原子力显微镜(上海爱建纳米公司)。
荧光实验: 在比色皿中依次加入3.0 mL的Tris-HCl (pH 7.4)缓冲溶液[9], 实验过程中忽略体积效应, 放置5min达平衡, 在298 K下测其荧光光谱。 实验1: 先固定BSA的浓度1.00× 10-7 mol· L-1, 然后加入不同量的LMG, 使其分别为0, 2.00, 4.00, …, 16.00× 10-8 mol· L-1, 浓度间隔2.00× 10-8 mol· L-1。 实验2: 分别固定[BSA]∶ [华法林]=1和[BSA]∶ [布诺芬]=1, cBSA=1.00× 10-7 mol· L-1, 加入不同浓度的LMG, 0, 2.00, 4.00, …, 16.00× 10-8 mol· L-1, 浓度间隔2.00× 10-8 mol· L-1。
AFM实验3: 取6.0 mL前一天配置的BSA(cBSA=6.67× 10-8 mol· L-1)和LMG-BSA([LMG]∶ [BSA]=2)样品滴在新鲜剥离的1.2 cm× 1.2 cm的云母片上, 室温下放置24 h干燥后, 在敲击模式下扫描。
实验4(荧光法,
Tauler等提出经典MCR-ALS法, 但由该法处理数据所得到的体系信息量较简单, 随后Tauler等对其进行了改进— 解析扩展矩阵(多维数据解析的优势在于可获得唯一的分解结果, 即可分辨出体系中有意义组分的相对浓度和光谱趋势图[10])。 本工作通过两种测量技术结合不同溶液滴加方式得到四个波谱数据矩阵(见1.3), 在行和列的方向将
式(11)中
LMG的结构使用ChemBio 3D Ultra 14.0得到, 并利用MMFF94分子力场进行优化。 BSA的结构来自RSCB数据库(编号: 1 ADC)。 使用软件AutoDock4中的遗传算法程序(Lamarckian, 参数为默认设置)对LMG和BSA进行对接, 并采用LigPlus+对最低的构象进行分析。
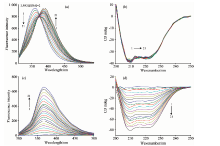
BSA内源荧光主要来自于色氨酸[9]。 固定BSA浓度不断加入LMG时, BSA在360 nm处的荧光峰逐渐减弱且红移, 在达到[LMG]∶ [BSA]=2∶ 1后[曲线11, 图1(a)], 荧光峰变化不明显, 但在390 nm处出现一新的发射峰, 且375 nm处发现等发射点, 表明体系处于动态平衡并可能生成复合物。 固定LMG不断加入BSA的荧光光谱如图1(c)所示, LMG在280 nm激发下并不产生荧光峰[曲线1, 图1(c)], 加入BSA后在360 nm处出现BSA的发射峰, BSA的浓度逐渐增加后, 峰强度和峰宽都有比例的增加。 在蛋白质的二级结构中, α -螺旋两个负的特征肩峰谱带出现在208和222 nm处; 在216 nm处的负谱带是α -折叠的特征曲线[12]。 由图1(b)可知, 随着LMG的加入, BSA的CD谱带变化较小且无规则交结在一起; 而固定LMG[图1(d)]不断加入BSA, 在208和222 nm处的两个负特征肩峰均逐渐增大。 从单个重叠严重且信号覆盖的图谱[图1(a)— (d)]中, 难以直观得到更多有效信息。
将图1中的4个图谱数据组成一扩展矩阵
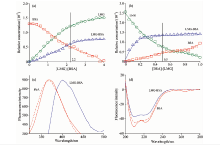
通过AFM即可观察生物大分子的形貌, 也能够持续监测生化反应的动力学过程[14]。 在本工作中, BSA与LMG结合后, 其厚度和分子直径都相应增大, 表面粗糙度(RMS)由(1.24± 0.28) nm增至(13.47± 0.53) nm[图3(a)和(b)]。 选择CD实验5的第1和11条(两者处于平衡状态, [LMG]∶ [BSA]=2)曲线[图3(c)], α -螺旋在208和222 nm处两个负的特征肩峰谱带都有所减弱(根据公式[15]计算, α -螺旋含量由46.5%减小为42.3%), CD与AFM结果基本一致, LMG与BSA结合后使蛋白部分伸展, BSA所处微环境和构象发生变化[16]。
加入site Ⅰ 标记物(华法林)时[图4(a)], LMG-BSA的猝灭常数由2.65× 106 L· mol-1减少为1.88× 106 L· mol-1, 而site Ⅱ 标记物(布洛芬)加入后[图4(b)], LMG-BSA的猝灭常数为2.79× 106 L· mol-1变化不明显[图4(c)], 因而推测LMG作用在BSA上的亚域Ⅱ A, 即site Ⅰ [15]。
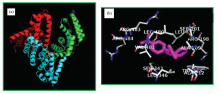
利用Autodock 4.2对LMG与BSA形成的非共价复合物进行了研究(图5), BSA的I位有足够的空间容纳LMG, 通过LigPlus+软件分析得知LMG与BSA之间主要为疏水作用, LMG与Ala 209, Ala 212, Trp 213, Leu 197, Leu 480, Leu 346和Val 481等七种疏水氨基酸作用[17]。
利用荧光光谱法、 CD珐、 AFM和分子对接研究LMG与BSA的相互作用。 AFM和CD实验表明LMG的存在不仅改变了BSA所处的微环境并使BSA的构象发生变化。 应用MCR-ALS解析拓展的荧光和CD光谱矩阵, 由重叠光谱中可同时获得定量(各因子数的浓度变化趋势)和定性(不能单独用化学或物理方法分离的多组份和中间体的检测)信息, 进一步认识LMG与BSA在作用过程中的动态变化过程和达到平衡时各组分的状态。 而分子对接更直观的表明LMG结合在BSA的site Ⅰ 位且主要作用力为疏水作用。 通过本研究探讨具有毒副作用的LMG与蛋白质的作用过程, 在分子水平认识和揭示LMG分子在机体内的运输、 代谢过程和毒理机制具有重要意义。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|