作者简介: 曹思敏, 1993年生, 华东师范大学精密光谱科学与技术国家重点实验室硕士研究生 e-mail: 1306289306@qq.com
甲醛(HCHO)是目前室内空气主要污染物之一, 长期暴露在过量甲醛环境中会对人的眼睛、 皮肤、 呼吸器官等产生严重危害, 甚至可能导致神经系统功能的丧失[
Formaldehyde (HCHO) is one of the main pollutants of indoor air. Exposure to excessive formaldehyde for a long time will cause serious damage to human eyes, skin and respiratory organs, and even lead to loss of the function of nervous system[
双光束紫外-可见分光光度计(TU1901, 北京普析通用); 稳态荧光光谱仪(FluoroMax-4, Horiba); 气相色谱质谱联用仪(Agilent 7890B-5977A, 美国安捷伦)。
使用的所有化学试剂均商业购买且未经任何提纯处理。 甲醛溶液(37%)购自上海麦克林生化科技有限公司; 4-氨基-3-戊烯-2-酮(Fluoral-P, 98%), 4-氨基-1, 1, 1-三氟-3-丁烯-2-酮(3F-FP, 95%)和乙腈(HPLC纯)均购自百灵威科技有限公司; 冰醋酸购自于国药集团化学试剂有限公司; 实验所用的水均为18.2 MΩ · cm-1去离子水。
在酸性环境下, Fluoral-P与甲醛反应速率更快[11], 因而Fluoral-P, 3F-FP与甲醛反应的相关实验均在酸性环境下进行。 将乙腈与醋酸水溶液(pH=1.73)按体积比5∶ 1混合, 所有溶液均用该混合溶剂配置。 配制200 μ mol· L-1的Fluoral-P和3F-FP溶液各1 mL, 间隔一定时间测量吸收光谱, 得到Fluoral-P和3F-FP的水解过程; 配置10 mmol· L-1 3F-FP溶液1 mL, 加入5 mmol· L-1甲醛溶液1 mL, 反应166 h后测量GC-MS; 配置上述相同3F-FP和甲醛溶液, 混合均匀后, 间隔一定时间测量紫外可见吸收光谱和稳态荧光光谱。 采用2 mm石英比色皿, 荧光光谱使用443 nm激发。
Fluoral-P+2H2O=acetylacetone+N
t=0 [F]0 [H2O]0 0
t=t [F]t [H2O]t [A]t
Fluoral-P的水解过程可用式(1)表示, Fluoral-P水解后生成产物乙酰丙酮[12]。 其中[F]0和[F]t分别表示初始时刻和t时刻Fluoral-P的浓度, [H2O]0和[H2O]t分别表示初始时刻和t时刻水的浓度, [A]t表示t时刻水解产物乙酰丙酮的浓度。 根据反应方程可以得到t时刻乙酰丙酮和水的浓度分别为[A]t=[F]0-[F]t和[H2O]t=[H2O]0-2([F]0-[F]t)。
根据实验方法, 可以得到Fluoral-P初始浓度为[F]0=200 μ mol· L-1=2× 10-4 mol· L-1, 而水分子初始浓度为[H2O]0=
式中, k为Fluoral-P水解速率常数, 求解该微分方程得到Fluoral-P的浓度随时间的函数
考虑到Fluoral-P和水解产物乙酰丙酮的吸收光谱存在重叠, 则吸光度应同时考虑两种物质的共同贡献, 设Fluoral-P和乙酰丙酮在同一波长处的消光系数分别为ε 1和ε 2, 则吸光度可表示为
式中, l为吸收厚度。
结合式(3)和式(4)可用Matlab对吸光度变化进行拟合, 从而得到Fluora-P水解速率常数R。
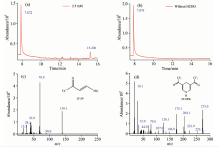
为了比较Fluoral-P和3F-FP水解速率的差异, 首先研究了Fluoral-P和3F-FP在酸性环境下吸收光谱随时间的变化。 Fluoral-P分子在酸性环境下极易发生水解生成产物乙酰丙酮, 其对应的特征吸收带分别位于300 nm[13]和273 nm[14]处。 图1(a)是Fluoral-P在不同时间测得的吸收光谱。 初始时刻, 吸收峰位于296 nm处, 随着水解时间的增加, 296 nm处的吸收峰逐渐下降, 并且峰值逐渐蓝移。 120 min后, 吸收峰蓝移至273 nm处, 随后基本保持不变。 图1(a)表明在该溶液环境中, Fluoral-P发生了水解反应生成乙酰丙酮, 从而引起吸收峰的蓝移。 图1(b)是3F-FP在不同时间测得的吸收光谱。 从图中可以看出, 初始时刻, 其吸收峰位于308 nm处, 与文献报道相一致[15]。 在随后的26 h内, 其吸收峰位置始终保持不变, 整个吸收光谱也只有微小变化, 这表明在26 h内, 3F-FP分子几乎没有发生水解, 表现出了较好的稳定性。
随后, 为了定量描述Fluoral-P和3F-FP水解速率的差异, 我们计算了其水解反应速率常数k。 对于Fluoral-P分子, 我们采用其在296 nm峰值处的数据进行处理, 由于在296 nm处, Fluoral-P和乙酰丙酮均具有较高的消光系数, 两种物质对296 nm处的吸光度贡献都需要考虑。 水解反应初始时刻, 溶液体系中有200 μ mol· L-1 Fluoral-P, 而160 min时Fluoral-P基本完全水解, 溶液体系中有200 μ mol· L-1乙酰丙酮。 分别利用在0和160 min时的吸收光谱计算Fluoral-P和乙酰丙酮在296 nm处的消光系数ε 1和ε 2。 计算得到ε 1=15 450 L· mol-1· cm-1和ε 2=2 000 L· mol-1· cm-1, 与文献报道数据相近[16, 17]。 根据式(3)和式(4), 我们对296 nm处的吸光度数值进行拟合, 得到Fluoral-P浓度随时间变化的曲线如图2(a)所示。 从图中可以看出, 拟合曲线与实验数据基本吻合, 拟合得到Fluoral-P水解速率常数为k=9.335 5× 10-4 L2· mol-2· min-1=1.555 9× 10-5 L2· mol-2· s-1(R2=0.997)。 图2(b)是3F-FP浓度随时间的变化曲线, 在26 h内, 3F-FP浓度基本没有明显改变, 无法进行拟合, 但可以看出3F-FP对应着一个极小的水解速率常数, 接近0。
2.2 3F-FP与甲醛反应前后GC-MS的比较
为了确定3F-FP与甲醛反应的生成物, 我们进一步对反应后的混合物进行GC-MS实验, 如图3所示。 图3(a)是甲醛与3F-FP反应166 h后测量的GC-MS, 可以看到在7.872 min处存在一个最高峰, 其相应的质谱如图3(c), 该处的峰值对应着3F-FP分子。 同时在15.206 min处还存在一个次高峰, 其对应的质谱如图3(d)所示, 通过质谱分析, 我们发现该处的质谱与6F-DDL分子相吻合。 图3(b)是相应的对照组, 其中没有加入甲醛, 可以看到其GC-MS谱上只在7.879 min处存在一个峰, 对应着3F-FP分子。 GC-MS实验表明甲醛与3F-FP发生反应后生成了环状化合物6F-DDL(反应方程式如Scheme 1所示)。
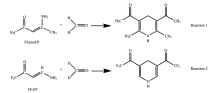 | 示意图1 反应物 (Fluoral-P和3F-FP) 以及其与甲醛反应形成的二甲基吡啶衍生物的化学结构Scheme 1 Chemical structures of reagents (Fluoral-P and 3F-FP) and their transformation into lutidine derivatives after reaction with HCHO |
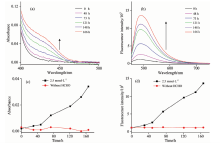
我们进一步研究了甲醛对3F-FP紫外可见吸收光谱和荧光光谱的影响。 图4(a)是向5 mmol· L-1 3F-FP中加入2.5 mmol· L-1甲醛后, 在不同时刻测得的吸收光谱。 可以看到, 随着时间的增加, 在430 nm左右处出现了一个新的吸收带, 并且逐渐上升。 图4(b)是5 mmol· L-1 3F-FP中加入2.5 mmol· L-1甲醛后, 在不同时刻测得的荧光光谱。 可以看到, 初始时刻在489 nm处有一个相对较弱的荧光峰, 随后, 这一荧光峰随时间增加而明显升高。 166 h后, 489 nm处的荧光强度增长到初始时刻的12倍以上。 而没有加入甲醛时, 无论是吸收光谱还是荧光光谱在166 h内均没有明显改变。 图4(c)是实验组和对照组在443 nm处的吸光度随时间变化的比较, 加入甲醛的一组, 其吸光度随时间增加而明显增加, 并且曲线呈现出线性增长趋势。 而没有加入甲醛的一组, 其吸光度随时间增加基本没有明显变化, 曲线保持平稳趋势。 图4(d)是实验组和对照组在489 nm处的荧光强度随时间变化的比较, 与吸光度比较的结果相类似, 加入甲醛的一组, 荧光强度随时间增长而明显增加, 并且曲线呈现出线性增长趋势。 没有加入甲醛的一组, 其荧光强度基本不随时间变化。
实验结果表明, 在3F-FP中加入甲醛后, 其吸收光谱和荧光光谱发生了明显的改变。 吸收光谱在430 nm处出现了一个新的吸收带, 而荧光光谱在489 nm处的荧光强度也随时间逐渐增强。 Fluoral-P与HCHO发生反应会生成环状化合物DDL, 在410 nm处形成新的吸收带, 并且在510 nm处会有新的荧光峰出现[11]。 图3和图4的实验结果以及前面GC-MS的实验结合表明, 在3F-FP中加入甲醛后, 发生了与Fluoral-P类似的反应生成了环状化合物6F-DDL(反应方程式如Scheme 1所示), 从而引起紫外可见吸收光谱和荧光光谱的相应改变。
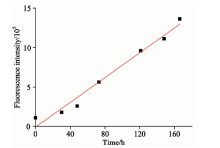
由图4可见, 荧光增强相对于吸收增强更加明显, 并且在489 nm处的荧光表现出线性增长的趋势。 因而, 我们对489 nm处的荧光变化进行线性拟合, 如图5所示, 拟合得到曲线斜率为k=7.881× 103 h-1(R2=0.972)。 曲线斜率表示荧光增长速率, 反映了3F-FP与甲醛反应速率的快慢。 这一荧光增长速率还可以通过以下多种方法进一步提高: (1)通过旋涂或溶胶凝胶等方法, 将3F-FP引入固体媒介中可以提高3F-FP浓度, 文献表明Fluoral-P在固体载体中的浓度可以高达几个摩尔级别[10]; (2)在气体实验环境下, 通过采用多孔玻璃等作为探针载体, 可以提高探针分子与甲醛的接触表面积, 从而提高反应速率; (3)通过气体泵浦的方式提高气流速度也可以提高反应速率[11]; (4)还可以选择合适的催化剂从而加快这一反应速率。 总而言之, 3F-FP在气体甲醛检测领域表现出了良好的应用前景。
致谢: 感谢法国科学院NIMBE研究所研究员Thu-Hoa TRAN-THI对实验的建议和指导。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|