作者简介: 张 铭, 1995年生, 南昌大学理学院硕士研究生 e-mail: 1743084891@qq.com
血液中含有众多生物信息, 如激素、 酶、 抗体等丰富的蛋白质成分。 通过对血液中众多生物信息进行检测鉴定可以起到对该血液种属判定、 溯源的目的。 因此, 血液检测技术的发展在诸如刑事案件侦破、 物种鉴定、 疾症预防等领域具有重要意义。 目前, 传统血液检测手段多为显微观测、 免疫法、 DNA/基因检测法等, 这些技术会对血液样本造成不可逆转的破坏性, 且存在分析周期长、 结构装置复杂、 试验价格昂贵等问题。 随着激光技术的发展, 拉曼光谱技术作为一种非线性散射光谱技术, 在血液检测技术中得到了应用。 在血液检测技术中, 拉曼光谱技术通常与共聚焦显微系统结合, 对涂在载玻片上或盛放在透明容器中的血液样品进行光谱信号采集。 该技术具有快速、 无损等优势, 但复杂的光路系统及昂贵的实验装置限制了该技术的广泛推广。 为提出一种装置简单、 操作简便的血液拉曼检测新技术, 研究采用基于毛细管的显微拉曼技术方案采集并分析人全血的拉曼信号。 血液样品通过毛细管的虹吸效应取样, 与载玻片的涂样方式相比毛细管的方案具有模拟人血管、 维持血液活性、 减小空气对实验过程中血液成分的影响、 降低激光对血液样品的灼伤效果等优势。 为避开可见光部分荧光较强区域的荧光干扰, 研究采用360 nm紫外激光器作为激发光源, 防止可见荧光信号的干扰。 积分时间设为800 ms, 有效避免因激光长时间照射对血液样品的灼伤效果, 影响实验数据的稳定性与真实性, 光谱平均次数为2次, 避免单次测量所带来的数据的不准确性影响。 光谱扫描范围为500~1 800 cm-1, 结果表明此范围内可较好的避开可见光部分荧光较强区域的干扰。 测得的拉曼光谱信号通过滤波去噪及基线校正进行处理。 首先采用5阶离散小波变换滤波, 进行1层信号分解, 滤除高频噪声信号, 保留低频有效信号, 从而去除杂散信号, 对光谱有效信号进行提取。 其次, 采用4阶多项式拟合扣除基底的基线校正, 实现人全血的毛细管显微拉曼光谱峰值信号的提取。 最终, 通过查询SDBS数据库以及人血样本通过reishaw共聚焦显微拉曼光谱仪测量所得光谱图进行验证发现测得信号中部分为人体内数种氨基酸成分的拉曼信号。 实验研究发现, 基于毛细管的显微拉曼实验系统与常规拉曼探头实验系统相比, 拉曼信号更稳定、 重复性高, 可有效提取人全血中的拉曼光谱信号, 而其与高精度的共聚焦显微拉曼系统相比价格便宜、 结构简单、 易于推广等优点, 但信号信噪比、 有效信号的峰值强度上仍有进一步的提升, 是一种测量人全血拉曼信号的可行方案。
The blood contains a variety of biological information such as hormones, enzymes, antibodies and so on. The detection and identification of numerous biological information in the blood can be used to determine and trace the origin of the blood species. Therefore, the development of blood analysis is of great significance to the fields such as criminal cases detection, species identification, disease prevention and so on. At present, the traditional blood detection methods are mostly microscopic observations, immunoassays and DNA/gene detection methods. These techniques can cause irreversible damage to blood samples and have problems such as long analysis cycle, complicated structure apparatus and high test prices. With the rise of laser technology, as a non-linear scattering spectroscopy, Raman spectroscopy is used in blood detection techniques. In blood detection techniques, Raman spectroscopy is usually combined with confocal microscopy to collect blood samples that have been coated on glass slides or in transparent containers because of its advantages like being fast, nondestructive, ect. However, complex optical systems and expensive experimental setups limit the widespread use of this technology. To provide a simple and easy-to-use method for detecting blood Raman, the Raman signal of human whole blood was collected and analyzed by a capillary-based Raman spectroscopy. Blood samples were sampled by siphon effect of the capillary. Compared with the loading of the carrier, the blood sample had the advantages of simulating human blood vessels, maintaining blood activity, reducing the degradation effect of oxygen on blood components and reducing the laser burns on blood samples. In order to avoid the fluorescence interference in the region of strong fluorescence of visible light, a 360 nm ultraviolet laser was used as an excitation light source to prevent the interference of the visible fluorescence signal. The integration time was set to 800 ms, which effectively avoided the burns on the blood sample caused by the laser irradiation for a long time which would affect the stability and authenticity of the experimental data. The average number was 2 times, aiming at avoiding the impact of inaccurate data caused by a single measurement. Spectral scanning range was 5001 800 cm-1. The results showed that this range can better avoid the interference of the stronger fluorescence region of the visible light portion. The spectral signal at this time was processed by filtered denoising and baseline correction. Firstly, a 5-order discrete wavelet transform filter was used to decompose the signal at the first layer. The high-frequency noise signal was filtered out, and the low-frequency effective signal was retained to remove the spurious signal, and the effective signal of the spectrum was extracted. Secondly, baseline correction for the use of fourth-order polynomial fitting base and subtraction, aiming at achieving human whole blood capillary Raman peak signal extraction. Finally, the spectra obtained by inspecting the SDBS database and human blood samples were measured by reishaw confocal Raman spectroscopy to verify that some of the measured signals were Raman signals of several amino acid components in the human body. Experimental studies have found that the capillary-based Raman experimental system is more stable and repeatable than the conventional Raman probe system, and can effectively extract Raman spectrum signals in human whole blood, and its high Accuracy of confocal Raman microscopy system is cheaper, simpler and easier to be popularized, but the signal SNR and the peak intensity of the effective signal remain to be further improved. It is a possible solution to detecting human blood Raman signal.
血液是人或动物体内循环系统的不透明液体。 其主要由为血浆、 血细胞、 遗传物质组成。 由于血液中包含着众多生物信息, 针对于血液分析在诸如刑事案件侦破、 物种鉴定、 疾症预防等领域具有重要意义。 传统检测手段多为显微观测、 免疫法、 DNA/基因检测法等。 这些技术在应用中均存在对血液样本造成不可逆转的破坏性、 分析周期性长等问题。 故而寻找一种新的识别方法迫在眉睫。
近年来, 随着激光技术的兴起, 拉曼光谱技术因其快速、 无损等检测优势在许多领域取得了很大的发展。 拉曼光谱是一种散射光谱, 于1928年被印度物理学家Raman发现。 拉曼光谱技术作为一种物质结构的分析手段而被广泛应用于聚合物研究[1]、 食物检测[2]、 司法鉴定[3]等领域。 而关于血液的研究, 国内外研究学者也取得了一定成果。 Virkler与Lednev将近红外拉曼光谱与统计学方法结合, 成功区分人、 犬、 猫三者的血迹。 McLaughlin等[4]利用共聚焦显微拉曼光谱技术对11种动物与人血样进行分类鉴别, 取得了良好的识别效果。 白鹏利等[5]等针对三种不同的动物及21个人血液作为分析对象采用PCA结合拉曼光谱进行血液识别检测, 其结果识别率均高于95%。 郑祥权等[6]将拉曼光谱与数理统计方法结合, 构建人血于全血种属判别模型, 盲测集分类正确率达90%。 诸如此类研究均适用于共聚焦显微拉曼系统平台研究。 但常规共聚焦显微拉曼平台系统存在价格昂贵, 体积较大等问题。
通过模拟微循环系统, 提出一种基于毛细管的显微拉曼光谱检测技术, 该实验装置与共聚焦显微拉曼系统相比具有价格便宜, 结构简单、 易于推广等优势, 与常规拉曼探头系统相比能有效地检测出液体血液中的拉曼信号, 且采用的毛细管与传统测量的载玻片相比具有模拟人血管、 维持血液活性、 减小空气对实验过程中血液成分的影响、 降低激光对血液样品的灼伤效果等优势, 便于推广血液拉曼光谱检测方面的研究。
研究分为2组对比实验, 一组为常规拉曼探头测量人全血的实验, 即采用常规拉曼探头直接测量PVE塑料离心管中人全血的拉曼光谱信号。 另一组为毛细管显微拉曼测量人全血的实验, 即基于内径0.5 mm毛细管的显微拉曼实验。
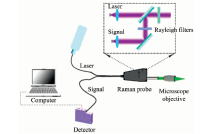
激光器采用长春新产业紫外360 nm激光光源并附带拉曼探头, 显微镜头采用三丰100倍紫外长焦镜头, 光谱仪采用Ocean光谱仪(USB4000系列)属于小型光谱仪系列, 数据采用Python进行处理。 人血样本采集于上海中冶医院, 均采用PVE塑料离心管盛装。
常规拉曼探头测量人全血的实验: 样品通过PVE塑料离心管开盖式测量, 放置于距离拉曼探头的7 mm焦距处, 激光通过拉曼探头聚焦在人全血的表面, 并测量人全血的拉曼光谱信号。
毛细管显微拉曼测量人全血的实验: 采用移液枪将离心管内液体通过毛细管的虹吸效应注入毛细管内壁。 (虹吸现象是液态分子间引力与位能差所造成的, 即利用水柱压力差, 使水上升后再流到低处。 由於管口水面承受不同的大气压力, 水会由压力大的一边流向压力小的一边, 直到两边的大气压力相等, 容器内的水面变成相同的高度, 水就会停止流动。 )将注好的全血样本的毛细管通过夹具或者胶带固定于显微物镜焦点附近。 采用实验结构如图1所示。 光源由激发波长为360 nm的激光器提供, 由360 nm激光拉曼探头引出。 通过光学调整架将激光拉曼探头与显微物镜进行共轴调节, 并移动毛细管样品, 使得从激光拉曼探头中射出的激发光源通过显微物镜聚焦在毛细管样品内壁。 信号采集方式为180° 背散射检测, 拉曼信号沿激发光路逆方向接收, 并由激光拉曼探头的一分二光纤传回探测器CCD中。
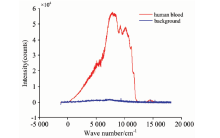
在基于毛细管人血液样本的显微拉曼光谱测量之前, 对空毛细管内壁内侧空气的拉曼光谱信号进行采集(焦点在玻璃内壁靠里的位置即空气中)并发现光谱信号较弱, 对血液光谱信号无较大影响, 利用暗背景进行扣除, 如图2所示。
从图2可以看出, 整个显微拉曼光谱原始图只有前半段为有效信号, 后半段均为抬高的荧光背景信号。 故而选取常见的500~1 800 cm-1范围内进行滤波去噪以及单独的基线校正处理。
1.3.1 信号滤波并重建
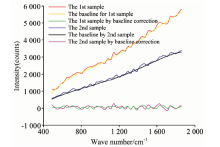
针对拉曼光谱图存在的噪音过大问题常见解决方案有小波变换滤波[7]、 最小均方滤波[8, 9]、 自适应噪声的完备经验模态分解(CEEMDAN)[10]等。 此处采用小波变换阈值滤波的方法。 采用离散型小波变换“ db5” 进行1层分解, 滤除其中的高频杂散信号, 得到如图3所示光谱, 但仍存在基线漂移现象, 需要采用基线校正。
1.3.2 基线校正
基于拉曼光谱信号的基线漂移, 常见方法有多项式拟合[11]、 线性拟合[12]、 最小二乘法多项式平滑[13]等方案。 此处采用多项式拟合方案对显微信号进行基线校正, 如图4所示。
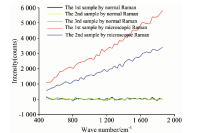
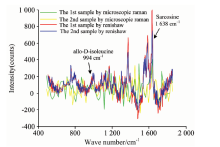
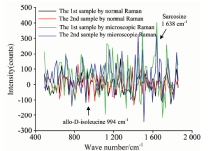
人全血的毛细管显微拉曼光谱实验验证如图5, 血液显微拉曼实验系统检测与renishaw共聚焦显微拉曼光谱仪检测毛细管内壁的人全血样本。 两者的拉曼光谱图都进行了关于小波变换“ db5” 的一层滤波去噪处理以及关于多项式拟合的基线校正处理。 其中毛细管显微拉曼测量人全血的拉曼光谱实验成功测量出人全血拉曼信号(如黄色信号线、 绿色信号线所示)和renishaw共聚焦光谱仪测量信号如红色信号线、 蓝色信号线所示), 通过对比验证结果, 该图数处确为人全血的拉曼光谱信号。
通过查询SDBS数据库发现多处为各类氨基酸信号, 如异亮氨酸(allo-D-isoleucine 994 cm-1)、 肌氨酸(sarcosine 1 638 cm-1)等。
由于人全血的毛细管显微拉曼光谱实验所测量的人全血含量与常规拉曼探头测量实验所测的人全血含量不尽相同, 无法根据两者拉曼光谱图强度进行对比分析, 只能从某一拉曼峰位的检出差别进行分析。 选取图5验证的异亮氨酸与肌氨酸拉曼峰位进行分析。 如图6所示, 人全血的毛细管显微拉曼光谱实验数据(如绿色信号线、 蓝色信号线所示), 常规拉曼探头测量实验数据(如黑色信号线、 褐色信号线所示)。 人全血的毛细管显微拉曼光谱实验较为明显的检测数是关于异亮氨酸(allo-D-isoleucine 994 cm-1)、 肌氨酸(sarcosine 1 638 cm-1)两个峰位的峰值信号, 而常规拉曼探头测量实验则无法检出肌氨酸峰位信号, 关于异亮氨酸的峰位信号则稍有痕迹, 但由于噪音过大, 无法准确判断。
实验于样品容器着手, 采用基于毛细管的显微拉曼实验分析人全血的拉曼信号。 血液样品通过毛细管装取, 与载波片装取相比具有模拟人血管、 维持血液活性、 缩减空气中的氧气对血液成分的降解作用、 降低激光对血液样品的灼伤效果等优势。 研究采用360 nm紫外激光器作为激发光源, 避开可见光部分荧光较强区域的干扰, 防止荧光信号淹没拉曼信号。 积分时间设为800 ms, 有效避免因激光长时间照射对血液样品的灼伤效果, 影响实验数据的稳定性与真实性。 平均次数为2次, 避免单次测量所带来的数据的不准确性影响。 光谱扫描范围为500~1 800 cm-1, 研究表明此范围内可避开可见光部分荧光较强区域的干扰, 且此范围为拉曼常用扫描谱段, 方便查询各类数据库光谱信号。 实验测得的光谱信号存在噪音过大、 基线漂移等现象, 此时的光谱信号需滤波去噪及基线校正等相应处理。 研究采用5阶离散小波变换滤波去噪, 进行1层信号分解, 滤除高频噪声信号, 保留低频有效信号, 从而去除杂散信号, 对光谱有效信号进行提取。 针对基线校正方面采用4阶多项式拟合扣除基底, 实现人全血的毛细管显微拉曼光谱峰值信号提取。 通过查询SDBS数据库发现测得信号中部分为人体内数种氨基酸成分的拉曼信号。 实验对比发现, 基于毛细管的显微拉曼实验系统与常规拉曼直测实验系统相比有良好的信号采集效果, 能够较为有效的测量出人全血的拉曼光谱信号, 而其与高精度的共聚焦显微拉曼系统相比存在价格便宜、 结构简单等优点, 是一种测量人全血信号的有效方法。 但由于未能实现共聚焦显微拉曼技术, 仅沿用了显微物镜系统, 故对信号的信噪比程度等仍有一定缺陷, 只能应用于粗检快检领域。 精密测量无法与高集成度的共聚焦显微拉曼光谱仪相比。 采用的光谱仪属于便携式光谱仪, 光谱分辨率仍有待提升。 另外在数据处理方面, 对噪声的滤除与基线的校正存在一定的提升空间。 相信通过对实验系统的优化升级, 结合有效的数据处理算法可得出一套简易人血样拉曼光谱有效检测手段。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|