作者简介: 吕 莉, 1992年生, 天津农学院动物科学与动物医学学院硕士研究生 E-mail: 1554155406@qq.com
探讨氢化物发生-原子荧光光谱法测定鸡蛋中硒含量的最佳仪器工作条件, 建立电热板混酸消解-氢化物发生-原子荧光光谱法检测硒含量的分析方法, 并通过检测市售乌鸡蛋、 土鸡蛋和普通鸡蛋中的硒含量, 以期为人们进行鸡蛋消费选择提供理论实践参考。 为提高原子荧光光谱法检测鸡蛋中硒含量方法的精确度和准确度, 试验分别对消解液的比例、 预还原剂的浓度选择、 硼氢化钾的浓度等反应条件进行比较分析, 并通过计算精密度、 回收率、 最低检出限等指标对该方法检测结果的可行性进行检验。 试验结果显示: 鸡蛋样品用体积比为1:1的浓硝酸与高氯酸的混合液消解过夜后, 放于200 ℃微控数显电热板上加热消解至透明清亮, 同时将电热板温度调至160 ℃, 当锥形瓶温度冷却至室温后, 再加入5 mL的6 mol·L-1的盐酸进行预还原反应, 再次将锥形瓶放在电热板上加热, 至溶液变透明清亮后取下, 冷却至室温后, 将锥形瓶内溶液转移置100 mL容量瓶中, 加入1.00 mL 10%铁氰化钾溶液, 用10%盐酸定容, 摇匀, 待测, 同时做样品空白对照。 将处理后的鸡蛋样品放在高性能空心阴极硒灯下, 以1.5%的硼氢化钾溶液为还原剂和2%盐酸溶液为载流液对鸡蛋样品进行连续测定。 在最佳消解条件和仪器工作状态下, 硒在0~8 μg·L-1的浓度范围内呈现良好的线性关系, 硒标准曲线方程式为 IF=114.19 C+1.30, 标准曲线相关系数为0.999 9, 最低检出限为0.01 μg·L-1, 相对标准偏差为0.07%~0.72%, 加标回收率为96.12%~99.1%。 建立了电热板混酸消解-氢化物发生-原子荧光光谱法准确测定鸡蛋中硒含量的方法, 该法具有简单易操作、 精密度高、 灵敏性高等优点, 并利用该法对普通鸡蛋、 土鸡蛋和乌鸡蛋中的硒含量进行了检测分析, 结果显示乌鸡蛋、 土鸡蛋和普通鸡蛋的硒含量分别为0.191, 0.195和0.141 mg·kg-1, 乌鸡蛋和土鸡蛋中的硒含量差异不显著( p>0.05), 但二者的硒含量均显著高于普通鸡蛋( p<0.05)。 该研究为禽蛋中硒含量的科学检测及人们进行鸡蛋消费选择提供了理论实践依据。
This paper mainly discussed the optimum conditions of hydride generation atomic fluorescence spectrometry (HG-AFS) for the determination of selenium content in eggs, then the analytical method for the determination of selenium content by mixed acid digestion hydride generation atomic fluorescence spectrometry was established, and through testing the selenium content of ordinary eggs, native eggs and dark eggs, we hoped to provide a theoretical and practical reference for people to choose eggs. In order to improve the precision and accuracy of the method to detect the selenium content in eggs by atomic fluorescence spectrometry, the mixed acid ratio, prereducing agent concentration and KBH4 concentration were compared and analyzed, and the feasibility of test result was detected by calculating the precision, recovery rate and the minimum detection limit. The results showed that the samples were dissolved overnight after the mixture of concentrated nitric acid and perchloric acid with a volume ratio of 1:1, then heated to clear on the micro control digital display electric heating plate at 200 degrees, then the temperature of the electric heating plate was adjusted to 160 degrees, after the conical bottle temperature was cooled to room temperature, 5 mL of 6 mol·L-1 HCl was added. The conical bottle was heated on the electric heating plate again, and removed after the solution was clear. After cooled to the room temperature, the conical bottle solution was transferred to 100 mL capacity bottle, and 1 mL 10% potassium ferricyanide solution was added, and 10% hydrochloric acid was used to shake and be measured at the same time, and the sample blank control was made at the same time. The analytes were detected by a high-performance hollow cathode selenium lamp with a deoxidizer of 1.5% KBH4 solution and the carrier fluid of 2% HCl. At the same time, the different reasons of selenium content between varieties of eggs were discussed. Under the optimum conditions and the working state, the selenium contents showed a good linear relationship in the concentration range from 0 to 8 g·L-1, and the standard curve equation of selenium is IF=114.19 C+1.30, and the correlation coefficient of the standard curve was 0.999 9, and the minimum detection limit was 0.01 μg·L-1, and the relative standard deviation was 0.07%~0.72%, and added standard recovery was 96.12%~99.1%. The optimum conditions of hydride generation atomic fluorescence spectrometry (HG-AFS) for the determination of selenium content in eggs were established, and the method is simple and easy to operate, with high precision and sensitivity. Using the method to test selenium content of ordinary eggs, native eggs and dark eggs, the results showed that the selenium content of dark eggs, native eggs and ordinary eggs were 0.191, 0.195, 0.141 mg·kg-1, respectively. The selenium content of dark eggs was not significant than that of native eggs ( p>0.05), but the selenium content of dark eggs and native eggs were significantly higher than that of ordinary eggs ( p<0.05). This study provides a theoretical basis for the scientific detection of selenium content in eggs and people’s choice.
硒是动物体内所必需的微量元素之一, 是谷胱甘肽过氧化物酶(GSH-Px)的重要组成部分, 适量的硒能提高机体的抗氧化能力和免疫功能, 改善动物的生产性能、 保护视觉及解毒等[1, 2]。 当人体缺硒时, 将会引起克山病、 大骨节病及甲状腺肿大等多种地方性疾病; 相反, 摄入过量的硒也会导致机体硒中毒。 中国营养学会调查结果显示, 我国居民硒摄入量普遍较低, 约26 μ g· d-1, 不能满足居民自身的生理需求[3]。 因此, 建立硒含量的测定方法及准确地检测食品中的硒含量, 对动物和人体健康都具有重要意义。
检测硒含量常用的方法有多种, Yang等应用微波消解-石墨炉原子吸收光谱法检测了大米中的硒含量[4], Wang等研究了电感耦合等离子体质谱法(ICP-MS)测定了土壤中的硒含量[5], Wang等采用高效液相色谱-电感耦合等离子体质谱(HPLC-ICP-MS)检测了食物中不同形态的硒元素[6], Wang等使用氢化物发生-电感耦合等离子体原子发射光谱法(HG-ICP-AES)测定了血样中的硒含量[7], Li等采用氢化物发生-原子荧光光谱法(HG-AFS)检测了铜精矿中的硒含量[8]。 上述研究均对样品中的硒含量进行了较好地检测。 但是, 采用HPLC-ICP-MS或HG-ICP-AES检测硒含量时, 其所使用的仪器价格及维修费用非常昂贵, 较难在一般实验室普及和推广。 而HG-AFS在食品、 环境和地质样品检测中常被广泛应用, 其操作方法简单易行, 灵敏度高, 结果准确, 且仪器价格及维修费用亦低于HPLC-ICP-MS和HG-ICP-AES。 目前, 有关利用氢化物发生-原子荧光光谱法检测鸡蛋中硒含量的研究鲜有报道, 本文建立了电热板混酸消解-氢化物发生-原子荧光光谱法检测鸡蛋中硒含量的分析方法, 并对三种鸡蛋中的硒含量进行比较研究, 以期为建立氢化物发生-原子荧光光谱法检测鸡蛋中硒含量的方法及人们进行鸡蛋消费选择提供理论实践参考。
PF6-2非色散原子荧光光度计(北京普析通用仪器有限责任公司), 高性能空心阴极硒灯(北京有色金属研究总院)。 仪器经反复调试并确定了最佳参数(表1)。
| 表1 PF6-2仪器参数的优化 Table 1 Optimized instrument parameters for PF6-2 |
微控数显电热板(北京莱伯泰科仪器股份有限公司); 电子分析天平(FB223, 上海舜宁恒平科学仪器有限公司); 电热恒温鼓风干燥箱(DHG-9246A, 上海精宏实验设备有限公司); 超纯水(天津农学院兽医实验室自制); 硒标准储备液(100 μ g· mL-1, 中国计量科学研究院); 硼氢化钾(KBH4)和KOH(博欧特化工贸易有限公司)均为分析纯; HClO4, HNO3和HCl(天津市风船化学试剂科技有限公司生产)均为优级纯, 试验所用试剂的配制方法如下:
硒标准溶液(10 μ g· L-1): 将硒标准储备液逐级稀释至0.1 μ g· mL-1的硒标准中间液, 分别移取10 mL硒标准中间液和浓盐酸, 移入100 mL的容量瓶中, 然后用超纯水定容。
1.5% KBH4还原剂: 称取2.5 g KOH置于烧杯中, 用超纯水溶解, 待KOH完全溶解后, 移置500 mL容量瓶中, 用超纯水定容; 再称取7.5 g KBH4置于烧杯中, 用KOH溶液溶解, 待KBH4完全溶解后, 移置500 mL容量瓶中, 用超纯水定容。
2% HCl载液: 量取26.8 mL浓HCl, 缓慢加入盛有200 mL超纯水的容量瓶中, 然后用超纯水定容至500 mL。
以上试剂均需现用现配。
从天津某大型超市中购买3种鲜鸡蛋(普通鸡蛋、 土鸡蛋和乌鸡蛋), 每种鸡蛋随机选取40枚, 共120份样品作为试验材料, 对鸡蛋样品中的硒含量进行测定。
鸡蛋蛋清与蛋黄混合均匀后, 准确称取鸡蛋混合样品1.0 g, 置于250 mL锥形瓶中, 依次加入10 mL混合酸(
采用SPSS 17.0软件对所有数据进行统计分析, 用单因子方差分析(one-way ANOVE, LSD)进行均值间多重比较, 并进行显著性检验, p< 0.05为差异显著, 所有测定结果均以平均数± 标准误差表示。
将10 μ g· L-1硒标准溶液加入PF6-2非色散原子荧光光度计中, 仪器自动将硒标准溶液稀释成0, 1, 2, 4和8 ng· mL-1。 依据其荧光强度, 以硒浓度为横坐标, 原子荧光强度为纵坐标, 绘制出标准曲线。 如图1所示, 标准曲线方程式为IF=114.19C+1.30, 相关系数r=0.999 9。
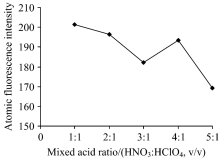
2.2.1 消解液的选择
由图2可知, 硒元素的荧光强度随着混合酸体积比的改变而变化。 在电热板消解过程中, 随着混合酸中HClO4体积的增加, 锥形瓶内溶液逐渐变为澄清透亮。 当消解液中HNO3与HClO4的体积比为1: 1时, 所测硒含量浓度与硒标准中间液浓度基本一致, 表明硒元素的回收率比其他比例混合酸的效果更好。 因此, 试验选用
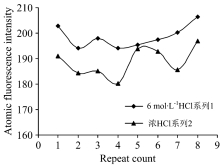
2.2.2 预还原剂的选择
由图3可知, 当预还原剂为浓HCl时, 测出的硒元素荧光强度稳定性较差, 而且硒含量比硒标准中间液的浓度较低, 回收率较差; 当用6 mol· L-1的HCl作为预还原剂时, 测出的硒元素荧光强度稳定, 且硒含量与硒标准中间液浓度基本一致, 回收率好。 因此, 该试验选用6 mol· L-1的HCl作为预还原剂。
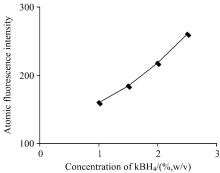
2.2.3 硼氢化钾的选择
由图4可知, 当KBH4浓度较低时, 测出的硒元素荧光强度较低, 硒含量比硒标准中间液的浓度低, 回收率较低; 相反, 当KBH4浓度较大时, 检测的硒浓度超出硒标准中间液的浓度, 试验误差较大, 易导致检测结果不准确。 当KBH4的浓度为1.5%(体积比)时, 测出的硒元素荧光强度效果好。 同时为了提高样品溶液的稳定性, 试验选用1.5%KBH4和0.5% KOH的混合溶液。
2.2.4 精密度和回收率
在同一鸡蛋样品中, 加入硒标准中间液的浓度分别为10.00, 20.00和30.00 μ g· L-1, 按照优化后的试验条件对同一样品平行测定8次, 测定结果见表2。 由表2可知, 样品加标回收率范围为96.12%~99.1%, 相对标准偏差(RSD)均小于5%, 表明使用此方法检测鸡蛋中的硒含量有较好的精密度和回收率。
| 表2 精密度和回收率 Table 2 Analytical for precision and recovery |
2.2.5 最低检出限
将仪器的各项参数调试至最佳状态, 对标准空白溶液连续测定15次, 取其中11次的数值计算标准偏差(SD), 仪器按照3倍标准空白溶液的标准偏差除以标准曲线的斜率, 计算出最低检出限(DL)为0.01 μ g· L-1。
由表3可知, 三种鸡蛋中的硒含量由多到少依次为: 土鸡蛋> 乌鸡蛋> 普通鸡蛋。 土鸡蛋和乌鸡蛋中的硒含量均显著高于普通鸡蛋中的硒含量(p< 0.05), 而土鸡蛋与乌鸡蛋之间的硒含量差异不显著(p> 0.05)。
| 表3 三种鸡蛋中硒含量的比较 Table 3 Selenium content in three kinds of eggs |
在消解过程中, 应根据试验样品数量、 最低检出限和结果准确性等要求选择适当的消解方法。 对试验样品进行消解的常用方法有电热板消解法、 高压罐加热消解法、 微波消解法、 干灰化法、 蒸馏消解法等[9], 由于本试验样品数量较多, 因此采用了电热板消解法。 试验中采用混合酸体系消解鸡蛋样品, 能加速破坏鸡蛋样品中的有机物, 但试验过程中也要严格控制电热板的温度, 避免在加热过程中硒元素形成氢化物而逸出, 从而造成硒的损失。 本试验采用混合比例(体积比)为1: 1的HNO3-HClO4体系对鸡蛋样品进行消解, 这与Liu等[10]采用体积比为2: 1的HNO3-HClO4体系测定鸡蛋中的硒含量相比, 硒元素检出范围相同, 但采用体积比为1: 1的HNO3-HClO4体系对鸡蛋样品进行消解时, 其氧化能力和反应速率均有所提升, 液体更加澄亮透明, 其对荧光强度的影响较小。
鸡蛋样品中的硒元素经HNO3-HClO4体系消解后转变成Se6+, Se6+不能直接与KBH4溶液反应[11], 只有将Se6+还原成Se4+, 然后Se4+被KBH4溶液还原成Se2+才能进行硒元素检测。 如果Se6+不能完全被还原成Se4+, 鸡蛋样品中的硒含量检测结果将会偏低。 因此, 进行预还原剂的选择尤为重要。 研究结果表明, 相比于浓HCl而言, 6 mol· L-1的HCl作为预还原剂使用时, 检测出鸡蛋样品中的硒元素荧光强度更稳定, 且硒含量与硒标准中间液浓度基本一致, 鸡蛋样品的回收率更高。 因此, 本试验选用6 mol· L-1的HCl作为预还原剂。
KBH4作为还原剂和氢气的来源, 其用量直接影响氢化物生成的速率和氩氢焰的质量[12]。 硒元素荧光强度随KBH4浓度的改变而变化, 当浓度较低时, 其还原能力差, 从而导致检测结果偏低; 当浓度较高时, 则会产生大量的氢气而对试验检测产生干扰。 总之, KBH4的浓度偏高或偏低均会使灵敏度降低。 试验结果显示, 当KBH4浓度为1.5%时, 其硒元素荧光强度检测结果最好。 同时为了提高样品溶液的稳定性, 本试验选用1.5%的KBH4和0.5%的KOH的混合溶液作为还原剂。
在生物体内, 微量元素可以通过与蛋白质及其他有机基团的结合, 形成酶、 激素、 活性肽等活性生物分子, 进而发挥代谢调节作用, 硒元素作为一种重要的微量元素在生物体内发挥着重要生理功能。 鸡蛋中的微量元素含量与蛋鸡所摄取的饲料状况有密切关系, Mabe等研究表明, 鸡蛋中微量元素的积累与饲粮中微量元素含量及比例直接相关[13]。 另外, Chen等研究也证明, 蛋鸡饲粮中添加有机硒能够显著提高鸡蛋中的硒含量, 并且鸡蛋中的硒含量与饲料中的有机硒添加量成正比[14]。 研究结果表明, 乌鸡蛋、 土鸡蛋和普通鸡蛋的硒含量分别为0.191, 0.195和0.141 mg· kg-1, 乌鸡蛋和土鸡蛋中的硒含量差异不显著(p> 0.05), 但二者的硒含量均显著高于普通鸡蛋(p< 0.05), 出现这种结果的原因可能是: 鸡的品种、 饲养方式、 生长环境及日粮营养组成等方面的差异最终导致了鸡蛋中硒含量沉积的不同。
建立了电热板混酸消解-氢化物发生-原子荧光光谱法准确测定鸡蛋中硒含量的方法, 该法简单易操作、 精密度高、 灵敏性强, 并利用该法对普通鸡蛋、 土鸡蛋和乌鸡蛋中的硒含量进行了检测分析。 结果显示, 土鸡蛋和乌鸡蛋中的硒含量显著高于普通鸡蛋, 也为人们进行鸡蛋消费选择提供了理论参考。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|