作者简介: 彭程佳, 1990年生, 鞍山师范学院化学与生命科学学院本科生 E-mail: 1667277850@qq.com
合成了配合物[Ni(2,2'-biby)(H2O)4]·(Htba)2·5H2O单晶, 分子式中2,2'-biby为2,2'-联吡啶, H2tba为2-硫代巴比妥酸。 通过红外光谱、 元素分析和单晶X-射线衍射表征其结构, 单晶X-射线衍射结果表明, 该配合物单晶属于正交晶系, Pbca 空间群, 晶胞参数为 a=13.662(2) Å, b=19.470(4) Å, c=21.590(4) Å。 应用紫外光谱和荧光光谱研究了其与鲱鱼精DNA/牛血清白蛋白(BSA)的相互作用, 研究结果表明, 标题化合物与DNA为静电结合, 对牛血清白蛋白发生静态猝灭作用。
A Ni(Ⅱ) coordination complex [Ni(2,2'-biby) (H2O)4]·(tba)2·5H2O(2,2'-biby=2,2'-dipyridine, H2tba=2-thiobarbituric acid ) has been synthesized and structurally characterized by IR, element analysis and single crystal X-ray diffractometry. The results of single crystal X-ray diffractometry displayed that the title compound belongs to orthorhombic with space group of Pbca, and its cell parameters are a=13.662(2) Å, b=19.470(4) Å, c=21.590(4) Å . The binding of title compound with Herring sperm DNA/BSA has been investigated by absorption and fluorescence spectra, and the results displayed that the title compound binds with DNA in electrostatic interaction mode, and quenches the intrinsic fluorescence of BSA by a static quenching mechanism.
DNA是重要的基因遗传物质, 控制着蛋白质合成、 细胞分裂和器官生长等生命过程, 同时也是抗肿瘤药物的主要靶标分子之一, 小分子与DNA相互作用方式主要分为共价键合和非共价结合两种作用模式, 其中非共价键合又分为嵌插作用、 静电结合和沟内结合等[1, 2, 3]。 小分子化合物与DNA相互作用研究对发现高效低毒抗肿瘤药物和DNA的结构探针分子具有重要的科学意义, 并且为从分子水平上解释抗癌药物的作用机理提供重要理论依据。 顺铂(顺式二氯二氨合铂)是无机类抗肿瘤药物的里程碑式化疗药物, 其作用机理是与DNA的鸟嘌呤碱基N7发生共价键合, 形成1, 2-链内交叉的加合物, 改变了DNA的构型, 阻止了癌细胞转录和复制, 从而发挥了其抗癌活性[4, 5]。 为解决顺铂的肾毒性、 癌细胞耐药性等毒副作用而研发成功的卡铂、 奥沙利铂和洛铂等铂类抗癌药物, 都是在DNA共价键合的相似作用机理基础上对顺铂在结构上进行修饰, 从而降低了顺铂某些方面的毒副作用。
2, 2'-联吡啶是经典的螯合配体, 2-巯基巴比妥酸及其衍生物是重要的医药中间体, 部分化合物具有抗肿瘤、 抗菌等生物活性, 同时它含有的巯基、 嘧啶和羟基基团能与过渡金属离子和稀土金属离子形成丰富多样的配位模式[6, 7, 8], 另外, 2-巯基巴比妥酸在结构上与DNA的碱基对具有相似性, 使其在生物化学研究中具有了特殊意义。 本研究以2, 2'-联吡啶和2-巯基巴比妥酸为配体与硫酸镍反应, 成功合成了镍配合物单晶, 应用红外光谱、 元素分析和X-射线单晶衍射表征了化合物结构, 采用吸收光谱和荧光光谱研究了其与鱼精DNA和牛血清白蛋白(BSA)的作用模式, 研究结果表明标题化合物与DNA发生静电作用, 对牛血清白蛋白具有静态猝灭作用。
六水硫酸镍(
IR-470傅里叶变换红外光谱仪(
在搅拌状态下, 向20 mL 0.1 mol· L-1的2-巯基巴比妥酸水溶液中逐滴加入0.1 mol· L-1的硫酸镍水溶液10 mL, 再向混合液中滴加0.1 mol· L-1的2, 2'-联吡啶的乙醇溶液10 mL, 用氢氧化钠溶液调节pH为5.0, 滴加完成后反应30 min。 过滤静止2周后有粉色块状晶体析出。 IR检测(KBr, cm-1): 3 072 (
挑选尺寸为0.2 mm× 0.2 mm× 0.2 mm大小的晶体置于单晶衍射仪上, 在296.15 K温度下, 经石墨单色器纯化后的Mo-Kα (λ =0.710 73)射线进行衍射实验, 共收集33 255个衍射点, 其中独立衍射点为6 603个(Rint=0.092 3), 衍射数据经LP吸收校正后, 使用OLEX 1.2和SHELXTL软件解析晶体结构[9, 10]。 标题配合物的晶体学数据列于表1, 主要键长键角见表2。 CCDC: 1581679。
| 表1 配合物的晶体学数据 Table 1 Crystal data and refinement for [Ni(2, 2'-biby)(H2O)4]· (Htba)2· 5H2O |
| 表2 配合物的部分键长和键角 Table 2 Selected bond distances (Å ) and bond angles (° ) for [Ni(2, 2'-biby)(H2O)4]· (Htba)2· 5H2O |
1.4.1 紫外-可见吸收光谱测定
向比色皿参比池和样品池中分别加入等体积的Tris-HCl缓冲液(tris浓度为5 mmol· L-1, NaCl浓度为50 mmol· L-1)和配合物溶液, 依次用等量的DNA的溶液加入参比溶液和样品溶液中, 反应30 min后, 在200~400 nm进行紫外光谱扫描。
1.4.2 荧光猝灭测定
向比色皿中加入3 mL EB-DNA溶液, 依次加入等量的配合物溶液, 反应30 min后, 以525 nm作为激发波长, 扫描550~700 nm的荧光光谱。
1.5.1 BSA荧光猝灭滴定
将BSA溶于Tris-HCl缓冲液(tris浓度为5 mmol· L-1, NaCl浓度为50 mmol· L-1)中配置成1.5 mmol· L-1的溶液, 取0.2 mL BSA溶液、 一定量的配合物溶液并用Tris-HCl缓冲液定容为10 mL (BSA的浓度为30 μ mol· L-1), 以295 nm波长为激发波长, 扫描300~500 nm的荧光发射光谱。
1.5.2 BSA紫外光谱滴定
取10 μ L BSA溶液、 一定量的配合物溶液并用Tris-HCl缓冲液定容为10 mL (BSA的浓度为15 μ mol· L-1), 以Tris-HCl缓冲液为参比溶液, 在200~350 nm之间进行紫外光谱扫描。
如图1, X-射线单晶衍射结果表明, 标题配合物单晶为正交晶系, Pbca空间群, 在一个非对称单元中存在一个二价阳离子配合物[Ni(2, 2'-biby)(H2O)4]和2个一价2-巯基巴比妥酸配体结晶以及5个结晶水。 镍中心离子与2个来自于一个2, 2'-联吡啶的N原子及4个配位水分子的氧原子配位, 形成了一个六配位八面体构型。 Ni(1)-N(5)和Ni(1)-N(6)的键长分别为2.078(4)和2.083(4) Å , Ni— O键长在2.048(3)和2.073(3) Å 之间, 这与文献[11]报道的镍配位化合物中Ni— N键长和Ni— O键长相近。 2-巯基巴比妥酸脱质子化后并未参与配位, 但在形成三维超分子结构中起到重要作用, 其嘧啶环与2, 2'-联吡啶的吡啶环形成较强的芳环堆积作用(
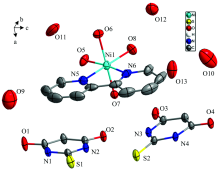 | 图1 配合物中Ni(Ⅱ )离子的配位环境Fig.1 The coordination environment of Ni(Ⅱ ) ions in compound [Ni(2, 2'-biby)(H2O)4]· (Htba)2· 5H2O |
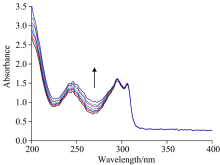
鱼精DNA是一种具有A-DNA特点的DNA, 并有深且窄的大沟和浅且宽的小沟, 廉价易得而广泛应用于小分子金属配合物与DNA的相互作用。 紫外-可见吸收光谱是研究小分子化合物与DNA相互作用模式和强度的最方便和最有效的方法之一[13]。 过渡金属配合物的紫外吸收光谱是分子中电子在不同能级分子轨道间跃迁而产生的光谱, 依据电子跃迁的机理, 可将过渡金属配合物的电子光谱分为配体内部电子跃迁光谱、 配体向金属离子或金属离子向配体的电子跃迁光谱和金属离子d轨道间跃迁光谱。 当配合物溶液中加入DNA后, 若配合物与DNA发生相互作用, 其电子跃迁的能级和跃迁能发生变化, 配合物的特征吸收谱带发生红移或蓝移, 同时伴随减色或增色现象。 一般认为, 配合物与DNA发生嵌插作用时, 其紫外吸收峰发生减色和红移效应, 而若配合物与DNA发生静电作用时, 该配合物的吸收峰红移幅度很小, 同时发生明显的增色现象[14, 15]。 如图3所示, 配合物紫外光谱中245 nm的紫外吸收峰应为2, 2'-联吡啶配体内π — π * 轨道的跃迁, 而293和310 nm的吸收峰应归属于2, 2'-联吡啶配体到镍离子的有机配体向金属的电子跃迁。 随着DNA的加入, 配合物的紫外吸收峰发生明显增色效应, 说明配合物与DNA的作用模式有可能为静电结合作用[16, 17]。
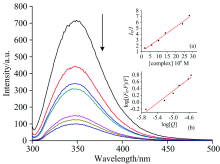
溴化乙锭(EB)是能与DNA发生嵌插作用的染料分子, 其自身的水溶液荧光强度很弱, 但当插入DNA碱基后, 由于DNA内部疏水作用致使其荧光大幅度增强。 当DNA-EB体系中加入能够与溴化乙锭竞争插入DNA碱基对的小分子后, 溴化乙锭分子被置换出来, DNA-EB体系发生荧光猝灭, 猝灭程度的大小可以解释小分子与DNA作用模式。 如图4(a)所示, DNA-EB体系在525 nm光激发下在602nm有较强的荧光发射, 但随着标题化合物的加入, 荧光强度逐渐猝灭, 当配合物浓度达到4.0 μ mol· L-1时, 荧光强度猝灭达到18%。 根据Stern-Volmer方程, F0/F=Kq[Q]+1, 式中F0为未加入猝灭剂时荧光强度, F为加入猝灭剂时荧光强度, Q为猝灭剂浓度, Kq为荧光猝灭常数。 以F0/F为纵坐标, Q的浓度为横坐标作图, 如图4(b)所示, 可得Kq为5.4× 103, 该猝灭常数低于与DNA插入作用的分子的猝灭常数[14], 与DNA静电作用的化合物的猝灭常数相近[18], 结合紫外光谱研究结果, 标题化合物与DNA作用模式应为静电作用, 从分子结构上分析该化合物为阳离子型配合物, 非常容易与DNA表面的丰富的负电性的磷酸根发生静电作用。
血清白蛋白在药物在人体内的运输、 存储和释放等过程中发挥关键性作用, 药物小分子与白蛋白的相互作用影响药物的靶向性目标扩散能力和人体内药物的利用率, 因而, 小分子化合物与血清白蛋白相互作用研究对药物设计、 开发具有重要的意义。 由于BSA与人血清白蛋白在结构和组成具有高度的相似性, 而广泛用于药物的研究和开发。 BSA因含有的酪氨酸、 色氨酸和苯丙氨酸等氨基酸残基使其具有内源性荧光发射性质, 如图5所示, 在激发波长295 nm的条件, 固定浓度30× 10-5 mol· L-1 的BSA在349 nm处具有较强的荧光发射, 在保持BSA浓度不变的体系中逐渐增加标题化合物浓度, 其荧光强度逐渐降低, 说明标题化合物与BSA发生了相互作用。 为了研究标题化合物猝灭BSA荧光的机理, 我们依据Stern-Volmer方程[19]: F0/F=1+KSV[Q]=1+Kqτ 0[Q]计算了标题化合物与BSA相互作用的能力, 式中F0和F分别为加入配合物前后体系的荧光强度, [Q]为配合物的摩尔浓度, KSV为Stern-Volmer常数, Kq为猝灭速率常数, τ 0为未加入标题化合物时体系的荧光寿命, 其值为10-8 s。 以[Q]为横坐标, F0/F为纵坐标作图, 其拟合直线的斜率即为KSV值, 进而可计算得Kq值, 经计算得KSV值和Kq值分别为2.11× 105和2.11× 1013, 标题化合物荧光猝灭速率常数Kq值远远大于2.0× 1010, 说明其对BSA荧光猝灭为静态猝灭, 在配合物与BSA相互作用过程中配合物与BSA的氨基酸残基发生了共价键合作用[20]。 为进一步研究标题化合物与BSA的结合常数和结合位点, 应用Scatchard方程[21] lg(F0-F)/F=lgK+nlg[Q], 式中F0和F分别为加入配合物前后体系的荧光强度, [Q]为配合物的摩尔浓度, K为结合常数, n为结合位点数, 以lg(F0-F)/F对lg[Q]作图, 斜率即为n, 由截距可以求得K。 经计算可知, 标题配合物与BSA的结合常数为6.02× 104, 结合位点数为0.89, 说明标题化合物与BSA只有一个键合点[20]。 此外, 通过紫外可见吸收光谱, 观察BSA加入配合物前后其紫外吸收峰的变化, 如图6所示, 当加入标题化合物后BSA在278 nm的紫外峰发生增色, 说明配合物与BSA发生反应生成了基态复合物, 进一步证明了配合物静态猝灭BSA的机理。
采用溶液挥发法成功合成了镍(Ⅱ )配合物单晶, 经红外光谱、 元素分析和单晶X-射线技术表征了化合物结构, 应用紫外光谱和荧光光谱从分子水平研究了标题化合物与鱼精DNA/BSA的相互作用, 结果表明标题化合物与DNA静电结合并且对BSA具有静态猝灭的作用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|