作者简介: 陈 繁, 1996年生, 北京工商大学计算机与信息工程学院硕士研究生 E-mail: chen_cfbtbu@163.com
蜂王浆是一种具有抗氧化、 抗衰老、 调节心血管系统和免疫功能的纯天然营养保健食品, 近年来在食品、 生物医学等领域广泛应用。 由于蜂王浆的采集过程费时费力且没有快捷简便的方法检测其品质, 使得市场上的蜂王浆产品质量参差不齐, 因此实现蜂王浆品质的快速鉴别就显得至关重要。 该研究以蜂王浆的水分和蛋白质为研究对象, 利用拉曼光谱技术结合主成分回归算法(
Royal jelly is a natural nutrient health food that has antioxidant, anti-aging, regulate cardiovascular system and immune function. In recent years, royal jelly has been widely applied in food, biomedicine and other fields. Because the collection process of royal jelly is time-consuming and the quality of the royal jelly is difficult to detect and the quality of royal jelly is uneven in the market. It is very important to realize the rapid identification of the quality of royal jelly. Therefore, the content of two components of moisture and protein on the quality of royal jelly is explored in this paper, and the quantitative analysis model of principal component regression (
众所周知, 蜂王浆是一种具有抗氧化、 抗衰老和调节心血管系统等功能的纯天然营养保健食品[1], 但采集蜂王浆的过程却十分复杂费力, 需要经过割蜡、 夹出王浆虫、 挖浆再移虫等步骤且这些流程都需要人工操作, 产量十分有限。 而近年来, 蜂王浆已被科研、 食品、 生物医学等领域广泛应用。 据统计, 我国的蜂王浆大约3 000多吨的年产量且占世界蜂王浆总产量的90%以上。 日趋成熟的产浆技术促进了我国蜂王浆产业的不断发展和养蜂业的不断壮大[2]。 由于没有一个快速检测蜂王浆品质的方法, 造成了其品质的参差不齐, 因此实现蜂王浆品质的快速鉴别就显得尤为重要。
贮藏温度和时间是影响蜂王浆品质的主要因素, 温度过高或贮藏时间过长都会导致其物理性状和化学成分发生变化。 当长时间在室温下贮藏时, 蜂王浆将失去活性[3]。 蛋白质含量的高低是评价蜂王浆品质的重要指标之一, 贮藏过程中温度的升高会导致蜂王浆蛋白质发生不同程度的降解, 从而引起褐变导致其生理活性功能降低[4]。 吴黎明等利用傅里叶变换红外光谱对蜂王浆的新鲜度、 品质和功效进行了检测, 并且探究了利用FTIR(Fourier transform infrared spectroscopy)光谱法分析王浆红外谱图的相关性, 研究结果表明王浆组分发生的变化, 蛋白质可能占据了主导地位, 由此可以快速分析出蜂王浆的品质[5]。 故蜂王浆的品质在某种程度上能由水分、 蛋白质等指标体现出来并对其质量进行规范监控。
近年来, 拉曼光谱在食品工业领域的应用越来越广泛, Abbas等利用拉曼光谱并结合主成分分析法(principal component analysis, PCA)和偏最小二乘判别分析法(partial least squares discrimination analysis, PLS-DA)来鉴别不同种类的动物油脂, 鉴别效果理想[6]。 Bruno等建立了大豆油中共轭亚油酸的定量分析模型, 相关系数R2达到了0.97, 实验结果理想[7]。 Stefanov等利用拉曼光谱结合偏最小二乘法(partial least squares method, PLS)测定牛奶中支链脂肪酸, 相关系数大于0.65[8]。 说明利用拉曼光谱建立食品的定量模型来检测其组分含量是可行的。 我国对各类食品中所含蛋白质、 脂质、 水分、 碳水化合物和其他微量元素有一定的定量检测研究, 但在蜂王浆品质检测方面的研究还很欠缺。
为解决国标法检测蜂王浆中水分、 蛋白质等组分含量费时费力等问题, 本文就水分、 蛋白质两种组分含量对蜂王浆的品质进行探究, 基于拉曼光谱分析技术建立其快速检测定量人分析模型[9, 10, 11, 12], 旨在寻找鉴别蜂王浆品质的最优定量模型。 本实验证明了采用拉曼光谱技术结合主成分回归法(principle component regression, PCR)和PLS建立蜂王浆水分和蛋白质的定量模型, 用于蜂王浆样品水分、 蛋白质含量的快速无损检测是可行的。
40份来自四川、 青海、 湖北的油菜浆样品。
DXR激光共焦显微拉曼光谱仪, 美国Thermo Fisher公司; 自动定氮仪, 瑞士BUCHI公司; 数显真空干燥箱, 上海浦东荣丰公司。
水分含量参照GB 9697— 2008《蜂王浆》国家标准规定的检验方法进行测定, 采用7 5℃减压干燥法。
蛋白质含量的测定同样按照GB 9697— 2008国家标准采用凯氏定氮法, 将40份样品逐一取样, 然后放入消化炉进行消化, 将消化后的样品利用全自动定氮仪定氮即得样品蛋白质的含量。
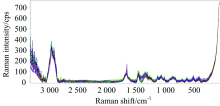
取蜂王浆样品约0.05 g, 均匀涂抹在玻璃载物片上, 用DXR激光共焦显微拉曼光谱仪采集样品光谱信号。 共焦显微拉曼光谱仪检测时激光波长780 nm; 激光功率20 mW; 检测精度1 cm-1; 谱图宽度65~3 350 cm-1; 扫描次数16次; 采集曝光时间3 s, 样品温度为室温。 在建立蜂王浆组分定量模型时, 其水分含量可通过测量O— H基团的谱带强度来测得, 谱带3 200~3 400 cm-1为O— H基团的拉曼特征谱带。 蜂王浆蛋白质含量则通过测量酰胺Ⅰ 谱带中C=O基团和酰胺Ⅲ 谱带中N— H基团的拉曼光谱强度获得, 酰胺Ⅰ 和酰胺Ⅲ 谱带为拉曼光谱中的强谱带, 其谱带范围分别为1 640~1 670和1 240~1 300 cm-1[13]。 图1所示为经过基线校正后的蜂王浆样品的拉曼光谱图。
应用TQ Analyst分析软件进行光谱预处理及定量模型的建立。 其中光谱预处理方法包括导数、 标准正态变换(
主成分回归法是一种在主成分分析法基础上发展起来的多元校正分析方法, 由主成分分析法将矩阵分解降维, 再对降维的矩阵进行线性回归分析来对样品进行预测[14, 15]。 利用PCA可以解决共线的问题, 还可消弱误差所产生的影响。 TQ analyst软件中Standards窗口包含有验证(Validation)样品, 进行校正时软件会自动计算出RMSEP。 本实验用于建立校正模型的样品集包含样品30份; 用于检验模型预测能力的验证集包含样品10份。 基于PCR的蜂王浆水分、 蛋白质含量在导数、 SNV、 MSC、 SG卷积平滑四种不同组合的预处理法下的校正集决定系数R2及均方根误差RMSEC、 预测集相关系数r2及均方根误差RMSEP如表1所示。
| 表1 不同组合预处理方法的定量模型结果对比(水分) Table 1 Comparison of quantitative model results for different combination pretreatment methods (Moisture) |
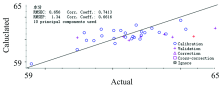
从表1的水分PCR定量分析模型的结果可以看出, 各预处理组合的数据均不理想, 相较之下PCR最优光谱处理方法是Savitsky-Golay平滑(
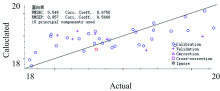
建立蛋白质的PCR定量模型, 将多种预处理组合处理结果进行对比, Savitsky-Golay平滑(7)处理相较之下最优, 校正集决定系数0.675 0, 预测集决定系数为0.566 8, RMSEC为0.548, RMSEP为0.957, 建模效果差。 图3为蛋白质PCR定量模型的建模效果图。
PLS是光谱多元定量校正的一种经典建模方法, 同时分解光谱矩阵和浓度矩阵, 考虑两者的相互关系再建立线性回归方程, 从而保证构建精度较高的模型[16, 17]。 模型性能采用校正集决定系数R2及校正均方根误差RMSEC和预测集决定系数r2及预测集均方根误差RMSEP, 结果如表2所示。 本实验用于建立校正模型的样品集包含样品30份; 用于检验模型预测能力的验证集包含样品10份。
| 表2 不同组合预处理方法的定量模型结果对比(水分) Table 2 Comparison of quantitative model results for different combination pretreatment methods (Moisture) |
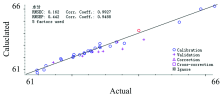
通过对表2中数据进行对比分析, 可以得出, 蜂王浆样品中水分含量的基于PLS的最优光谱预处理方法是S-G(7)+二阶导数+SNV处理。 校正集决定系数0.992 7, 预测集决定系数为0.948 8, RMSEC为0.162, RMSEP为0.442, 建模效果好, 预测效果良好。
采用偏最小二乘法进行S-G(7)+二阶导数+SNV处理, 得到的各验证集水分含量的真实值与预测值之间的关系如图4所示。
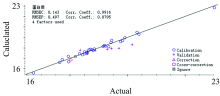
建立蛋白质的PLS定量模型, 通过对多种预处理组合处理结果进行对比, S-G(7)+一阶导数+SNV处理可得到最优光谱, 校正集决定系数0.991 6, 预测集决定系数为0.879 5, RMSEC为0.143, RMSEP为0.497, 建模效果好。 图5为蛋白质PLS定量模型的建模效果图。
将图2和图4、 图3和图5分别进行对比分析可以明显看出, 基于PCR建立的水分、 蛋白质定量模型效果较基于PLS建立的定量模型效果差, 且基于PCR建立的水分、 蛋白质的各验证集真实值与预测值之间线性相关性差, 预测结果不好。 而相较之下, 采用PLS得到的水分、 蛋白质各验证集真实值和预测值线性相关性高, 预测准确度好。 由此可见, 采用PLS法建立蜂王浆水分、 蛋白质的定量模型是可行的, 水分定量模型进行S-G(7)+二阶导数+SNV处理, 蛋白质建模进行S-G(7)+一阶导数+SNV处理, 得到的模型准确度高, 稳健性好。
描述了基于拉曼光谱的蜂王浆水分、 蛋白质定量模型的建立, 且通过光谱的预处理研究了最适合拉曼光谱PLS和PCR定量模型的优化方式, 旨在提高模型的准确性和稳健性, 保证模型在某些不可避免的外界因素影响下具有一定的抗干扰能力。 采用PCR建立蜂王浆水分、 蛋白质的定量模型, 其建模效果差, 预测准确度低, 不适合用于蜂王浆的组分检测。 采用PLS法对蜂王浆水分、 蛋白质进行建模是可行的, 水分含量校正集和预测集的决定系数分别为0.992 7和0.948 8, RMSEC和RMSEP分别为0.162和0.442。 蛋白质含量校正集和预测集的决定系数分别为0.991 6和0.879 5, RMSEC和RMSEP分别为0.143和0.497。
结果表明, 将多种预处理方法组合起来比单一方法修正光谱更加有效, 优化效果更加明显, 有效提升了模型性能, 提高了模型预测的准确性。 也表明了, 拉曼光谱应用于蜂王浆品质的快速检测是可行的, 且检测准确度高速度快, 在蜂王浆品质的快速检测方面展现了很好地应用前景。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|