作者简介: 杨卫梅, 女, 1992年生, 云南师范大学物理与电子信息学院硕士研究生 E-mail: 1090887515@qq.com
在农作物生产中, 不合理使用化学农药来防治植物病害的现象普遍存在, 严重影响产品品质及食用安全, 快速鉴别植物病害并采取合理的防治措施对提高农作物品质具有重要意义。 利用红外光谱三级鉴别法(傅里叶变换红外光谱(FTIR)、 二阶导数红外光谱(SD-IR)及二维相关红外光谱(2D-IR))对蚕豆、 玉米、 葱和蒜正常叶、 锈病叶病斑处及病斑附近绿色部位进行了研究。 结果显示, 正常叶、 病斑附近绿色部位及锈病叶病斑处的光谱吸收峰强度和形状存在微小差异。 原始光谱中正常叶、 病斑附近绿色部位及锈病叶病斑处的几个吸收强度比存在差异, 蚕豆的正常叶、 病斑附近绿色部位及锈病叶病斑处的吸收强度比 A1 410 /A1 646分别为0.698, 0.624和0.616, A2 926 /A1 646相应比值分别为0.665, 0.638和0.552; 玉米的相应比值 A1 649 /A1 055分别为0.813, 0.696, 0.691, A1 382 /A1 055相应比值分别为0.552, 0.478和0.465, A2 926 /A1 055相应比值分别为0.574, 0.467和0.469; 葱的相应比值 A1 382 /A1 061分别为0.843, 0.821和0.704, A2 923 /A1 061相应比值分别为0.707, 0.680和0.489; 以上锈病叶病斑处及病斑附近绿色部位的几个峰强比均比正常叶小。 二阶导数红外光谱在1 800~800 cm-1范围内, 正常叶、 病斑附近绿色部位及锈病叶病斑处的吸收峰的形状及强度显示明显差异。 二维相关红外光谱显示, 正常叶、 锈病叶病斑处及病斑附近绿色部位在860~1 690 cm-1范围内自动峰和交叉峰的位置、 数目及强度存在显著差异。 蚕豆正常叶出现4个强自动峰, 2组强的正交叉峰; 病斑附近绿色部位出现5个强自动峰, 4组强正交叉峰; 锈病叶病斑处出现2个最强自动峰和5个中强自动峰, 5组强正交叉峰; 蚕豆锈病叶病斑处自动峰强度最强, 而正常叶的各个自动峰的强度最低。 玉米正常叶出现9个强自动峰, 12组强的正交叉峰; 病斑附近绿色部位出现11个强自动峰, 3组最强的正交叉峰和11组中强正交叉峰; 锈病叶病斑处出现6个强自动峰, 3组强正交叉峰; 蒜正常叶出现9个强自动峰, 8组强的正交叉峰; 病斑附近绿色部位出现2个最强自动峰和9个次强自动峰, 10组强正交叉峰; 锈病叶病斑处出现6个强自动峰, 1组强正交叉峰; 玉米和蒜病斑附近绿色部位的各个自动峰的强度最强, 而锈病叶病斑处自动峰和交叉峰强度最弱。 葱正常叶出现9个强自动峰, 5组强的正交叉峰; 病斑附近绿色部位出现8个强自动峰, 3组强正交叉峰; 锈病叶病斑处出现3个强自动峰, 无正交叉峰出现。 葱正常叶的各个自动峰的强度最强, 而锈病叶病斑处自动峰强度最弱。 结果表明, 利用傅里叶变换红外光谱结合二阶导数红外光谱及二维相关红外光谱能简单、 快速地鉴别研究农作物锈病叶, 有望为农作物病害提供一种光谱检测方法。
In crop production, the unreasonable use of chemical pesticides to prevent from plant diseases is widespread, which affects product quality and food safety seriously. Therefore, it is of great significance to identify plant disease quickly and adopt appropriate control measures to improve the quality of crops. In this paper, the healthy leaves, rust spot and green area near the spot of rust diseased leaves of broad bean, corn, allium fistulosum and garlic were studied by a tri-step IR spectroscopy method, including Fourier transform infrared (FT-IR) spectroscopy, second derivatives infrared (SD-IR) spectroscopy and two-dimensional correlation infrared (2D-IR) spectroscopy. The results showed that tiny differences were observed in the intensities and shape of several peaks in the original spectra of each crop leaves. And several peak intensity ratios in the original spectra were different. The peak intensity ratio A1 410 /A1 646 of the healthy leaves, green area near spot and rust spot of rust diseased leaves of broad bean were 0.698, 0.624 and 0.616 respectively, and the corresponding ratio A2 926 /A1 646 were 0.665, 0.638 and 0.552 respectively. The corresponding ratio A1 649 /A1 055 of corn were 0.813, 0.696 and 0.691 respectively, and the corresponding ratio A1 382 /A1 055 were 0.552, 0.478 and 0.465 respectively; the corresponding ratio of A2 926 /A1 055 were 0.574, 0.467 and 0.469 respectively. The corresponding ratio A1 382 /A1 061 of allium fistulosum were 0.843, 0.821 and 0.704 respectively; the corresponding ratio of A2 923 /A1 061 were 0.707, 0.680 and 0.489 respectively. It can be seen that the intensity ratios of the rust spot and the green area near the spot of rust leaves were lower than that of the healthy leaves. More significant differences were exhibited in their SD-IR spectra in the range of 1 800~800 cm-1, and clearer differences in the position and intensity of auto and cross peaks were observed in the range of 860~1 690 cm-1 in 2D synchronous correlation spectra. The healthy leaves of broad beans showed 4 strong auto-peaks and 2 strong positive cross peaks, and 5 strong auto-peaks and 4 strong positive cross peaks were revealed in the green area near the spot of rust diseased leaves, and 2 strongest auto-peaks, 5 medium strong auto peaks and 5 strong positive cross peaks were appeared in the rust spot of rust diseased leaves. The intensity of auto-peaks of the rust spot of broad bean rust leaves were the strongest while the intensity of auto-peaks of the healthy leaves were the weakest. There were 9 strong auto-peaks and 12 strong positive cross peaks in the healthy leaves of corn, and 11 strong auto-peaks, 3 strongest positive cross peaks and 11 medium strong positive cross peaks in the green area near the rust spot on the diseased leaves, and 6 strong auto-peaks and 3 strong positive cross peaks in the rust spot of rust diseased leaves. There were 9 strong auto-peaks and 8 strong positive cross peaks in the healthy leaves of garlic, and 2 strongest auto-peaks, 9 medium strong auto-peak and 10 strong positive cross peaks appeared in the green area near spot of rust diseased leaves, and 6 strong auto-peaks and 1 strong positive cross peaks in the rust spot of rust diseased leaves. The intensity of auto-peaks of the green area near the spot of rust diseased leaves of corn and garlic were the strongest while the intensity of auto-peaks of the rust spot of rust diseased leaves were the weakest. There were 9 strong auto-peaks and 5 strong positive cross peaks in the healthy leaves of allium fistulosum, and 8 strongest auto-peaks and 3 strong positive cross peaks in the green area near the spot of rust diseased leaves, and 3 strong auto-peaks in the rust spot of rust diseased leaves. The auto-peaks of the healthy leaves of allium fistulosum were the strongest, while the auto-peaks of the rust spot of the rust leaves were the weakest. It is demonstrated that FT-IR combined with SD-IR and 2D-IR spectroscopy could be used to discriminate the crops rust leaves rapidly and effectively. Tri-step IR spectroscopy might provide a spectral method for detecting crop disease.
锈病是由真菌寄生引起的一种常见植物病害, 危害植物的叶片, 有时也危害花梗和果实, 病情严重时, 病斑将布满叶片两面, 像铁器生锈, 影响作物产量, 葱蒜类将失去食用价值[1, 2]。 在农作物生产中, 不合理使用化学农药来防治植物病害的现象普遍存在, 严重影响产品品质及食用安全; 快速、 准确地鉴别植物病害并采取合理的防治措施对提高农作物品质具有重要意义[3]。
根据病害叶症状的传统形态检测方法, 有一定的主观性; 还有利用分子生物学方法、 显微镜技术[4]、 镶入式图像处理[5]及分子标记法[6]检测植物锈病方法, 这些方法成本高, 需丰富经验, 耗时费力。
傅里叶变换红外光谱(FTIR)技术具有制样简单、 灵敏度高、 快速、 无损等优点, 广泛用于中药材鉴定、 食品品质检验、 农产品分析等领域[7, 8], 如Cardinali等[9]利用FT-IR结合偏最小二乘回归法鉴别巴西柑橘病害; 何志遥等[10]利用FT-IR技术研究葱蒜锈病叶; 欧全宏等利用FT-IR技术研究稻瘟病、 玉米锈病和蚕豆锈病叶; Sankaran等[11]利用可见-近红外光谱及热成像结合支持向量方法鉴别柑橘的病害叶与正常叶; Pereira等[12]利用激光荧光成像技术研究柑橘黄龙病; 二维光谱鉴别尚未见报道。
二维相关红外光谱(2D-IR)引入外界微扰来研究各组分基团分子振动行为差异, 运用数学方法将传统红外光谱信号扩展到二维来提高光谱分辨率, 可提供更多细节信息, 在食品、 中草药分析鉴别等领域广泛应用[13]。 如Qu等[14]利用FT-IR结合2D-IR分析和筛选沉香药材的掺假。 本利用傅里叶变换红外光谱结合二阶导数红外光谱和二维相关红外光谱研究蚕豆、 玉米、 葱和蒜正常叶、 锈病叶病斑处及病斑附近绿色部位, 有望为农作物病害检测提供一种快捷、 准确的方法。
美国Perkin Elmer公司生产的Frontier型红外光谱仪, 配备DTGS探测器, 测定范围4 000~400 cm-1, 分辨率为4 cm-1, 累计扫描16次。 温控仪为EUROTHERM公司生产的SYD-TC— 01型温度控制仪, 温度控制范围为50~120 ℃, 升温速率为2 ℃· min-1, 每隔10 ℃采集一次光谱得到动态光谱。
所有样品均采自云南省陆良县, 将所有样品进行烘干, 分别取同一品种、 同一生育期、 同一程度病害叶的病斑部位, 正常叶取与病害叶对应相同部位测试, 将样品放入玛瑙研钵中磨为细粉, 再加入适量的溴化钾搅磨均匀, 压片测试光谱, 测量的所有光谱均扣除纯溴化钾背景。
利用光谱处理软件(OMNIC 8.0)对原始光谱进行自动基线校正、 纵坐标归一化、 平均谱图、 平滑点数为5的Savitsky-Golay二阶导数预处理。 利用Origin8.6软件进行原始红外光谱、 二阶导数红外光谱数据处理, 再利用Perkin Elmer公司的Spectrum 10.03软件对动态原始光谱进行基线修正和基线交互修正预处理, 然后用清华大学开发的TD 4.2软件对动态谱进行二维相关红外光谱分析。
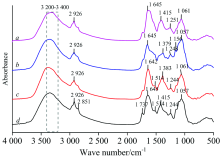
图1为蚕豆、 玉米、 葱和蒜正常叶的原始红外光谱图(10次测量值的平均红外光谱), 可以看出, 四种作物正常叶有一些共同的特征峰, 归属如下: 在3 200~3 400 cm-1附近呈现强而宽吸收峰, 归属为多糖和蛋白质的— OH和— NH伸缩振动; 在2 926和2 851 cm-1附近的吸收峰为— CH2的反对称和对称伸缩振动[8]; 1 737 cm-1附近的弱吸收峰是C=C伸缩振动; 1 645 cm-1附近的峰是蛋白质酰胺Ⅰ 带吸收峰, 葱和蒜在1 515 cm-1附近的弱峰为蛋白质酰胺Ⅱ 带吸收峰[13]; 1 415 cm-1附近的吸收峰为C— H剪式振动; 玉米和葱在1 383 cm-1附近的强峰为— OH弯曲振动; 1 244 cm-1附近的峰为C— O伸缩振动; 1 200~950 cm-1范围内为多糖的吸收区, 在1 156 cm-1附近出现弱吸收峰为多糖的C— O伸缩振动, 1 057 cm-1附近强峰为C— O— C伸缩振动[14]; 950~750 cm-1附近为糖类异构体吸收峰。
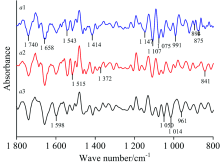
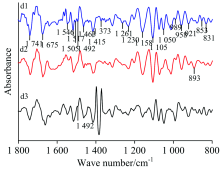
图2为蚕豆正常叶(a1)、 病斑附近绿色部位(a2)及锈病叶病斑处(a3)的原始红外光谱(10次测量值的平均红外光谱), 原始红外光谱显示, 在1 417, 1 105和921 cm-1附近, a1的吸收强度比a3强; 在1 740和1 650 cm-1附近, a3的吸收强度比a1强; a3在1 067 cm-1附近的吸收峰强度强于a2。 a1, a2和a3吸收强度比A1 410/A1 646分别为0.698, 0.624和0.616; A2 926/A1 646相应比值分别为0.665, 0.638和0.552; a1, a2及a3吸收强度比依次变小。
 | 图2(a) 蚕豆叶的傅里叶变换红外光谱 a1: 正常叶; a2: 病斑附近绿色部位; a3: 锈病叶病斑处Fig.2(a) FTIR spectra of broad bean leaves a1: Healthy; a2: Green area near rust; a3: Rust spot |
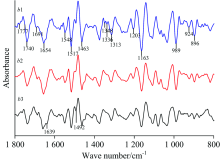
二阶导数光谱[图2(b)]在1 800~800 cm-1范围内存在明显差异, 在1 740, 1 658, 1 543, 1 414, 1 147和1 107 cm-1附近的峰强度, a1强于a2和a3; 在1 075和875 cm-1附近的峰强度, a1和a3强于a2; 在1 598和961 cm-1附近的峰强度, a3强于a1。 在1 542, 1 515和841 cm-1附近的峰强度, a2强于a3, 而在1 075, 1 050, 1 014和961 cm-1附近的峰强度, a3强于a2。 a1在991和894 cm-1附近及a2在1 372 cm-1附近出现明显吸收峰, a3在此处无吸收峰出现。
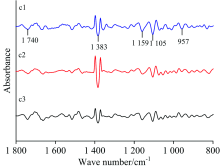
在860~1 690 cm-1范围的二维相关红外光谱[图2(c)], 正常叶(a1)出现4个强自动峰分别为1 197, 1 414, 1 560和1 650 cm-1附近, 最强峰1 560 cm-1附近, 最弱峰为1 197 cm-1, 两组较强的正交叉峰。 病斑附近绿色部位(a2)出现五个强自动峰在1 000, 1 218, 1 456, 1 562和1 606 cm-1附近, 最强峰在1 562 cm-1附近, 最弱峰1 218 cm-1附近, 出现四组强正交叉峰。 锈病叶病斑处(a3)出现两个最强自动峰为1 562和1 633 cm-1附近, 五个中强自动峰分别在939, 985, 1 039, 1 133和1 195 cm-1附近, 最强峰1 633 cm-1附近, 最弱峰为1 133 cm-1附近, 五组强正交叉峰。 a2, a3与a1相比较, a3在1 456 cm-1附近的自动峰强度低于a2, 其余自动峰强度增强, a1的各个自动峰的强度最低, 数目最少。
以上特征分析, 表明蚕豆正常叶、 病斑附近绿色部位和锈病叶病斑处的光谱存在明显差异, 表明它们的蛋白质、 多糖相对含量不同。
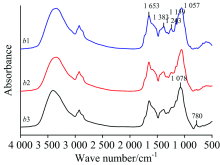
图3(a)是玉米正常叶(b1)、 病斑附近绿色部位(b2)及锈病叶病斑处(b3)的原始红外光谱(10次测量值的平均红外光谱), 可以看出, 在1 653, 1 383, 1 243和1 159 cm-1附近, b1的吸收强度比b3强; 在780 cm-1附近, b3的吸收强度比b1和b2强; 在1 243 cm-1附近, b2的吸收强度比b3强。 同时b1和b2在1 057 cm-1附近出现吸收峰, b3在1 078 cm-1附近出现吸收峰, 相差21 cm-1。 b1, b2, b3吸收强度比A1 649/A1 055分别为0.813, 0.696和0.691; A1 382/A1 055相应比值分别为0.552, 0.478和0.465; A2 926/A1 055相应比值分别为0.574, 0.467和0.469; 以上比值均看出, b2和b3吸收强度比均比b1相应比值变小。
 | 图3(a) 玉米叶的傅里叶变换红外光谱 b1: 正常叶; b2: 病斑附近绿色部位; b3: 锈病叶病斑处Fig.3(a) FTIR spectra of corn leaves b1: Healthy; b2: Green area near rust spot; b3: Rust spot |
二阶导数光谱[图3(b)]显示出明显差异, 正常叶(b1)在1 777 cm-1附近出现中强峰, 而锈病叶病斑处(b3)和病斑附近绿色部位(b2)在此处无吸收峰出现, b3在1 639 cm-1附近出现弱吸收峰, 而b1和b2在此处无明显吸收峰。 b1在1 350~1 320 cm-1附近出现两个吸收峰, 分别在1 348和1 336 cm-1附近, 而b2和b3在此范围无明显吸收峰出现。 在1 691, 1 548和1 492 cm-1附近的峰强度, b3强于b1, 在1 740, 1 654, 1 517, 1 463和1 313 cm-1附近峰强度, b1强于b3; 在1 203, 1 163, 989, 924和896 cm-1附近的峰强度, b1, b2和b3依次减弱, 同时在1 440~1 380, 1 110~1 070, 960~910 cm-1范围内, b1, b2和b3的峰形状和强度明显不同。
在二维相关红外光谱[图3(c)]中, 在860~1 690 cm-1范围内, 正常叶(b1)有九个自动峰, 分别为880, 955, 1 010, 1 095, 1 147, 1 212, 1 290, 1 558和1 632 cm-1附近, 最强峰在1 629 cm-1附近, 最弱峰为1 290 cm-1附近, 12组强的正交叉峰。 病斑附近绿色部位(b2)只出现11个自动峰, 分别为883, 971, 1 010, 1 094, 1 149, 1 197, 1 294, 1 455, 1 500, 1 561和1 634 cm-1附近, 最强峰在1 561 cm-1附近, 最弱峰为1 094 cm-1附近, 三组最强的正交叉峰, 11组强的正交叉峰, 与b1相比, 在1 455和1 561 cm-1附近的自动峰增强, 其余的自动峰强度减弱。 锈病叶病斑处(b3)只出现六个自动峰, 分别为1 008, 1 149, 1 210, 1 456, 1 556和1 633 cm-1附近, 最强峰在1 633 cm-1附近, 最弱峰为1 456 cm-1附近, 三组强的正交叉峰, 与b2比较, 在1 633 cm-1附近的自动峰强度增强, 其余的自动峰强度减弱。 可看出, b3的自动峰和交叉峰数目最少, 强度最低。
 | 图3(c) 玉米叶在860~1 690 cm-1范围的二维相关红外光谱 b1: 正常叶; b2: 病斑附近绿色部位; b3: 锈病叶病斑处Fig.3(c) 2D-IR spectra of corn leaves in the range of 860~1 690 cm-1 (b1): Healthy; (b2): Green area near rust; (b3): Rust spot |
根据以上特征, 表明玉米正常叶、 病斑附近绿色部位和锈病叶病斑处的蛋白质、 多糖含量存在明显差异。
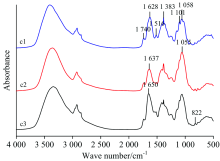
葱[图4(a)]正常叶(c1)、 病斑附近绿色部位(c2)及锈病叶病斑处(c3)的原始红外光谱(10次测量值的平均红外光谱)显示, 在1 740, 1 516, 1 383和1 101 cm-1附近, c1的吸收强度比c3强; 在1 058和822 cm-1附近, c3的吸收强度比c1强; c2在1 637 cm-1附近的峰强度最低。 c1和c3最强吸收峰分别为1 628和1 650 cm-1附近, 两者相差22 cm-1; c2最强峰在1 055 cm-1附近。 c1, c2和c3吸收强度比A1 382/A1 061分别为0.843, 0.821, 0.704; A2 923/A1 061相应比值分别为0.707, 0.680, 0.489; 可看出, c1, c2及c3吸收强度比依次变小。
 | 图4(a) 葱叶的傅里叶变换红外光谱 c1: 正常叶; c2: 病斑附近绿色部位; c3: 锈病叶病斑处Fig.4(a) FTIR spectra of allium fistulosum leaves c1: Healthy; c2: Green area near rust; c3: Rust spot |
在二阶导数光谱[图4(b)]中, 在1 159, 1 105和957 cm-1附近, 正常叶(c1)的吸收强度比病斑附近绿色部位(c2)和锈病叶病斑处(c3)强; 在1 740 cm-1附近, c3的吸收强度比c1和c2强; 在1 383 cm-1附近, c2峰强度最强, 可看出c1, c2及c3的吸收峰形状和强度存在明显差异。
二维相关红外光谱[图4(c)]显示, 在860~1 690 cm-1范围内, 正常叶(c1)出现九个强自动峰, 分别为941, 985, 1 039, 1 089, 1 129, 1 206, 1 352, 1 377和1 604 cm-1附近, 最强峰1 377 cm-1附近, 最弱峰为1 129 cm-1附近, 五组强的正交叉峰。 病斑附近绿色部位(c2)出现八个自动峰, 分别为885, 941, 999, 1 208, 1 325, 1 397, 1 450和1 617 cm-1附近, 最强峰在1 397 cm-1附近, 最弱峰为885 cm-1附近, 三组强的正交叉峰; 与c1相比较, 自动峰和交叉峰数目减少, 强度降低。 锈病叶病斑处(c3)只出现三个自动峰, 分别为1 385, 1 581和1 648 cm-1附近, 最强峰在1 385 cm-1附近, 最弱峰为1 581 cm-1附近, 无较明显的正交叉峰出现。 c1, c2及c3相比较, c1的自动峰和交叉峰数目最多, 强度最强, 而c3的自动峰和交叉峰数目最少, 强度最低。
以上分析结果得出, 葱正常叶, 病斑附近绿色部位和锈病叶病斑处的光谱存在明显差异, 表明它们的蛋白质, 多糖相对含量不同。
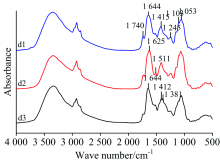
图5(a)为蒜正常叶(d1)、 病斑附近绿色部位(d2)及锈病叶病斑处(d3)的原始红外光谱(10次测量值的平均红外光谱)显示, d1和d3最强吸收峰在1 644 cm-1附近, 而d2最强峰在1 625 cm-1附近, 相差19 cm-1。 在1 740, 1 245, 1 103和1 053 cm-1附近, d1的吸收强度比d3强; 在1 644 cm-1附近, d3的吸收强度比d1强, 在1 511 cm-1附近, d2的吸收强度比d1和d3强。 在1 415 cm-1附近, d1和d2出现单峰, 而d3出现双峰分别在1 412和1 381 cm-1附近。
 | 图5(a) 蒜叶的傅里叶变换红外光谱 d1: 正常叶; d2: 病斑附近绿色部位; d3: 锈病叶病斑处Fig.5(a) FTIR spectra of garlic leaves d1: Healthy; d2: Green area near rust; d3: Rust spot |
二阶导数光谱[图5(b)]显示出明显差异, 在1 741, 1 546, 1 261, 1 230, 1 158, 1 105和958 cm-1附近的峰强度, 正常叶(d1)强于锈病叶病斑处(d3); 在1 517, 1 415, 1 373, 1 050, 989, 921, 853和831 cm-1附近的峰强度, d3强于d1; 在1 463和1 415 cm-1附近的峰强度, d3强于病斑附近绿色部位(d2); 在1 158, 1 105, 958和893 cm-1附近的峰强度, d2强于d3。 在1 492 cm-1附近, d3出现单峰, 而d1出现双峰为1 505和1 492附近; d2在1 630~1 560 cm-1范围无明显吸收峰; 同时在1 780~1 740, 1 590~1 550和1 400~1 300 cm-1范围, d1, d2及d3的峰形状和强度明显不同。
在二维相关红外光谱[图5(c)]中, 在860~1 690 cm-1范围内, 正常叶(d1)出现九个自动峰, 分别为937, 1 060, 1 204, 1 316, 1 383, 1 448, 1 521, 1 575和1 646 cm-1附近, 最强峰在1 575 cm-1附近, 最弱峰为1 316 cm-1附近, 八组强的正交叉峰。 病斑附近绿色部位(d2)出现两个最强峰分别为1 000和1 587 cm-1附近, 九个次强峰分别为885, 949, 1 078, 1 110, 1 214, 1 385, 1 443, 1 521和1 652 cm-1附近, 最强峰在1 587 cm-1附近, 最弱峰为1 385 cm-1附近, 10组较强的正交叉峰。 锈病叶病斑处(d3)只出现六个强自动峰, 分别为895, 953, 1 018, 1 204, 1 420和1 631 cm-1附近, 最强峰在1 631 cm-1附近, 最弱峰为1 018 cm-1附近, 一组较强的正交叉峰, 与d1, d2比较, d3的自动峰和交叉峰数目减少, 强度减弱。
 | 图5(c) 蒜叶在860~1 690 cm-1范围的二维相关红外光谱 d1: 正常叶; d2: 病斑附近绿色部位; d3: 锈病叶病斑处Fig.5(c) 2D-IR spectra of garlic leaves in the range of 860~1 690 cm-1 (d1): Healthy; (d2): Green area near rust; (d3): Rust spot |
以上分析结果得出, 蒜正常叶, 病斑附近绿色部位和锈病叶病斑处之间存在明显差异, 表明它们的蛋白质, 多糖含量明显不同。
利用红外光谱三级鉴别法(傅里叶变换红外光谱, 二阶导数红外光谱及二维相关红外光谱)鉴别研究蚕豆, 玉米, 葱和蒜的正常叶, 锈病叶病斑处及病斑附近绿色部位。 结果显示, 锈病叶病斑处及病斑附近绿色部位的几个吸收强度比均比正常叶相应比值小, 且正常叶, 锈病叶病斑处及病斑附近绿色部位的原始红外光谱存在微小差异; 在二阶导数光谱1 800~800 cm-1范围内, 峰位置, 强度及形状存在明显差异。 在二维相关红外光谱860~1 690 cm-1范围内, 正常叶, 锈病叶病斑处及病斑附近绿色部位的自动峰和交叉峰的位置, 数目及强度有显著差异, 正常叶自动峰数目最多, 强度最强; 锈病叶病斑处自动峰数目最少, 强度最低。 结果表明傅里叶变换红外光谱结合二维相关红外光谱在研究农作物病害方面具有快速, 简便的优点, 有望发展为农作物病害的光谱检测方法。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|