作者简介: 王世霞, 女, 1983年生, 上海理工大学理学院讲师 e-mail: wangshixia@usst.edu.cn
成矿作用过程中, 温压条件改变导致矿物溶解重结晶, 溶液中溶质浓度发生变化。 从溶液中析出晶体的粒度同时存在着时间和空间的分布, 是复杂的动力学过程。 当前对矿物在流体中溶解重结晶动力学研究主要使用高压釜或活塞圆筒等封闭设备测定溶液溶质浓度的变化或固相矿物的形态变化, 降温淬火反应会影响样品的真实组成。 使用可进行原位观测的金刚石压腔结合拉曼光谱分析技术, 研究无水芒硝-饱和Na2SO4溶液随体系温度压力变化所出现的晶体溶解重结晶过程。 通过原位观测无水芒硝溶解、 结晶变化来探究硫酸钠晶体在不同温压条件下的溶解结晶动力学反应机制。 结果表明常温条件下无水芒硝拉曼位移分别位于449.9, 620.5, 632.9, 647.4, 993.3, 1 101.8, 1 132.2和1 153.1 cm-1。 随着体系温度的缓慢升高, 固相Na2SO4的晶形不断发生变化, 温度至193 ℃时无水芒硝(Na2SO4)完全溶解, 降温重结晶出现了新的1 196.5 cm-1拉曼特征峰, 重结晶晶体为芒硝(Na2SO4·10H2O); 金刚石原位观测结果显示迅速升温过程中无水芒硝发生部分溶解重结晶, 重结晶区域拉曼特征峰显示依然为无水芒硝。 拉曼光谱定量分析结果显示, 溶液中S
During the mineralization process, the dissolution of primary mineral and the formation of secondary mineral could happen on the conditions of changing temperature and pressure. The dissolution and recrystallization of the minerals would cause the changing concentration of the solute, and the crystal which is from recrystallization depends on the reaction process. The process of dissolution and recrystallization is a complex dynamic process. At present, high-pressure autoclave and piston-cylinder are mainly used for the study of the kinetics on the dissolution and recrystallization of the minerals, whereas the cooling quenching reaction will affect the true composition of the sample. In this experiment, the process of the crystal recrystallization of thenardite saturated Na2SO4 solution with the change of temperature and pressure was traced by using the in-situ observation of diamond anvil cell with Raman spectroscopy. The dissolution and recrystallization kinetics of sodium sulfate crystals during different temperature and pressure conditions were investigated by in situ observation and spectrometry. The results showed that the Raman spectroscopy of thenardite at room temperature were 449.9, 620.5, 632.9, 647.4, 993.3, 1 101.8, 1 132.2 and 1 153.1 cm-1 respectively. The crystal shape of solid thenardite changed continuously with the slow increase of temperature, and thenardite was dissolved completely when system temperature reached to 193 ℃. The recrystallized crystal appeared with decreasing temperature rapidly, and the new 1 196.5 cm-1 Raman characteristic peak of recrystallized crystal showed the appeared crystal was mirabilite (Na2SO4·10H2O). In-situ observation of diamond showed that thenardite partially dissolveed and recrystallized during the rapid heating process, and the Raman characteristic peak of the recrystallized region was still thenardite. The process of dissolution and crystallization was controlled by diffusion. The Raman spectroscopy improved can be used for quantitative analysis. Compared with the parameter of peak intensity, area and S
矿物在水溶液中溶解结晶不仅引起溶液相溶质浓度发生变化, 从溶液中析出晶体的粒度同时存在着时间和空间的分布。 对矿物在水溶液中溶解和结晶及其动力学研究的两种方法, 一是测定溶液中溶质浓度的变化[1, 2], 二是测定固相的变化[3]。 目前高温高压条件下的实验多采用高压釜或活塞圆筒等封闭设备来进行, 封闭设备不能进行原位观测, 降温淬火过程中伴随反应的发生会对样品的真实组分产生影响, 而固液两相在线实时变化信息的准确获取对于溶解结晶过程识别和参数计算具有较大的影响。 相对于传统实验方法的局限性, 水热金刚石压腔可以进行镜下原位观察, 原位拉曼光谱可定量分析溶液中离子的浓度[4, 5, 6]。
芒硝为干涸盐湖的化学沉积物, 它从含钠和硫酸根的过饱和盐湖中晶出, 与石膏、 石盐、 无水芒硝、 泻利盐等共生。 应用水热金刚石压腔结合拉曼光谱技术研究无水芒硝在饱和水溶液中的溶解结晶过程, 通过原位观测无水芒硝溶解, 结晶变化, 对该反应中溶液中S
高温高压实验采用类似于Mao-Bell金刚石压腔[7, 8], 实验体系的温度由温控器测得并校正, 压力根据石英压标确定[9]。 拉曼光谱应用北京大学地球与空间科学学院Renishow100型激光拉曼光谱仪进行原位测定。
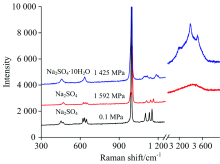
Na2SO4是无水芒硝的主要成分, 无水芒硝为斜方晶系, 晶体结构由[SO4]四面体和[NaO6]八面体组成, 集合体为粒状、 块状或粉末状, 易溶于水, 在潮湿空气中易水化, 逐渐变为粉末状的芒硝。 芒硝为十水硫酸钠 (Na2SO4· 10H2O), 单斜晶系, 晶体结构中[Na(H2O)6]八面体联结成锯齿状链, 链间以[SO4]和2个缓冲H2O分子以氢氧— 氢键相联结, 呈致密块状, 纤维状集合体。 图1显示为常温不同压力调节下无水硫酸钠和含水硫酸钠拉曼光谱图。 常温条件下无水硫酸钠拉曼位移分别为表征[S
选择无水Na2SO4晶体和饱和Na2SO4溶液共存态作为初始状态。 体系1研究缓慢升温Na2SO4晶体的溶解重结晶过程; 体系2研究快速升温Na2SO4晶体的溶解重结晶过程。 实验体系1缓慢升温使无水Na2SO4晶体完全溶解在饱和Na2SO4溶液中, 随后降温发生Na2SO4晶体重新结晶; 实验体系2快速升至109 ℃, 随温度升高 Na2SO4溶解度降低导致Na2SO4晶体发生重结晶。 实验过程中应用拉曼光谱仪测定体系溶液中S
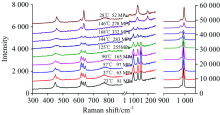
首先在压腔中装入压标物质石英和样品无水硫酸钠晶体, 然后加入饱和Na2SO4溶液迅速密封。 常温条件下放置12 h后进行加温实验, 每次升温10~20 ℃, 升温之后等待10~20 min进行拉曼测试, 原位观测实验过程以及该过程中硫酸钠晶体的拉曼光谱图如图2和图3所示。
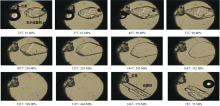 | 图3 Na2SO4溶解结晶过程中固相的变化Fig.3 The change of solid phase in the process of dissolution and recrystallized of Na2SO4 |
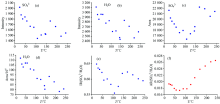
硫酸钠溶液体系中S
将溶液中S
| 表1 Na2SO4溶解重结晶过程中溶液S |
通过和图3中的溶解现象对比, 无水Na2SO4溶解过程中溶液中S
升温过程中, 无水硫酸钠的溶解度减小, 促使固相生长。 本实验常温条件下快速升温至109 ℃, 研究该升温过程中无水硫酸钠的生长速率。 实验过程如图5所示, 固相样品为无水硫酸钠。 图6所示整个实验过程中拉曼光谱未发生突变, 无水硫酸钠无相变。
 | 图5 109 ℃条件下水溶液中固相Na2SO4随时间的变化Fig.5 The change of solid phase of Na2SO4 in the aqueous solution with time at 109 ℃ |
 | 图6 109 ℃溶液中S |
由图6可以看出溶液中S
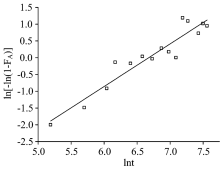
研究对体系中固相无水Na2SO4的溶解结晶过程选取Johnson-Mehl-Avrami-Kolmogorov(JMAK)[11, 12, 13]模型进行拟合
其中, F为反应进度; t为反应时间; n为反应级数; k为反应速率常数。 利用ln[-ln(1-F)]和lnt作图, 根据最小二乘法拟合得到的线性关系的斜率n和截距nlnk可得到反应的级数和反应速率。
根据FA=(AR-AR0)/(AReq-AR0)计算得到反应进度F, 由初始反应的0.126 6到反应平衡的1.113 9(表1所示)。
根据JMAK方程ln[-ln(1-F)]=nlnk+nlnt, 结合表2数据利用ln[-ln(1-F)]对lnt作图(图7所示), 由AR(S
| 表2 109 ℃溶液中S |
(1)硫酸钠晶体在饱和溶液中重结晶受溶解过程控制。 逐步增温过程中无水硫酸钠晶体完全溶解, 降温结晶十水硫酸钠。 快速增温并保持恒温过程中, 无水硫酸钠晶体部分溶解至过饱和, 再结晶为无水硫酸钠。
(2)根据拉曼光谱定量分析结果, 溶液中S
(3)利用金刚石压腔结合拉曼光谱技术可以实现高温高压条件下矿物在水溶液中溶解结晶动力学过程的原位观察和测量, 对于研究快速相变具有重要意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|