作者简介: 连 宁, 1962年生, 江苏理工学院化学与环境工程学院教授 e-mail: ln@jsut.edu.cn
儿茶酚胺(Cas)作为神经递质和激素对人体的生理功能发挥着重要作用。 它是一类分子中包含一个胺基和一个邻苯二酚基团的有机化合物, 其中邻苯二酚基团由苯环和3, 4位两个羟基组成。 生理条件下, 儿茶酚胺主要指多巴胺(DA)、 去甲肾上腺素(NE)和肾上腺素(E)三种物质。 儿茶酚胺性质不稳定, 遇光或空气易氧化分解。 镧系敏化发光是一种很有前途的临床和药物分析工具, 在镧系敏化发光中, 镧离子与有机化合物形成络合物, 这些络合物具有良好的发光特性, 主要用于有机分析物的测定。 因此, 利用镧系金属离子铽敏化发光法测定儿茶酚胺的关键是待测物与中心离子易形成稳定的络合物。 儿茶酚胺与金属离子的络合作用主要依赖于分子中酚羟基解离后的氧作为成键原子, 溶液的碱性越强, 儿茶酚胺与金属离子的络合能力越强。 在碱性介质中, 为防止金属离子水解加入乙二胺四乙酸作为协同配体, 金属离子铽和协同配体以及儿茶酚胺形成易溶于水的三元络合物, 络合物具有良好的稳定性, 并表现出较强的铽的特征荧光。 加入阳离子表面活性剂十六烷基三甲基氯化铵为增敏剂, 可使儿茶酚胺三元络合物体系的荧光强度增加约4~6倍。 利用紫外吸收和荧光光谱研究了铽三元络合物的光物理性质以及能量转移机理, 结果表明, 儿茶酚胺能有效吸收紫外辐射, 三元络合物荧光增强机理是配体儿茶酚胺吸收辐射能后通过分子内能量转移将能量转移给铽离子, 进而产生铽的特征发射。 对影响三元络合物荧光强度的主要因素如溶液酸度、 试剂浓度和加入顺序、 表面活性剂种类以及干扰物质等进行了讨论。 在一定条件下, 体系的发光强度与儿茶酚胺的浓度成线性关系。 多巴胺、 去甲肾上腺素和肾上腺素的线性范围分别为0.080~50.0×10-6, 0.070~50.0×10-6和0.070~50.0×10-6 mol·L-1; 相应检出限分别为2.4×10-8, 2.2×10-8和2.1×10-8 mol·L-1。 建立的方法用于药物制剂中三种儿茶酚胺的定量测定, 结果满意; 由于反应体系所得铽络合物具有发射带窄, 斯托克斯位移大, 以及较长的荧光寿命等优点, 该方法有望用于儿茶酚胺的自动分析、 临床药代动力学研究以及相关病理的实际诊断, 也可用于高效液相色谱和毛细管电泳检测器。
Catecholamines (Cas) plays an important role in physiological function of human body as neurotransmitter and hormone. They are organic compounds that contain an amine group and a catechol group that is constituted by a benzene ring with two hydroxyl groups at 3- and 4-positions. In physiological conditions, catecholamine mainly refers to dopamine (DA), norepinephrine (NE) and adrenaline (E). Catecholamines are chemically unstable, prone to spontaneous oxidation and decompose easily when exposed to light or air. Lanthanide sensitized luminescence is a promising tool for clinical analysis and drug analysis. In lanthanide sensitized luminescence, lanthanide ions form complexes with organic compounds, these chelates display a well-defined luminescence characterized, mainly for the determination of organic analytes. Therefore, the key to determining catecholamine by the terbium sensitization luminescence is that the analyte forms an effective and stable complex with the central ion. It is a general understanding that catecholamines form rather stable chelate complexes with metal ions, the two oxygen of the phenolic groups acting as donor atoms. Therefore, the more alkaline the solution, the stronger the complex ability of catecholamine and metal ions. In order to prevent hydroxide formation ethylenediaminetetracetic acid (EDTA) is added into the alkaline solutions, EDTA as synergistic ligand serves to chelate Tb3+ with high affinity and keeps it soluble in water, terbium ion and synergistic ligands and catecholamines form stable ternary complex soluble in water and exhibit strong characteristic fluorescence of terbium. The system with cationic surfactant cetyltrimethylammonium chloride (CTAC) as sensitizer, can make the luminescence for catecholamine chelates increased by a factor of 4 to 6. UV absorption and fluorescent spectra were used to investigate the photophysical properties of the ternary complex and energy transfer mechanism. The study shows that the catecholamine is an effective absorber of ultraviolet radiation, and the possible mechanism of the ligand sensitized fluorescence may be explained based on intramolecular energy transfer. In the energy transfer process, the ligand catecholamine absorbs the radiation energy and transfers the energy to terbium ion through intramolecular energy transfer, thus generating characteristic emission of terbium. The main factors affecting the fluorescence intensity of ternary complex, such as solution acidity, reagent adding concentration and sequence, types of surfactants and interfering substances, etc., were discussed. Under the optimized condition, the luminescence intensity of the system is linearly related to the concentration of the catecholamines. Linearity is observed in the concentration ranges of 0.080~50.0×10-6 mol·L-1 for dopamine, 0.070~50.0×10-6 mol·L-1 for norepinephrine, and 0.070~50.0×10-6 mol·L-1 for epinephrine, with limits of detection as low as 2.4×10-8, 2.2×10-8 and 2.1×10-8 mol·L-1, respectively. The proposed method has been successfully applied to the quantitative determination of the three catecholamines in a pharmaceutical preparation. Due to the advantages of narrow emission bands, large stokes shift and long excited-state lifetimes, it will be possible to investigate this method further for automated analysis, clinical pharmacokinetics study, practical diagnostic for catecholamine-related pathologies, and it can be used in HPLC and CE detectors.
儿茶酚胺(Cas)是由酪氨酸在中枢和周围神经系统的神经元结构中通过酶级联的多步生物转化而产生的, 在中枢和周围神经系统中作为神经递质和/或激素对人体的生理功能发挥着重要作用, 与人类健康密切相关。 多巴胺(DA)、 肾上腺素(E)和去甲肾上腺素(NE)是三种较丰富的内源性儿茶酚胺。 除了与阿尔茨海默氏症和帕金森氏症等疾病有关外, 儿茶酚胺作为诱导刺激的串联释放物, 也是衡量饮食、 性和药物成瘾等相关行为的重要指标[1], 在医疗上用于诊断和治疗帕金森氏症、 心力衰竭、 肥胖、 抑郁和癫痫等疾病[2]。 因此, 临床和生物医学领域需要开发简单、 快速、 灵敏的方法来测定儿茶酚胺。
常见的测定儿茶酚胺的方法有分光光度法[3]、 荧光法[4]、 化学发光法[5]、 电化学法[6]、 毛细管电泳(CE)法[7]以及高效液相色谱(HPLC)法[8]等。 实际应用中根据儿茶酚胺易氧化的性质常选择HPLC结合电化学法[8]作为定量测定儿茶酚胺及其代谢物的标准方法。 虽然高效液相色谱法分析具有选择性好、 检出限低的特点, 但其一般需要复杂的前处理步骤; 毛细管电泳易受样品中不同化合物相似电泳行为的影响; 电化学法中, 儿茶酚胺的氧化还原峰与尿酸、 抗坏血酸等常见共存化合物有较大的重叠[9]。 荧光法、 化学发光法和质谱法是选择性测定儿茶酚胺的常见替代方法。 荧光分析法具有灵敏度高、 重现性好, 简单方便、 发射光谱变化大等特点而受到关注。 近年来, 一些纳米材料如量子点、 碳点、 金纳米以及纳米团簇等荧光纳米材料由于其独特的物理和化学性质, 作为优良的荧光传感组成部分, 用来灵敏的检测儿茶酚胺及其代谢物[10, 11, 12, 13]。 然而, 大多数基于量子点和金纳米等儿茶酚胺荧光分析方法都是通过荧光猝灭来实现的, 利用荧光增敏进行分析的比较少。 本法利用稀土铽络合物荧光增敏进行分析, 分析特性与文献报道相似[11, 12, 13], 且荧光分析的稳定性和重现性均较好。
儿茶酚胺与金属离子的络合作用主要依赖于分子中酚羟基解离后的氧作为成键原子。 据文献报道[14], 通常儿茶酚胺在水溶液中有三级解离平衡, pKa值: 多巴胺(8.85, 10.32, 12.62), 去甲肾上腺素(8.58, 9.53, 12.93), 肾上腺素(8.63, 9.84, 13.13), 其中Ka1和Ka3对应苯环上两个酚羟基的解离, 而Ka2对应胺基的解离。 根据解离平衡常数的大小, 溶液pH 12~13时酚羟基易于解离与金属离子形成络合物。 因此, 溶液的碱性越强, 儿茶酚胺与金属离子的络合能力越强。 为防止金属离子在强碱性介质中发生水解, 采用乙二胺四乙酸(EDTA)作为协同配体。 本文基于铽与儿茶酚胺在协同配体EDTA存在下形成易溶于水的稳定三元络合物, 加入阳离子表面活性剂十六烷基三甲基氯化铵为增敏剂能显著增强络合物荧光的特性, 建立了一种简便、 快速、 灵敏的荧光法测定儿茶酚胺的新方法; 该方法用于药物制剂中儿茶酚胺的测定, 结果满意。 并在实验基础上探讨了铽络合物的发光性质以及镧系敏化发光机理。
Cary eclipse 荧光分光光度计; Cary 50紫外/可见分光光度计; pHS-3C型酸度计。 盐酸多巴胺标准品、 重酒石酸去甲肾上腺素标准品和盐酸肾上腺素标准品购于国药集团化学试剂有限公司; 三种儿茶酚胺配成0.001 mol· L-1储备液储存于4 ℃冰箱中, 临用时逐级稀释; 乙二胺四乙酸二钠盐(EDTA, 分析纯, 国药试剂); 十六烷基三甲基氯化胺(CTAC, 分析纯, 国药试剂); 六水氯化铽(分析纯, 国药试剂); 其他试剂均为分析纯, 实验用二次蒸馏水。 Tb-EDTA(1:1, 0.5 mol· L-1): 1.861 2 g Na2EDTA· 2H2O溶于少量0.1 mol· L-1 NaOH溶液中, 然后加入1.866 4 g TbCl3· 2H2O溶解后定容至100 mL。
在10 mL比色管中, 依次加入一定量的儿茶酚胺标准溶液或样品溶液, 1.0 mL 1.0× 10-2 mol· L-1 Tb(Ⅲ )-EDTA溶液和1.0 mL 0.1 mol· L-1 NaOH溶液, 摇匀后加入0.4 mL 5.0× 10-3 mol· L-1 CTAC溶液, 再用水稀释至刻度摇匀, 放置20 min, 分别进行紫外和荧光测定; 荧光测量用1 cm比色皿, 在激发波长307 nm、 发射波长545 nm下测定体系荧光强度(I), 同时测定试剂空白的荧光强度(I0), 相对荧光强度(Δ I=I-I0)与Cas的浓度呈线性关系。
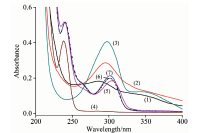
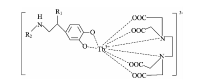
儿茶酚胺及其三元络合物、 Tb(Ⅲ )-EDTA的紫外吸收光谱如图1所示。 由于芳香族苯环的p电子离域, 儿茶酚胺是一种有效的紫外辐射吸收剂。 由图1可知, 单独的多巴胺、 去甲肾上腺素和肾上腺素三种儿茶酚胺的最大吸收波长分别为285, 295和298 nm; 二元体系Tb(Ⅲ )-EDTA或Tb(Ⅲ )-EDTA中加入CTAC在260~350 nm范围内没有任何吸收, 当儿茶酚胺加入二元体系Tb(Ⅲ )-EDTA的胶束介质中后, 在此范围内出现了新的吸收峰, 多巴胺体系新峰位于304 nm, 去甲肾上腺素体系新峰位于302 nm, 肾上腺素体系新峰位于300 nm, 这些新峰与单纯的儿茶酚胺吸收峰相比较, 发生了明显的红移, 说明体系形成了新的三元络合物。 通常情况下Tb(Ⅲ )-EDTA形成1:1络合物, 且络合物的配体中含有不稳定的水, 易被其他较强配体所取代[15]; 因此, 在碱性溶液中儿茶酚胺的酚羟基完全解离后的氧作为成键原子取代水分子与Tb(Ⅲ )配位, 形成了Cas-Tb(Ⅲ )-EDTA三元络合物。 根据EDTA络合物特点和稀土离子配位数, 结合上述实验现象, 推测儿茶酚胺与Tb(Ⅲ )-EDTA形成的三元络合物的结构如图2(DA: R1-H, R2-H; NE: R1-OH, R2-H; E: R1-OH, R2-CH3)所示。
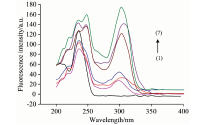
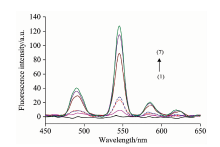
不同体系络合物Tb(Ⅲ )-EDTA, Cas-Tb(Ⅲ )-EDTA及Cas-Tb(Ⅲ )-EDTA-CTAC的荧光激发光谱和发射光谱分别如图3和图4所示。
由图3的激发光谱可知, 铽与EDTA二元络合物仅在235 nm处有一个激发峰, 而儿茶酚胺与铽和EDTA的三元络合物在235~248和297~305 nm处分别有两个激发峰; 激发光谱与紫外吸收光谱形状相似, 波长相近, 在此条件下, 儿茶酚胺形成的三元络合物能有效吸收激发光显著增强铽的荧光强度。
由图4的荧光发射光谱可知, 铽与EDTA二元络合物几乎无荧光, 向其中加入儿茶酚胺后, 儿茶酚胺作为较强配体与Tb(Ⅲ )发生共配位作用, 形成Cas-Tb(Ⅲ )-EDTA三元络合物, 表现出铽的特征荧光峰, 其中545 nm处荧光强度最大。 这也从另一个方面证实三元络合物的形成, 因为Tb(Ⅲ )-EDTA二元络合物在545 nm处几乎无荧光。 儿茶酚胺与铽和EDTA形成的三元络合物在490, 545, 585和620 nm处表现出窄的、 尖锐的铽离子荧光特征, 分别对应铽离子的5D4→ 7F6, 5D4→ 7F5和5D4 → 7F4的跃迁。 产生这种现象的原因可用分子内能量转移来解释, 即三元络合物配体中的儿茶酚胺能有效吸收激发光的能量, 然后通过分子内能量转移将能量转移给铽, 使铽离子发射的荧光强度显著增强。 文献报道, 儿茶酚胺分子的三线态能量(T1)约为20 800~24 000 cm-1, 与三价铽离子的5D4能级的能量20 500 cm-1相比较, 儿茶酚胺分子的能量接近并略高于三价铽离子的能量, 能够发生有效的分子内能量转移[15], 从而产生较强的铽的特征荧光。 因此, 上述分子内能量转移主要历程推测如下, 首先三元络合物中的儿茶酚胺配体接受激发光形成Cas* -Tb(Ⅲ )-EDTA激发态, 然后通过分子内能量转移由Cas* 将能量转移给铽离子, 形成Cas-Tb(Ⅲ )* -EDTA激发态, 随后此激发态以辐射失活过程释放能量回到基态, 从而形成铽离子的特征发射。 上述分子内能量转移机理可表示如下:
图3的激发光谱还表明在CTAC胶束介质中三元络合物的激发光谱峰位产生轻微的红移, 且峰有显著的增强。 此外, 从图4的荧光发射光谱还可看出三元络合物的荧光在CTAC存在下有显著增强, 推测其原因可能是一方面阳离子表面活性剂CTAC与儿茶酚胺三元络合物之间产生了较强的静电相互作用, 另一方面在胶束表面pH值的增高可能降低了游离儿茶酚胺酚羟基的pKa值, 更利于三元络合物的形成。 此外, 当三元络合物与表面活性剂胶束相互作用分散和聚集时, 其微环境的改变在很大程度上降低了由于分子碰撞导致的非辐射能量损失, 提高了荧光量子效率, 更有效地促进分子内能量转移。
酸度是影响络合物荧光强度的主要因素, 用稀盐酸或氢氧化钠调节溶液pH为9.0~13.0, 测试了儿茶酚胺在过量Tb(Ⅲ )* EDTA存在下的荧光强度, 结果表明, 在pH 12.0~13.0酸度条件下, 三元络合物的荧光强度最强, 此酸度与儿茶酚胺酚羟基完全解离的酸度一致。 同时还实验了Tris-HCl, NH4Cl-NH3, Na2CO3-NaHCO3, NaOH以及硼酸盐等不同缓冲溶液的影响, 结果表明使用氢氧化钠控制pH的效果最好, 因此后续实验选择用0.01 mol· L-1氢氧化钠调节溶液酸度。
在pH 12的酸度条件下研究了Tb(Ⅲ )-EDTA浓度对三元络合物荧光强度的影响, 荧光强度起初随Tb(Ⅲ )-EDTA浓度的增加而显著增强, 当浓度超到0.5× 10-3 mol· L-1时, 荧光强度达到最大值并稳定不变。 后续实验选择其浓度为1.0× 10-3 mol· L-1, 此条件下儿茶酚胺形成络合物的速度很快并且很稳定。
实验检测了不同种类表面活性剂对三元络合物荧光强度的影响, 在选定的酸度下, 阳离子表面活性剂对络合体系有较好的增敏作用。 当所加阳离子表面活性剂(例如CTAC)的浓度接近或大于临界胶束浓度时, 荧光强度显著增强, 与不加CTAC的体系相比, 荧光强度增加约4~6倍。 而十二烷基苯磺酸钠等阴离子表面活性剂以及曲拉通X-100等非离子型表面活性剂则没有增敏作用。 增敏作用主要可能是带正电荷的阳离子胶束与带负电荷的络合物之间产生了较强的相互静电作用。 同时实验了CTAC浓度对荧光强度的影响, 体系的荧光强度随CTAC浓度的增加而增大, 当浓度达到2.0× 10-4 mol· L-1时, 体系荧光强度达到最大, 然后随浓度增加荧光强度减小, 因此, 后续实验选择CTAC浓度为2.0× 10-4 mol· L-1。
实验结果表明, 试剂加入顺序为Tb(Ⅲ )-EDTA、 儿茶酚胺、 氢氧化钠、 CTAC时, 反应生成的三元络合物的荧光强度最大, 该顺序为最佳试剂加入顺序。 在选择的最佳实验条件下, 反应体系在加入试剂10 min后其荧光强度达到最大, 并且具有良好的稳定性, 其荧光强度能稳定维持8 h。 与金属离子和儿茶酚胺二元络合物相比(约稳定1 h), 稳定性有很大的提高。
在选定的实验条件下, 考察了用荧光法测定儿茶酚胺(5.0× 10-6 mol· L-1)时可能共存物质的干扰影响。 以干扰物质存在下待测体系荧光强度变化不超过± 5%作为判据, 若超过5%, 则视为有干扰; 反之无干扰。 儿茶酚胺药物制剂和生物样品中常见离子和生化物质的干扰情况见表1。 结果表明, 大多数常见的药物辅料等共存物质不影响Cas的测定。
| 表1 测定儿茶酚胺时各种共存物质的最大允许量 Table 1 Tolerance limit for possible interferents in determination of Cas |
在最佳条件下, 体系的荧光强度与儿茶酚胺的浓度呈良好的线性关系, 线性范围和回归方程如表2所示。 多巴胺、 去甲肾上腺素和肾上腺素的线性范围分别为0.080~50.0× 10-6, 0.070~50.0× 10-6和0.070~50.0× 10-6 mol· L-1; 相应的检出限多巴胺为2.4× 10-8 mol· L-1、 去甲肾上腺素为2.2× 10-8 mol· L-1、 肾上腺素为2.1× 10-8 mol· L-1。
| 表2 儿茶酚胺的分析特性(n=3) Table 2 Analytical characteristics of the Cas (n=3) |
为了验证方法的有效性, 对不同药物针剂中的儿茶酚胺按照本法进行了分析。 针剂分别采用盐酸多巴胺(H32023366), 重酒石酸去甲肾上腺素(H12020621)和盐酸肾上腺素(H12020526)三种注射液作为样品, 分析时取一定量样品直接用二次蒸馏水稀释, 使其浓度位于线性范围内, 然后按照实验方法进行测定, 同时用标准加入法进行回收率测定。 结果表明, 本法测定的结果与标示值无显著差别; 标准加入法三种药物的回收率测定结果多巴胺为97.5%~98.0%、 去甲肾上腺素为98.5%~101.0%、 肾上腺素为99.0%~102.0%; 分析结果见表3。
| 表3 药物针剂中儿茶酚胺的分析(n=3) Table 3 Assay of the Cas in injection (n=3) |
铽敏化发光法用于药物制剂中儿茶酚胺的测定, 结果满意。 方法的主要优点是简单、 快速和灵敏, 重现性和稳定性好。 由于反应体系所得铽络合物具有斯托克斯位移大, 荧光强度强以及荧光寿命长等优点, 本法若用于时间分辨荧光检测有望进一步提高分析的灵敏度和选择性。 此外, 本法还可用于自动分析、 临床药代动力学研究、 儿茶酚胺相关病理的实用诊断, 也可用于HPLC和CE检测器。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|