RU Ping and YUAN Cui-fang: jont first authors
作者简介: 茹 苹, 女, 1997年生, 河北北方学院医学检验学院本科生 e-mail: 1848519637@qq.com;袁翠芳, 女, 1998年生, 河北北方学院医学检验学院本科生 e-mail: 2285207802@qq.com
茹 苹, 袁翠芳: 并列第一作者
目前, 傅里叶变换红外光谱(FTIR)技术具有待测样品数量少、 对特征基团灵敏度高、 样品制备和分析简单等优点; 电感耦合等离子体质谱(ICP-MS)的优势也较为显著: 微量元素的高灵敏度检出率, 低检测限和多元素的同时分析; 协同上述两种方法, 可快速对功能医用材料的化学元素和基团进行鉴定, 从而为仿生医用抗菌材料的研发提供新的设计思路和理论依据。 羟基磷灰石(HA)因其优异的骨传导和骨诱导特性被用于薄膜材料, 钛植入表面HA薄膜已进入临床应用阶段。 但是, HA的本真脆性和缺乏抗菌性, 常常导致植入失败。 因此, 开发一种耐磨性好且抑菌性优的促成骨功能涂层成为当前急需要解决的难题。 研究目的在于在钛表面制备耐磨性好且抑菌性优的促成骨功能涂层, 初步探讨了涂层的抗菌离子缓释规律和生物活性。 开拓性地在工业纯钛表面制备了明胶、 银和镁离子改性的羟基磷灰石(Mg-Ag-HA/明胶)抗菌涂层。 将银(Ag)引入羟基磷灰石涂层(HA)以改善其抗菌性能, 镁(Mg)作为第二元素以提高生物相容性, 明胶可以同时提高HA的生物相容性和力学性能。 ICP-MS测定涂层中镁和银元素的释放量和可持续性。 所得到的新型Mg-Ag-HA/明胶的SEM结果、 Ca/P比值、 化学特征峰和晶相通过FTIR, SEM, EDAX和XRD进行表征。 结果表明: 明胶的羧基与HA的钙离子之间已形成Ca—COO化学键, 明胶和Mg-Ag-HA构成了有机-无机复合涂层; Mg和Ag元素被成功地引入到了HA晶格中, 且分布均匀。 模拟体液浸泡后, Mg-Ag-HA/明胶涂层试样表面有新的缺钙型的HA生成, 且球形磷灰石中检测到新的Mg, Na和Cl元素; 结果表明, 新型复合涂层样品具有良好的生物活性。 SEM和LSCM实验结果观察发现, 小鼠颅骨成骨细胞在Mg-Ag-HA/明胶上粘附良好, 细胞伸展大量伪足, 未见细胞毒性。 明胶的加入大大降低了复合镀层中Mg2+和Ag+的释放速率, 提高了复合镀层的生理稳定性, 为镀层保持长期抗菌功能提供了保证。 Mg-Ag-HA/明胶作为钛基涂层材料具有良好的抗菌离子释放能力和优异的生物相容性, 为新型抗感染外科植入体的研发提供了新思路。
Fourier transform infrared spectroscopy (FTIR) has the advantages of a low test sample requirement, high sensitivity to characteristic groups and simple sample preparation and analysis. Inductively coupled plasma mass spectrometry (ICP-MS) is important because of its high detection rate sensitivity to trace elements, low detection limit and ability to analyse multiple elements simultaneously. Synergistically, the use of FTIR and ICP aids in the rapid identification of chemical elements and groups of functional medical materials, thereby providing new design ideas and theoretical basis for the development of bionic medical antibacterial materials. Hydroxyapatite (HA) is used in thin film materials because of its excellent bone conduction and osteoinductive properties. Titanium-implanted surface HA film is currently in the clinical application stage, but the brittleness and lack of antibacterial properties of HA often lead to implant failure. Thus, a bone-promoting functional coating with good wear resistance and excellent bacteriostasis must be developed to address these limitations. This paper presents a method for preparing a bone-promoting coating on the surface of titanium with good abrasion resistance and excellent bacteriostasis. The antibacterial ion sustained release law and biological activity of the coating were studied. For the first time, a gelatin, silver (Ag) and magnesium (Mg) ion-modified hydroxyapatite (Mg-Ag-HA/gelatin) antibacterial coating was prepared on the surface of industrial pure titanium. Ag was introduced into the HA coating to improve its antibacterial properties, while Mg was added to improve the biocompatibility of industrial pure titanium. Gelatin could simultaneously improve the biocompatibility and mechanics of HA. The release and sustainability of Mg and Ag in the coating were determined using ICP-MS. Morphology, Ca/P, chemical structure and crystal structure of deposited Mg-Ag-HA/gelatin were characterized using FTIR, scanning electron microscopy, electron diffraction spectroscopy and X-ray diffraction. Results showed that a Ca-COO chemical bond formed between the carboxyl group of gelatin and the calcium ion of HA. Gelatin and Mg-Ag-HA formed an organic-inorganic composite coating, and Mg and Ag were successfully introduced and evenly distributed into the HA lattice. After simulated body fluid immersion, a new calcium-deficient HA was formed on the surface of the Mg-Ag-HA/gelatin-coated samples, and new Mg, Na and Cl were detected in the spherical apatite. Results showed that the new composite coating has good biological activity. SEM and laser confocal experiments showed that mouse MC3T3-E1 cells adhered well on the film and had good morphology. The composite coating did not manifest cytotoxicity. The addition of gelatin greatly reduces the release rate of Mg2+ and Ag+ in the composite coating, improves the physiological stability of the composite coating and guarantees the long-term antibacterial function of the coating. As a titanium-based coating material, Mg-Ag-HA/gelatin has good antibacterial ion release ability and excellent biocompatibility, which provides a new idea for the development of new anti-infective surgical implants.
虽然商业纯钛(CP-Ti)及其合金被广泛应用于牙科和整形外科, 但是它们只表现出有限的生理稳定性和骨整合能力, 大量研究发现其植入体内后经常会因感染导致植入松动等术后并发症[1, 2, 3]。 解决这些问题需要改善钛表面的综合性能。 羟基磷灰石(HA)与人体牙齿和骨骼的无机成分近似, 因其优异的骨传导和骨诱导特性被用于薄膜材料, 钛植入表面HA薄膜已进入临床应用阶段[1]。 但是, HA涂层具备优异成骨活性的同时, 给细菌的滋生和粘附提供的天然的温床, 极易在植入体表面形成生物膜而引发炎症, 造成植入体脱落, 从而导致植入失败 [2]。 据文献报道, 由人工假体引发的感染中, 45%的原因是植入假体与人体接触时, 涂层材料表面首先会形成蛋白类薄膜, 这层蛋白膜为细菌的滋生繁殖提供了有利条件, 使得HA涂层失去骨整合的能力而导致植入体发生松动 [3]。 此外, HA差的耐磨性和低的断裂韧性仍难以满足天然骨组织的机械性能要求, 阻碍了其作为膜层材料在主要承载设备上的临床应用 [4]。 再者, 虽然有公认的骨传导性能, 但由于人工HA与自然骨存在一定的差异(如缺少成骨微量元素和胶原等), 其诱导间充质干细胞分化以及诱导新骨生成能力仍然存在争议, 需要进一步提高HA涂层的生物学性能。 因此开发一种耐磨性好且抑菌性优的促成骨功能涂层成为当前急需要解决的难题 [5]。
明胶作为无毒、 免疫原性低的可降解生物材料, 可以诱导细胞的粘附和增殖、 表现出优异的细胞相容性, 作为胶原的水解产物, 其与胶原一起被广泛用于医用材料领域 [6]。 天然的骨间质是由纳米级低结晶的磷灰石和少量碳酸钙与胶原纤维有机组合而成的三维结构。 基于仿生学的观点, HA和明胶的恰当组合, 可以在一定程度上模拟自然骨的成分和形态, 从而综合改善HA的机械性能和骨诱导活性 [7]。 银作为广谱抗菌金属、 极具潜力、 且几乎无耐药性, 而将Ag离子取代Ca离子掺入HA的晶格后, AgHA依然表现出优异的抑菌活性 [2]。 近些年, AgHA逐渐成为抗菌涂层的研究热点 [3]。 Mg离子可诱导骨细胞伪足的延伸, 诱导ALP和GLa蛋白等成骨分化标志物的合成, 同时整合素、 转录因子Dlx5、 骨涎蛋白的表达也显著增加 [8]。 掺镁HA可以提高转录因子Runx2、 碱性磷酸酶、 骨桥蛋白在成骨细胞中的表达, MgHA具备优异的细胞形容性 [9]。
综上, 我们可以充分利用上述三种成分各自的优点, 设计耐磨性好且抑菌性优的促成骨功能涂层, 相关研究目前尚未见报道。 本工作尝试合成一种新的生物相容性、 抗感染性的MgAgHA/明胶仿生生物复合涂层, 并采用FTIR, ICP-MS, SEM, EDS, XRD和激光共聚焦等技术对涂层的表观形貌、 理化性能进行表征; 对复合涂层表面MC3T3-E1细胞的生物学特性以及成骨和粘附能力进行了研究, 以探讨该涂层材料在抗菌植入领域的可行性。
采用CP-Ti(纯度99.98%)作为基板材料。 其尺寸为10 mm× 10 mm× 1 mm的方片。 首先, 用240#— 1200#的金相砂纸对其表面进行抛光处理。 然后, 用10%的盐酸, 10%的硝酸和80%的H2O组成的溶液对样品进行蚀刻, 以创造一个粗糙的表面。 用无水乙醇、 丙酮和去离子水对样品分别进行超声清洗, 每次10 min [5]。 将2.2× 10-2 mol· L-1 Ca(NO3)2, 2.5× 10-2 mol· L-1 NH4H2PO4, 1× 10-2 mol· L-1 AgNO3和1× 10-2 mol· L-1 Mg(NO3)2溶解于1 L烧杯中。 然后在上述电解液中加入1 g明胶, 恒温60 ℃水浴磁力搅拌1 h, 超声10 min, 调节溶液的pH为4.4。 单纯HA涂层作为对照组。 实验主设备为天津兰立科高技术有限公司的LK2005 A型电化学工作站, 烧杯中加入150 mL的沉积液, 25 mm× 25 mm× 0.1 mm的Pt为阳极, CP-Ti为阴极, 两个电极距离1 cm, 单电流阶跃模式进行电解沉积, 涂层的制备过程需要在65 ℃、 恒电流密度为0.9 mA· cm-2条件下持续30 min。
采用SEM(JEOL JSM-7500F)观察样品表面形貌并用EDS(Max20 EDAX)对样品进行成分分析; 采用D/Max-2500型X-射线衍射仪检测涂层的晶体特性, Cu靶(40 mA, 40 kV) λ =0.154 06 nm, 步长为0.06° 。
采用Nicolet iS5型FTIR仪对Mg-Ag-HA/明胶的基团振动峰进行分析; 将刮下的涂层与KBr按照1:100的比例混合压片, 扫描范围: 4 000~500 cm-1; 分辨率常规设定为4 cm-1, 扫描叠加16次。
为了检测Mg2+和Ag+的缓释规律, 37 ℃下, 将Mg-Ag-HA/明胶涂层静态浸泡在盛有2 mL磷酸盐缓冲液(PBS)的24孔板中, 分别放置1, 7和14 d等不同的时间段。 每天, 溶液都需要收集并且重新换置2 mL新鲜的PBS溶液, 采用电感耦合等离子体质谱(ICP-MS, 7700, Agilent Technologies Inc, USA)法对涂层中释放的Mg和Ag的浓度进行实时监测。
将6.547 g NaCl, 2.268 g NaHCO3, 0.373 g KCl, 0.358 g Na2HPO4· 12H2O, 0.305 g MgCl2.6H2O, 0.278 g CaCl2, 0.071 g Na2SO4和6.057 g(CH2OH)3CNH2依次溶解到1 000 mL去离子水中, 制备模拟体液(SBF)。 而后在37 ℃下调节溶液的pH值为7.40。 沉积的样品用去离子水洗涤后干燥, 然后放入制备的SBF中, 溶液在36.5 ℃恒温下每隔1 d更换一次, 5 d后取样。
在加有10%的胎牛血清、 10 μ g· mL-1的链霉素(In-vitrogen)和10 μ g· mL-1的青霉素的基本培养基(α -MEM)中培育MC3T3-E1成骨细胞。 将样品置120 ℃的水蒸汽中灭菌20 min, 并在每个样本上接种成骨细胞密度为1× 105 cells· mL-1。 细胞培养1 d后, 观察细胞形态。 取出样本, 用PBS缓冲液漂洗钛片, 吸弃PBS, 加入2.5%戊二醛在4 ℃下固定3 h。 用PBS替换戊二醛, 系列梯度乙醇溶液对细胞进行脱水。 用二氧化碳对样品进行临界点干燥, 涂层表面喷金处理, FE-SEM观察细胞形态。 MC3T3-E1接种后3 d, 用浓度为4% 多聚甲醛溶液将MC3T3-E1固定于试样表面, 用Triton X-100打孔15 min, 对MC3T3-E1的骨架(用鬼笔环肽染为红色)和核(用DAPI染为蓝色)。 最后, 用Confocal microscopy技术对MC3T3-E1的粘附特性进行拍照观察。
SEM结果见(图1), 实验组(HA)及对照组(Mg-Ag-HA/明胶)表面均未见明显裂纹。 HA薄膜具有均匀针状和蔟晶形态, 这些晶体融合在一起形成微孔结构, 且分布均匀[图1(a)]。 当引入Mg和Ag离子和明胶以后, 复合涂层的磷灰石晶粒变为紧凑的片状[图1(c)], 晶粒呈团簇状分布[图1(b)], 孔隙分布更显致密, 但明胶的引入导致涂层分布不均匀[图1(b)][7]。 目前普遍认为可能由于电解质中晶体结构中Mg2+引入, 使得HA晶体的生长受限, 从而导致的导致一个相对较低的孔径 [10]。 根据图1(b)中所示的Mg-Ag-HA/明胶涂层的横截面形貌, 涂层为厚度约10 μ m均匀薄膜, 界面处未见分层和/或开裂, 结合强度良好。
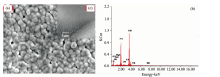
图2(b)为Mg-Ag-HA/明胶复合涂层的EDS能谱图, 表明涂层中含有Mg, Ag, P, Ca, C及O元素, 其中(Mg+Ag+Ca)/P的原子量比约为1.31, Mg的质量分数约为1.21 Wt%, Ag的质量分数约为2.94 Wt%, 表明实验得到的薄膜为缺钙型Mg和Ag离子共修饰HA复合涂层。 图2(c)示出了MgAgHA/明胶复合物的EDS扫描结果。 所有元素均匀地分布在膜中, 表明镁和银元素均匀地掺杂到HA的晶体结构中。
 | 图2 Mg-Ag-HA/明胶涂层的EDS能谱图(a和b); Mg-Ag-HA/明胶涂层EDS能谱面扫描图(c)Fig.2 (a, b) EDS spectra of the Mg-Ag-HA/gelatin coating; (c) EDS mapping of the Mg-Ag-HA/gelatin coating |
图3为Mg-Ag-HA/明胶涂层的XRD图谱。 与JCPDS 09-0432标准HA衍射图谱相比, 观察到特征性HA衍射峰和基底Ti衍射峰, 没有观察到其他的相衍射峰。 涂层在(002)晶面出现了择优生长, 且结晶度较好[10], 与Chang[11]等的研究结果一致, 说明明胶具有能诱导能HA成核的基团, 提高Mg-Ag-HA结晶度。 且电解沉积法在Ti表面涂覆HA薄膜时通常会垂直于Ti表面, 即沿着(002)晶面择优生长。 XRD 图谱中未见明显的明胶的衍射峰, 可能是因为明胶为弱结晶物质而无法检测到。
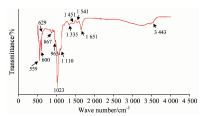
图4为Mg-Ag-HA/明胶涂层的傅里叶变换红外光谱。 涂层中可见HA化学基团的振动峰[2], 如3 443 cm-1表征HA中OH— 的伸缩振动吸收峰; 629 cm-1为— OH的摆动振动峰[2]。 600和559 cm-1对应PO4的ν 4振动吸收峰; 963 cm-1对应PO4的ν 1振动吸收峰; 1 020和1 109 cm-1为PO4的ν 3振动吸收峰 [12]。 867和1 451 cm-1为C
明胶是基于多肽构成的有机物, 酰胺Ⅰ 带(1 651 cm-1)和酰胺Ⅱ 带(1 541 cm-1)特征吸收峰表明, 明胶掺入到了复合涂层中[11]。 图3中, 涂层中含有明胶和HA的特征性化学基团振动吸收光谱, 且无机和有机相之间形成了化学键。 如1 335 cm-1对应的吸收峰表示来自明胶的羧基与HA的钙离子之间已形成Ca— COO化学键。 研究表明[11]: 明胶的氨基酸成分里富含羧酸根负离子, 在适当温度条件下, 能与羟基磷灰石的钙离子形成化学键, 诱导羟基磷灰石的成核和生长, 利于复合材料的自组装和生成。 这一结论与SEM的分析一致。 通过分析FTIR, SEM, EDS和XRD的表征结果表明, 采用经济高效、 低碳环保的电沉积技术, 成功地将无机离子和有机化合物掺杂入HA薄膜, 在CP-Ti表面成功制备出结晶度好, 生长有序的仿生Mg-Ag-HA/明胶复合涂层。
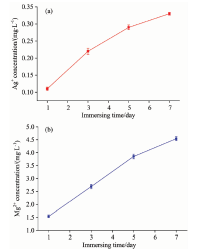
图5为样品在PBS中浸泡7 d的Mg2+和Ag+离子释放结果。 结果表明Mg-Ag-HA/明胶结构的离子释放缓释动力学显示无突然释放现象。 从材料表面缓慢释放的Ag+可通过静电力吸附在负电荷细菌的细胞壁上, 阻断跨膜电子传递, 并通过与— SH结合破坏酶蛋白的活性。 接着Ag+从细菌尸体中游离出来, 再与其他细菌结合达到循环杀菌的效果[3, 4]。 因此, 采用Ag+抗菌几乎无耐药性现象, 其广谱抗菌能力表现为可以高效地灭活细菌、 真菌和病毒等各类微生物 [3, 4]。 研究表明 [1, 2], 虽然Ag+对微生物的毒性强, 但低浓度时对人体细胞相对安全 。 与此同时, Mg2+离子的释放可以增加涂层的细胞相容性, Mg2+作为生物活性元素可以有效地抵消Ag+可能潜在的细胞毒性[13]。 而对照组HA的Mg和Ag浓度几乎持续为0, 可忽略不计。
在SBF中浸泡5 d后, Mg-Ag-HA/明胶涂层表面被新的差异显著的磷灰石覆盖, 且在复合试样表面呈球状集聚生长, 模拟体液浸泡后试样表面的磷灰石聚集越来越密集, 见图6(a), 同时可以发现, 球状聚集的磷灰石层是由细针状的羟基磷灰石晶体层层交错堆积而成的[14]。 图6(b)是模拟体液浸泡5 d后Mg-Ag-HA/明胶试样表面涂层的EDS 能谱图, 计算其Ca/P比分别是1.3, 比较Ca10(PO4)6(OH)2的化学计量比1.67, 可见钛基体上沉积的是缺钙型HA[14]。 此外, 在球形磷灰石中检测到新的Mg, Na和Cl元素。
 | 图6 Mg-Ag-HA/明胶经SBF浸泡后的扫描电子显微镜图(a和c)和EDS能谱图(b)Fig.6 SEM images (a and c) and EDS (b) spectrum of the Mg-Ag-HA/gelatin coatings after immersed in SBF |
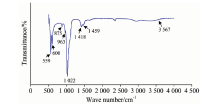
Mg-Ag-HA/明胶在SBF中浸泡5 d后, 其FTIR结果如图7(a, b), 波数1 022和963 cm-1为P
骨整合和成骨细胞分化的关键首先是其在陶瓷表面的附着特性[15]。 图8(a)是MC3T3-E1细胞在Mg-Ag-HA/明胶上培养1 d后, 通过SEM观察细胞的粘附能力。 结果表明细胞紧紧贴附于涂层表面并表现出典型的细胞呈梭形或多边形成骨细胞表型, 丝状伪足附着在材料孔壁上, 部分细胞还伸展出板状伪足, 胞质在板状伪足之间扩展或完全伸展 [15]。 接种3 d后涂层上的细胞的形态如图8(b)所示。 附着细胞呈伸长并均匀铺展的状态。 F-肌动蛋白丝在许多不同方向上的延伸, 表明涂层具有良好的细胞相容性[15]。 复合生物涂层材料为细胞向成骨分化的提供了微环境和促成骨的Mg元素和明胶[6, 7, 8, 9]。
多功能复合材料的表面应当具备长效的抗菌性能和生物相容性, 是目前替代硬组织替换的理想生物材料。 研究表明, Mg-Ag-HA/明胶抗菌涂层的开发满足了上述多功能性的要求。 FTIR, XRD, SEM和EDX的结果证实了Mg-Ag-HA/明胶涂层的形成。 得到的涂层形貌完全无裂纹、 致密, 但分布不均。 Mg和Ag离子均匀地掺杂到了Mg-Ag-HA/明胶复合涂层中。 SBF浸泡结果显示, Mg-Ag-HA/明胶可以在5天内诱导新的类骨磷灰石形成, 表明其生物活性优异。 小鼠颅骨成骨细胞在Mg-Ag-HA/明胶上未见细胞毒性。 涂层中持续的Mg和Ag离子释放, 为其植入体内后具备长期的骨诱导性和抗菌性成为可能。 本实验旨在为研发仿生抗感染骨修复薄膜提供多方位的设计思路和实验依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|