作者简介: 张 鹏, 1992年生, 吉林农业大学资源与环境学院硕士研究生 e-mail: 737769155@qq.com
探明土壤磷素的存在形态, 有助于揭示其在环境中的累积、 迁移和转化过程及生物有效性。 目前, 在大尺度样带上开展土壤磷素形态空间变异规律的研究较少。 本研究中, 沿纬度方向采集了我国东部不同气候带分布的7种地带性林地土壤(包括寒温带的棕色针叶林土、 中温带的暗棕壤、 暖温带的棕壤、 北亚热带的黄棕壤、 中亚热带的黄壤、 南亚热带的赤红壤和热带的砖红壤), 将化学浸提法与溶液磷-31核磁共振(31P NMR)波谱法相结合, 分析了土壤中磷素形态以及与其他土壤性质之间的关系, 以期为阐明土壤磷素形态的空间变异性及其驱动因素提供基础资料。 结果表明: 供试土壤中, 全磷、 有效磷、 无机磷和有机磷的含量范围分别为179.8~825.2, 2.41~15.3, 92.6~351.2和14.7~474.4 mg·kg-1, 其中活性、 中等活性、 中等稳定性和高稳定性有机磷组分的含量范围分别为1.38~30.9, 8.63~213.7, 3.01~32.2和1.73~199.2 mg·kg-1。 根据溶液31P NMR波谱, 鉴定出供试土壤中含有无机形态的磷素即正磷酸盐和焦磷酸盐, 同时也鉴定出了磷酸单酯、 磷酸二酯和膦酸盐等有机形态磷素的存在, 其中磷酸单酯中又鉴定出了新-肌醇六磷酸、 D-手性-肌醇六磷酸、 RNA单核苷酸、 α-磷酸甘油、 肌-肌醇六磷酸、 β-磷酸甘油和鲨-肌醇六磷酸, 磷酸二酯中又鉴定出了DNA的存在; 所有土壤中均未检测出多聚磷酸盐的存在, 除棕色针叶林土和暗棕壤外的其他土壤中未检测出膦酸盐的存在, 而赤红壤中未检测出DNA的存在; 无机形态的磷素以正磷酸盐为主, 而有机形态的磷素则以磷酸单酯为主。 总体来看, 无论化学浸提法还是溶液31P NMR波谱法, 从寒温带的棕色针叶林土到热带的砖红壤, 全磷、 有效磷、 无机磷、 有机磷及其组分的含量均呈现下降趋势。 溶液31P NMR波谱与化学浸提法鉴定的磷素形态之间存在相关关系, 其中正磷酸盐与活性有机磷的关系最为密切, 磷酸单酯和膦酸盐与中等活性有机磷的关系最为密切, 而焦磷酸盐和磷酸二酯与中等稳定性有机磷的关系最为密切。 与化学浸提法相比, 溶液31P NMR波谱法能从详细的分子水平上揭示土壤磷素形态的空间变异规律。
Understanding the forms of phosphorus present in soil is important for elucidating its accumulation, migration, transformation, and bioavailability in the environment. At present, however, studies on the spatial variability of different forms of phosphorus in soil across large-scale transects are rare. In the present study, seven zonal forest soils from sites across different climatic zones were collected along a latitudinal transect in eastern China. The soils used included brown coniferous forest soil from the cold temperate zone, dark brown soil from the middle temperate zone, brown soil from the warm temperate zone, yellow brown soil from the northern subtropical zone, yellow soil from the middle subtropical zone, lateritic red soil from the southern subtropical zone, and latosol from the tropical zone. A chemical extraction method was combined with solution phosphorus-31 nuclear magnetic resonance (31P NMR) spectroscopy to analyze the phosphorus forms present in the soils and determine their relationships with other soil properties. The concentrations of total phosphorus, available phosphorus, inorganic phosphorus, and organic phosphorus in the tested soils ranged from 179.8 to 825.2, 2.41 to 15.3, 92.6 to 351.2, and 14.7 to 474.4 mg·kg-1, respectively. The concentrations of four organic phosphorus components (i. e., active, moderately active, moderately stable, and highly stable organic phosphorus) obtained through continuous chemical extraction were 1.38~30.9, 8.63~213.7, 3.01~32.2, and 1.73~199.2 mg·kg-1, respectively. According to solution31P NMR spectra, both inorganic (i. e., orthophosphate and pyrophosphate) and organic (i. e., phosphomonoester, phosphodiester, and phosphonate) forms of phosphorus were identified in the test soils. Moreover, neo-inositol hexakisphosphate, D-chiro-inositol hexakisphosphate, RNA mononucleotides, α-glycerophosphate, myo-inositol hexakisphosphate, β-glycerophosphate and scyllo-inositol hexakisphosphate in phosphomonoesters and deoxyribonucleic acid in phosphodiesters were also identified. In all the tested soils, polyphosphate was not detected. Phosphonate was not detected in the soils except in brown coniferous forest soil and dark brown soil, whereas deoxyribonucleic acid was not detected in lateritic red soil. Inorganic phosphorus was dominated by orthophosphate, while organic phosphorus was dominated by phosphomonoester. In general, regardless of whether chemical extraction or solution31P NMR spectroscopy, the concentrations of total phosphorus, available phosphorus, inorganic phosphorus and organic phosphorus and its fractions tended to decrease from brown coniferous forest soil in the cold temperate zone to latosol in the tropical zone. There was a correlation between phosphorus forms identified using solution31P NMR spectroscopy and those identified using chemical extraction method. Orthophosphate was most closely related to active organic phosphorus; phosphomonoester and phosphonate were most closely related to moderately active organic phosphorus; and pyrophosphate and phosphodiester were most closely related to moderately stable organic phosphorus.31P NMR spectroscopy is a more effective method than chemical extraction to understand the spatial variability in soil phosphorus at a detailed molecular level.
磷是植物必需的营养元素之一, 而土壤是植物磷素的主要来源。 土壤磷素对于植物的有效性主要取决于其在土壤中的存在形态, 因此探明土壤磷素的存在形态是阐明其在环境中迁移、 转化和累积过程以及生物有效性的关键。 目前, 测定土壤磷素形态的方法主要有化学浸提法、 红外光谱、 拉曼光谱、 溶液磷-31核磁共振(31P NMR)波谱法等[1]。 与其他常规磷素形态分析方法相比, 31P NMR波谱分析具有样品前处理简单、 分析破坏性小及组分分辨完全等优点, 近年来已被广泛用于土壤磷素形态的研究[2, 3]。 但目前, 在大尺度样带上, 利用31P NMR波谱法开展土壤磷素形态空间变异规律的研究尚少见报道。 此外, 31P NMR波谱法与化学浸提法测得的磷素形态之间的内在联系也尚不清楚。
本研究以我国不同气候带分布的几种地带性林地土壤为研究对象, 将化学连续浸提法与溶液31P NMR波谱分析相结合, 分析土壤中磷素形态以及与其他土壤性质之间的关系, 以期为阐明土壤磷素的空间变异性及其驱动因素提供基础资料。
供试土壤为采自我国东部不同气候带的7种地带性林地土壤, 包括棕色针叶林土(寒温带)、 暗棕壤(中温带)、 棕壤(暖温带)、 黄棕壤(北亚热带)、 黄壤(中亚热带)、 赤红壤(南亚热带)和砖红壤(热带), 采样深度为表层0~20 cm(去除枯枝落叶层)。 上述土壤的基本情况如表1所示。
土壤全磷用酸溶-钼锑抗比色法测定, 有效磷用NaHCO3浸提-钼锑抗比色法测定, 有机磷总量采用烧灼法测定, 有机磷形态分级采用连续浸提法[4]。 溶液31P NMR分析样品的预处理方法如下: 风干土样用0.25 mol· L-1 NaOH+0.05 mol· L-1 Na2EDTA混合液振荡浸提16 h(土:液比1:10), 吸取部分离心(10 000 r· min-1, 30 min)后的浸提液, 用Thermo Scientific iCAP6300电感耦合等离子体发射光谱仪测定全磷含量, 其余浸提液冷冻干燥并保存在密封的样品瓶中。 31P NMR分析前, 将冻干的样品重新溶于0.25 mol· L-1 NaOH溶液中, 离心(8 000 r· min-1, 5 min)后转移上清液至5 mm核磁样品管内, 滴加0.05 mL D2O, 摇匀待测。 31P NMR波谱用Bruker AVANCE III HD 500核磁共振波谱仪测定, 共振频率202.5 MHz, 脉冲时间13.0 μ s, 采样时间0.4 s, 循环延迟时间3.0 s, 扫描15 000次。 半定量分析采用MestReNova 5.3.1软件。
| 表1 供试土壤的基本情况 Table 1 Basic information of the soils used in this experiment |
总体来看, 从寒温带的棕色针叶林土到热带的砖红壤, 土壤全磷、 有效磷、 无机磷和有机磷含量均呈下降趋势(表2)。 以往研究发现, 从寒温带到热带, 我国主要森林类型凋落叶片的磷含量趋于降低[5]。 凋落叶片是森林土壤磷素的主要来源, 这解释了本研究中土壤磷素沿气候带的变化规律。 除暗棕壤外, 其他类型土壤中无机磷含量均高于有机磷含量。 不同类型土壤相比, 暗棕壤和棕色针叶林土的全磷、 有效磷、 无机磷和有机磷含量均高于其他类型土壤。 土壤有机磷组分中, 棕色针叶林土中活性有机磷的含量最高, 而暗棕壤的中等活性、 中等稳定性和高稳定性有机磷含量最高, 赤红壤中活性、 中等活性、 中等稳定性及高稳定性有机磷的含量都低于其他类型土壤。
| 表2 不同地带性土壤中全磷、 有效磷、 无机磷和有机磷的含量(mg· kg-1) Table 2 Contents of total phosphorus (P), available P, inorganic P and organic P in different zonal soils |
土壤有效磷、 无机磷和有机磷分别占全磷的1.17%~5.28%, 42.5%~91.9%和8.08%~57.5%, 其中赤红壤中无机磷占全磷的91.9%, 而暗棕壤中有机磷则占到了全磷的57.5%。 从土壤有机磷组分占有机磷总量的比例来看, 活性、 中等活性、 中等稳定性和高稳定性有机磷分别占有机磷总量的6.18%~15.1%, 31.8%~58.7%, 2.29%~21.4%和11.8%~51.2%, 这些有机磷组分的比例分别以黄壤、 赤红壤、 黄棕壤和棕色针叶林土最高; 同一类型土壤中, 棕色针叶林土、 黄壤和砖红壤中, 高稳定性有机磷所占比例(39.8%~51.2%)最高; 暗棕壤、 棕壤、 黄棕壤和赤红壤中, 中等活性有机磷所占比例(45.0%~58.7%)最高。
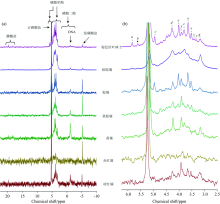
从供试土壤的溶液31P NMR波谱(图1)来看, 赤红壤31P NMR谱图的分辨率较其他类型土壤的低, 这一方面可能与赤红壤的有机磷含量(14.7 mg· kg-1)较低有关, 另一方面也可能是由于赤红壤中含有较多高分子量(> 10 kDa)组分的缘故[6]。 根据溶液31P NMR波谱, 可以鉴定出供试土壤中所含的无机和有机形态的磷素。 无机形态的磷素包括正磷酸盐(5.5~5 ppm)和焦磷酸盐(-5~-5.9 ppm); 有机形态的磷素包括磷酸单酯(5.9~5.5 ppm, 5~2.5 ppm)、 磷酸二酯(2.5~-1.8 ppm)和膦酸盐(17.5~20 ppm), 其中磷酸单酯中又可鉴定出新-肌醇六磷酸(5.8 ppm)、 D-手性-肌醇六磷酸(5.6 ppm)、 RNA单核苷酸(4.9, 3.8, 3.4和3.3 ppm)、 α -磷酸甘油(4.3 ppm)、 肌-肌醇六磷酸(4.0, 3.6和3.5 ppm)、 β -磷酸甘油(3.9 ppm)和鲨-肌醇六磷酸(3.2 ppm), 磷酸二酯中又可鉴定出DNA(-1.1 ppm)的存在[6]。 一般认为, α -和β -磷酸甘油可能主要来自于土壤中磷脂的碱水解, 而单核苷酸则可能主要源于RNA的碱水解[6]。 值得注意的是, 所有土壤中均未检测出多聚磷酸盐的存在, 而赤红壤中未检测出DNA的存在。 Gatiboni等[7]利用溶液31P NMR波谱的研究发现, 长期施用化肥的土壤(巴西的典型薄层正常氧化土)中也未检测出DNA的存在。 此外, 除棕色针叶林土和暗棕壤外, 其余6种土壤中均未检测出膦酸盐存在, 其原因可能与这些土壤中缺乏含有膦酸酶的细菌有关[8]。
半定量分析结果(表3)表明, NaOH-EDTA提取物的总磷含量为13.3~741.3 mg· kg-1, 相应的回收率(即占土壤全磷的比例)为7.33%~89.8%。 与灼烧法测定的有机磷(表2, 图1)相比, NaOH-EDTA提取的有机磷量通常较高, 说明其对于有机磷具有更高的提取效率, 这与以往的研究结果[3]相一致。 相关分析结果(表4)发现, NaOH-EDTA提取物总磷与灼烧法测定的有机磷之间存在显著(p< 0.01)的线性相关。 NaOH-EDTA提取物中, 棕色针叶林土、 暗棕壤、 黄壤和砖红壤的磷素形态均以有机磷为主, 分别占提取物总磷的54.8%, 86.8%, 64.7%和61.5%; 而棕壤、 黄棕壤和赤红壤的磷素形态则以无机磷为主, 分别占提取物总磷的60.8%, 54.4%和56.5%。 总体来看, 从寒温带的棕色针叶林土到热带的砖红壤, NaOH-EDTA提取物的总磷、 无机磷和有机磷含量均呈下降趋势, 这与前述化学分析(表2)结果基本一致。
| 表3 不同地带性土壤NaOH-EDTA浸提物中磷化合物的含量(mg· kg-1)和相对比例(%) Table 3 Contents (mg· kg-1) and relative proportions (%) of phosphorus compounds in NaOH-EDTA extracts of different zonal soils |
无机形态的磷素中, 正磷酸盐含量明显高于焦磷酸盐, 前者以棕色针叶林土最高而赤红壤最低, 分别占浸提物总磷的44.4%和49.0%; 后者则以暗棕壤最高而赤红壤最低, 分别占浸提物总磷的1.51%和7.48%(表3)。 一般认为, 土壤焦磷酸盐主要来源于微生物[9], 由此可以推测暗棕壤中微生物量较高而赤红壤中则较低, 这与土壤微生物量沿气候带的变化趋势[10]是相似的。
有机形态的磷素中, 磷酸单酯的含量最高, 其次为磷酸二酯, 而膦酸盐的含量最低(表3)。 一般认为, 磷酸单酯对微生物分解具有较强的抵抗能力, 因此容易积累在土壤中[11]。 无论磷酸单酯、 磷酸二酯还是膦酸盐, 其含量都是以暗棕壤最高。 以往的研究表明, 土壤中单酯磷/二酯磷比值范围在1~20之间[12], 该比值能够反映有机磷组分的相对降解和迁移情况[13]。 本研究中, 供试土壤的单酯磷/二酯磷比值在2~14之间, 该比值沿气候带从北至南趋于降低, 说明磷酸单酯更容易积累于温带地区土壤中, 而磷酸二酯则相对容易积累在亚热带和热带土壤中。
此外, 我们进一步对部分磷酸单酯及二酯组分进行了半定量分析(图2), 发现α -磷酸甘油、 鲨-肌醇六磷酸的含量通常高于新-肌醇六磷酸与D-手性-肌醇六磷酸的总含量, 前两者分别占浸提物总磷的0~13.0%(赤红壤中未检测到α -磷酸甘油存在)和3.29%~11.7%, 而后者则占浸提物总磷的0.09%~3.00%; 同时, DNA占浸提物总磷的比例以黄壤最高(14.1%)。 一般认为, 新-肌醇六磷酸与D-手性-肌醇六磷酸来自于微生物合成作用[14], 暗棕壤中这些肌醇六磷酸的含量较高, 进一步证实了该土壤具有较高的微生物量。
从溶液31P NMR波谱与化学浸提法鉴定的磷素形态之间的关系(表4)来看, 活性有机磷与中等活性有机磷、 高稳定性有机磷、 NaOH-EDTA提取物总磷、 正磷酸盐、 磷酸单酯和膦酸盐之间呈显著正相关; 中等活性有机磷与中等稳定性有机磷、 高稳定性有机磷、 NaOH-EDTA提取物总磷、 焦磷酸盐、 磷酸单酯、 磷酸二酯和膦酸盐之间呈显著正相关; 中等稳定性有机磷与NaOH-EDTA提取物总磷、 焦磷酸盐、 磷酸单酯、 磷酸二酯和膦酸盐之间呈显著正相关; 高稳定性有机磷与NaOH-EDTA提取物总磷、 正磷酸盐、 磷酸单酯、 磷酸二酯和膦酸盐之间呈显著正相关; NaOH-EDTA提取物总磷与磷酸单酯、 磷酸二酯和膦酸盐之间呈显著正相关; NaOH-EDTA提取物中焦磷酸盐与磷酸单酯、 磷酸二酯和膦酸盐之间呈显著正相关; NaOH-EDTA提取物中磷酸单酯与磷酸二酯和膦酸盐之间呈显著正相关; NaOH-EDTA提取物中磷酸二酯与膦酸盐之间也呈显著正相关, 上述相关分析结果与以往的研究结果[8, 15, 16]是一致的。 Backnä s等[8]指出, 碱性提取液中部分磷酸二酯可快速降解为磷酸单酯, 从而使得两者之间存在显著正相关关系。 同时, 由相关分析结果可知, 化学连续浸提法与溶液31P NMR波谱法鉴定的磷素形态之间存在一定的相关关系, 其中正磷酸盐与活性有机磷的关系最为密切, 而焦磷酸盐、 磷酸单酯、 磷酸二酯和膦酸盐分别与中等稳定性有机磷、 中等活性有机磷、 中等稳定性有机磷和中等活性有机磷的关系最为密切。
| 表4 溶液31P NMR波谱与化学浸提法鉴定的土壤磷素形态之间的相关关系 Table 4 Pearson correlation coefficients between soil phosphorus forms identified using solution 31P NMR spectroscopy and chemical extraction method |
通过对我国东部不同气候带分布的7种地带性林地土壤中磷素形态的分析, 可以得到如下结论:
(1)总体来看, 从寒温带的棕色针叶林土到热带的砖红壤, 全磷、 有效磷、 无机磷、 有机磷及其组分的含量均呈现下降趋势。
(2)化学连续浸提法与溶液31P NMR波谱法鉴定的磷素形态之间存在相关关系, 其中正磷酸盐与活性有机磷的关系最为密切, 磷酸单酯和膦酸盐与中等活性有机磷的关系最为密切, 而焦磷酸盐和磷酸二酯与中等稳定性有机磷的关系最为密切。
(3)与化学浸提法相比, 溶液31P NMR波谱法能从详细的分子水平上揭示大尺度样带土壤磷素形态的空间变异规律。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|