作者简介: 桂 兰, 女, 1993年生, 中国科学院西北高原生物研究所硕士研究生 e-mail: guilan16@mails.ucas.ac.cn
烈香杜鹃为常用藏药, 具有止咳、 祛痰、 平喘、 清热解毒、 健胃消肿之功效, 藏医常用于治疗类风湿性关节炎, 多数为野生药材; 为有效鉴别烈香杜鹃的真伪、 产地和品质差异, 采用红外光谱法对13个不同产地的烈香杜鹃进行了红外光谱图的识别分析。 红外光谱的扫描范围为4 000~400 cm-1, 实验发现其红外光谱相似; 对红外吸收谱带归属进行判别分析, 建立了烈香杜鹃红外指纹图谱, 其特征吸收峰位于3 404, 2 921, 2 852, 1 734, 1 625, 1 449, 1 374, 1 266, 1 060和534 cm-1等处; 在1 517, 1 316, 1 161, 825, 779和594 cm-1附近, 峰数目、 峰位置与峰强度有差异。 计算共有峰率和变异峰率, 建立共有峰率和变异峰率双指标序列, 利用SPSS软件对其红外图谱数据进行聚类分析。 双指标序列分析法与聚类分析法的分析原理与角度不同, 分组结果基本一致, 表明这两种方法可靠, 可用于分析烈香杜鹃的产地与品质差异。 双指标序列分析法比较结果显示, 样品的共有峰率≥68.75, 变异峰率≤27.27, 分组结果表明, 产地接近、 气候条件与生长环境相似的烈香杜鹃之间共有峰率较高; 而产地、 气候条件与生长环境相差较大的烈香杜鹃之间变异峰率较高。 聚类分析结果显示, 当欧氏距离为15时, 可聚为三大类, R2, R3和R4为一类, R7, R8, R10, R11和R12为一类, 剩下的归为一类; 当欧氏距离为20时, 聚为两大类, R2, R3和R4为一类, 剩下的归为一类; 当欧式距离为25时, 13个产地的烈香杜鹃聚为一类。 将聚类分析结果与使用ArcGIS软件所做的烈香杜鹃采样点分布图结合起来分析, 能直观地看出烈香杜鹃品质与其产地的关系。 综合以上分析, 建立的烈香杜鹃红外指纹图谱, 结合双指标序列分析法和聚类分析法, 可以为鉴别烈香杜鹃的真伪、 产地和品质差异提供快速、 有效的新方法。
Rhododendron anthopogonoides Maxim., a traditional Tibetan ethnodrug, has been used for antitussive, expectorant, antiasthmatic, heat-clearing and detoxicating, stomachic and swelling agent for a long time, besides, it is also commonly used for treating rheumatoid arthritis. And most of them are wild. Thus, in this study, R. anthopogonoides from 13 different regions were identified in the range of 4 000~400 cm-1 by adopting infrared fingerprint (IR) in order to identify the adulterants, regions and quality of this herbal medicine effectively. Results showed that the infrared spectrum of the samples are similar. And the main IR absorption peaks of the samples were identified and assigned. Then, the fingerprint of R. anthopogonoides was established and the characteristic peaks were at 3 404, 2 921, 2 852, 1 734, 1 625, 1 449, 1 374, 1 266, 1 060, 534 cm-1. However, there were still some differences in the number, position and intensity of the characteristic peaks at 1 517, 1 316, 1 161, 825, 779, 594 cm-1. Moreover, the common peak ratio and variant peak ratio dual-indexes sequential were also calculated and established, respectively. In addition, the cluster analysis was used to analyze the fingerprint data by using SPSS software. What’s more, the grouping results of sequential analysis of dual-indexes and cluster analysis were nearly the same although the analysis principle and aspect of the two methods were different. And it was shown that the two methods are reliable and can be used to analyze the differences in regions and quality of the samples. Results also showed that the common peak ratios of the samples are ≥68.75, and the variant peak ratios are ≤27.27. The common peak ratios are higher when the samples grow in the closer regions with the similar climatic conditions and growing environments, while variant peak ratios are higher when the samples grow in the farther regions with the different climatic conditions and growing environments. The results of cluster analysis showed that when the Euclidean distance is 15, the samples can be clustered into three categories, where R2, R3 and R4 are one class, R7, R8, R10, R11 and R12 are another class, and the rest are classified into the last class. When the Euclidean distance is 20, the samplesare divided into two categories, where R2, R3 and R4 are one class, and the rest are classified into the other class. When the Euclidean distance is 25, the samples from 13 regions are grouped together. So, the relationships between the quality of R. anthopogonoides and their origins can be summarized intuitively by combining the results of cluster analysis with the figure of sampling plots’ location made with ArcGIS. To sum up, fingerprint combined with sequential analysis of dual-indexes and cluster analysis provides a new method which is effective and rapid for the identification of R. anthopogonoides with the adulterants, regions and quality.
烈香杜鹃(Rhododendron anthopogonoides Maxim.)为杜鹃花科(Ericaceae)杜鹃属(Rhododendron L.)常绿灌木。 临床药用烈香杜鹃别名小叶枇杷、 白香柴、 鬼枇杷、 野枇杷、 黄花杜鹃、 香柴, 主要分布于甘肃省、 青海省及四川省的西北部, 生长于2 900~3 700 m的高山坡、 山地林下或灌丛中[1], 含有的化学成分主要有挥发油[2, 3]、 黄酮类[4, 5]及其他类化合物[6, 7]等, 花和叶是常用的藏药材, 被大量应用于藏成药制剂中, 藏医常用于治疗培根病寒热症[8]、 肺病、 脾胃虚寒、 消化不良、 水土不服等[9], 为重要的药用植物。
红外光谱可以真实地反映中药最原始的信息, 不同产地的同一中药, 因生长环境不同所含化学成分会有所差异, 这种差异表现在红外光谱的峰形状、 峰数目、 峰位置与峰强度上。 傅里叶变换红外光谱法具有操作简便、 分析速度快、 所需样品量小、 制样简单、 重现性好和无损等优点[10]。 文献报道, 淡竹叶[11]、 黄精[12]和淡菜[13]等采用双指标序列分析方法[14]和聚类分析法对其红外指纹图谱进行了比较与识别研究。 在烈香杜鹃质量控制与品质评价中, 目前尚无结合两种方法对不同产地烈香杜鹃进行分析的相关报道。 本研究采用红外光谱法, 结合双指标序列分析法和聚类分析法对13个产地烈香杜鹃进行鉴别, 建立烈香杜鹃红外指纹图谱, 为鉴别烈香杜鹃的真伪、 产地和品质差异提供了快速、 有效的新方法。
傅里叶变换红外光谱仪(IS50, Thermo Nicolet公司); DTGS检测器; 压片机(YP-2, Specac公司); 压片模具直径13 mm(PIKE公司); 电热鼓风干燥箱101A-2B, 上海实验仪器有限公司), 万分之一天平(XS105, 梅特勒-托利多仪器有限公司), 玛瑙研钵; KBr(光谱纯, 赛默飞公司)。
根据药品标准[9], 2016年6月于青海省13个产地采集烈香杜鹃的花和叶, 原植物标本由中国科学院西北高原生物研究所梅丽娟研究员鉴定为烈香杜鹃(Rhododendron anthopogonoides Maxim.), 样品信息见表1。 取干燥的13个产地烈香杜鹃样品, 粉碎过200目筛。 经KBr压片法制成样品片, 置于红外光谱仪中, 在室温下测定红外光谱图。 红外光谱的扫描范围为4 000~400 cm-1, 每张光谱累加扫描32次, 分辨率为4 cm-1, 扫描过程中实时扣除二氧化碳和水蒸气干扰。
| 表1 样品信息 Table 1 Information of samples |
由图1可见, 13个产地烈香杜鹃红外光谱图整体峰形相似, 在3 404, 2 921, 2 852, 1 734, 1 625, 1 449, 1 374, 1 266, 1 060和534 cm-1附近均有吸收; 在1 517, 1 316, 1 161, 825, 779和594 cm-1附近, 峰数目、 峰位置、 峰形状与峰强度有较大差异。 R2在829和595 cm-1处有特征吸收, 但在779 cm-1处没有吸收; R8在829和595 cm-1处没有吸收, 但在779 cm-1处有特征吸收; R3在1 316 cm-1处有特征吸收; 可根据特征吸收峰对烈香杜鹃整体化学成分、 产地进行初步判断, 建立的红外指纹图谱可用于烈香杜鹃药材真伪、 掺假的鉴别。
烈香杜鹃主要红外吸收谱带归属见表2。 可见不同产地烈香杜鹃在黄酮类物质的羟基取代位置与数量、 取代糖的结构与数量有所差异, 因此黄酮类物质的数量有所差异。 在此基础上, 进一步探讨采用共有峰和变异峰率的计算方法, 对不同产地烈香杜鹃进行比较。
| 表2 烈香杜鹃主要红外吸收谱带归属 Table 2 The assignments of main IR absorption peaks of R.anthopogonoides |
2.2.1 共有峰的确定方法
对于一组吸收峰, 如果该组内吸收峰的波数最大差值小于该组峰与其相邻组峰之间的平均波数之差, 确定该组峰为一组共有峰, 如对1 620, 1 636, 1 640, 1 640, 1 620, 1 620, 1 620, 1 620, 1 621, 1 621, 1 620, 1 621和1 620 cm-1这一组峰, 平均波数值为1 625 cm-1, 该组峰内最大波数差为20 cm-1; 该组峰前后相邻组峰的平均波数值分别1 734和1 517 cm-1, 与其前后相邻组峰的平均波数值差分别是109和108 cm-1, 20 cm-1小于109, 108 cm-1, 可判断该组峰是一组共有峰。
2.2.2 13个产地烈香杜鹃红外指纹图谱共有峰率、 变异峰率双指标序列
根据公式[14], 计算13个产地烈香杜鹃样品之间红外指纹图谱的共有峰率和变异峰率, 建立了13个产地烈香杜鹃的双指标分析序列, 该序列可以在2+n维(n=样品数)空间中精确判断任一样品与其他样品的亲缘远近关系, 具有很强的鉴别力。 13个产地烈香杜鹃的共有峰率和变异峰率双指标序列如下:
R1: R7R10(100.00; 0.00, 0.00), R2R5R6R13(93.33; 7.14, 0.00), R9(87.50; 7.14, 7.14), R4R8(86.67; 15.38, 0.00), R11R12(81.25; 15.38, 7.69), R3(75.00; 25.00, 8.33)
R2: R5R6R13(100.00; 0.00, 0.00), R1R7R10(93.33; 0.00, 7.14), R4(92.86; 7.69, 0.00), R9(81.25; 7.69, 15.38), R3R8(80.00; 16.67, 8.33), R11R12(75.00; 16.67, 16.67)
R3: R9(86.67; 0.00, 15.38), R2R5R6R11R12R13(80.00; 8.33, 16.67), R1R7R10(75.00; 8.33, 25.00), R4R8(73.33; 18.18, 18.18)
R4: R2R5R6R13 (92.86; 0.00, 7.69), R1R7R10 (86.67; 0.00, 15.38), R9 (75.00; 8.33, 25.00), R3R8 (73.33; 18.18, 18.18), R11R12 (68.75; 18.18, 27.27)
R5: R2R6R13 (100.00; 0.00, 0.00), R1R7R10 (93.33; 0.00, 7.14), R4 (92.86; 7.69, 0.00), R9 (81.25; 7.69, 15.38), R3R8 (80.00; 16.67, 8.33), R11R12 (75.00; 16.67, 16.67)
R6: R2R5R13 (100.00; 0.00, 0.00), R1R7R10 (93.33; 0.00, 7.14), R4 (92.86; 7.69, 0.00), R9 (81.25; 7.69, 15.38), R3R8 (80.00; 16.67, 8.33), R11R12 (75.00; 16.67, 16.67)
R7: R1R10 (100.00; 0.00, 0.00), R2R5R6R13 (93.33; 7.14, 0.00), R9 (87.50; 7.14, 7.14), R4R8 (86.67; 15.38, 0.00), R11R12 (81.25; 15.38, 7.69), R3 (75.00; 25.00, 8.33)
R8: R11R12 (92.86; 0.00, 7.69), R1R7R9R10 (86.67; 0.00, 15.38), R2R5R6R13 (80.00; 8.33, 16.67), R3R4 (73.33; 18.18, 18.18)
R9: R11R12 (93.33; 7.14, 0), R1R7R10 (87.50; 7.14, 7.14), R3R8 (86.67; 15.38, 0), R2R5R6R13 (81.25; 15.38, 7.69), R4 (75.00; 25.00, 8.33)
R10: R1R7 (100.00; 0.00, 0.00), R2R5R6R13 (93.33; 7.14, 0.00), R9 (87.50; 7.14, 7.14), R4R8 (86.67; 15.38, 0.00), R11R12 (81.25; 15.38, 7.69), R3 (75.00; 25.00, 8.33)
R11: R12 (100.00; 0.00, 0.00), R9 (93.33; 0.00, 7.14), R8 (92.86; 7.69, 0.00), R1R7R10 (81.25; 7.69, 15.38), R3 (80.00; 16.67, 8.33), R2R5R6R13 (75.00; 16.67, 16.67), R4 (68.75; 27.27, 18.18)
R12: R11 (100.00; 0.00, 0.00), R9 (93.33; 0.00, 7.14), R8 (92.86; 7.69, 0.00), R1R7R10 (81.25; 7.69, 15.38), R3 (80.00; 16.67, 8.33), R2R5R6R13 (75.00; 16.67, 16.67), R4 (68.75; 27.27, 18.18)
R13: R2R5R6 (100.00; 0.00, 0.00), R1R7R10 (93.33; 0.00, 7.14), R4 (92.86; 7.69, 0.00), R9(81.25; 7.69, 15.38), R3R8(80.00; 16.67, 8.33), R11R12(75.00; 16.67, 16.67)
其中R1: R9(87.50; 7.14, 7.14)表示该序列以R1为标准计算其他样品指纹图谱的共有峰率与变异峰率, R1与R9的共有峰率为87.50, R1的变异峰率为7.14, R9的变异峰率为7.14。 R1: R7R10(100.00; 0.00, 0.00)表示R7, R10与R1的共有峰率相同, 为100.00, R7, R10与R1具有相同的变异峰率, 为0.00。
从以上序列可以看出, 在不同的序列中, 不同的共有峰率表明样品之间存在着不同的关系。 某一样品与另一样品具有相同的共有峰率时, 多数变异峰率不同, 少数变异峰率相同, 如R1: R4R8 (86.67; 15.38, 0.00), 表明R4和R8相对于R1具有相同的共有峰率, 为86.67, R4、 R8相对于R1的变异峰率不同, 分别是15.38与0.00, 此时能很好地区分R4与R8。 R1: R7R10(100.00; 0.00, 0.00)中, R7和R10相对于R1具有相同的共有峰率与变异峰率, 说明R7和R10相对于R1非常相似, 可在更深层次上做出认同或区分。 运用双指标序列分析法从共性和变异性两方面分析药材的红外指纹图谱, 可以准确地找出化学成分最相似与差异最大的烈香杜鹃。
依据建立的序列, 对烈香杜鹃样品进行基本的分组, 在最相似样品对、 组中, 根据共有峰率分为以下几组:
A组: R1: R7R10(100.00; 0.00, 0.00), R2: R5R6R13(100.00; 0.00, 0.00), R5: R2R6R13 (100.00; 0.00, 0.00), R6: R2R5R13 (100.00; 0.00, 0.00), R7: R1R10 (100.00; 0.00, 0.00), R10: R1R7 (100.00; 0.00, 0.00), R11: R12 (100.00; 0.00, 0.00), R12: R11 (100.00; 0.00, 0.00), R13: R2R5R6 (100.00; 0.00, 0.00)
B组: R9: R11R12 (93.33; 7.14, 0.00), R4: R2R5R6R13 (92.86; 0.00, 7.69), R8: R11R12 (92.86; 0.00, 7.69)
C组: R3: R9(86.67; 0.00, 15.38)
在A组中, 序列R1: R7R10; R2: R5R6R13; R11: R12的共有峰率、 变异峰率相同, 吸收峰情况完全对应, 序列对应的产地分别为大通县宝库林场与互助县北山十二盘南坡、 化隆县青砂山; 大通县达板山北坡与门源县仙米林场、 互助县北山林场、 互助县林川乡; 群加林场与贵德县拉脊山; 每对序列的地理位置接近, 气候条件和生长环境近似, 所产烈香杜鹃的质量相似性高。
在B组中, 序列共有峰率很高, 且十分接近, R2, R5, R6和R13相对于R4有相同的共有峰率, 为92.86, R4变异峰率为0.00, R2, R5, R6和R13变异峰率为7.69, 说明R2, R5, R6, R13与R4之间化学成分很接近, 对应的产地分别为大通县达板山北坡、 仙米林场、 北山林场、 互助县林川乡、 门源县青石嘴, 这5个产地地理位置相对较近, 气候条件与生长环境相似; R11与R12相对R8和R9的共有峰率很接近, 变异峰率较小, 由此可见R8, R9, R11和R12的化学成分较相似。
在C组中, R9相当于R3共有峰率为86.67, R3的变异峰率为0.00, 但R9变异峰率为15.38, 说明这两个产地的烈香杜鹃的化学成分差异最大, 从地理位置上分析, 乐都区上北山林场与大通县达板山南坡的经度跨度最大, 具有明显的产地差异。
由上述分析可知, 产地接近、 气候条件与生长环境相似的烈香杜鹃之间共有峰率较高; 而产地、 气候条件与生长环境相差较大的烈香杜鹃之间变异峰率较高, 分析结果确切地反映了实际情况。
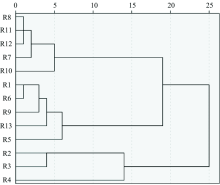
使用SPSS 20对13个产地烈香杜鹃的红外指纹图谱做系统聚类分析, 聚类方法选择组间联接法, 区间选择Euclidean距离, 对13个产地烈香杜鹃红外指纹图谱进行聚类分析, 见图2。
从图2中可以看出, 互助县北山十二盘北坡、 湟中县群加林场与贵德县拉脊山的烈香杜鹃最先聚为一类, 与双指标序列分析法得到的结论一致, 表明这3个产地的烈香杜鹃的化学成分十分相似。 烈香杜鹃采样点分布如图3所示, 根据聚类分析结果, 当欧氏距离为15时, 可聚为三大类, 聚类分析归为一类的用相同颜色采样点表示。 其中大通县达板山南坡与北坡、 门源县青石嘴的烈香杜鹃为一类, 用蓝色采样点表示; 互助县北山十二盘北坡与北坡、 湟中县群加林场、 贵德县拉脊山、 化隆县青砂山的烈香杜鹃归为一类, 用红色采样点表示; 其余归为一类, 用绿色采样点表示。 蓝色采样点的地理位置、 气候与生长环境非常接近, 且3个产地烈香杜鹃的化学成分十分相似; 5个绿色采样点比较分散, 所产烈香杜鹃的化学成分相似; 5个红色采样点分散, 所产烈香杜鹃化学成分相似。 R6, R7, R8与R13产地均位于互助县, 在欧氏距离为20时, 互助县所产烈香杜鹃归为两大类, 从此产地向北随着纬度的增加, 无红色采样点出现; 随着纬度的减小, 无绿色采样点出现, 推断此产地可能为这两类烈香杜鹃分布的重叠区域。 当欧式距离为20时, 绿色采样点与红色采样点代表的两类烈香杜鹃归为一类, 蓝色采样点归为一类。 当欧式距离为25时, 13个产地的烈香杜鹃聚为一类。
本研究运用的双指标序列分析法与聚类分析法, 分析的分析原理、 角度不同, 得到的分组结果基本一致, 表明这两种分析方法可靠[11], 可用于快速分析不同产地的烈香杜鹃。
傅里叶变换红外光谱技术避免了一般指纹图谱分析技术前处理过程复杂、 成分提取不完全、 药材用量大、 分离难度大的缺点, 因此, 本研究采用用傅里叶变换红外光谱技术开展了烈香杜鹃花和叶的红外指纹图谱研究, 建立烈香杜鹃药材的红外指纹图谱, 对红外光谱主要吸收谱带进行
了基团归属, 为烈香杜鹃的真伪鉴别、 质量控制提供依据。 双指标序列分析法能精确地辨认关系最近的样品, 可以快速、 准确地对两个及多个样品进行可靠的区分, 但共有峰率、 变异峰率的计算较为繁琐; 聚类分析法多用于大样本量的分析, 操作简单快捷, 但只适用于一般归类。 从实验结果可以看出, 双指标序列分析法与聚类分析法互补, 可用于分析烈香杜鹃红外指纹图谱数据。
运用双指标序列分析法和聚类分析法分析红外指纹图谱, 表明不同产地、 气候与生长环境相似的烈香杜鹃红外指纹图谱的相似度很高, 进一步证明, 中药的化学成分及其含量受气候条件与生长环境的影响, 与程云清等[15]和黄瘤萍等[16]的研究结果一致。 红外指纹图谱结合双指标序列分析法和聚类分析法为鉴别烈香杜鹃的真伪、 产地和品质差异提供了快速、 有效的新方法, 也为烈香杜鹃药材资源的综合开发利用提供参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|