作者简介: 张崇辉, 1984年生, 西安建筑科技大学材料与矿资学院博士研究生 e-mail: 277599189@qq.com
在紫外吸收光谱范围内对黄药溶液进行扫描, 发现在波长226.5和300 nm处有两个明显吸收峰, 且300 nm处的吸收峰强于226.5 nm处的。 采用标准曲线法对不同浓度的标准样品进行浓度测量, 对所得数据进行线性拟合, 结果表明: 在波长226.5和300 nm处的线性相关性均较好, 但在波长300 nm处的相关性更佳, 在226.5 nm处进行高浓度黄药溶液测量, 可在300 nm处进行低浓度黄药溶液测量。 在300 nm下对不同浓度黄药溶液进行定量分析, 结果表明, 最大吸光度为1.672, 最小吸光度为0.032时, 黄药溶液标准曲线的线性相关性仍很好, 吸光度继续增大时, 相关系数降低, 在进行定量分析时, 黄药浓度最好不要超过20 mg·L-1。 在不同pH条件下, 在300 nm处对黄药溶液进行浓度测量, 发现pH为3时, 吸光度下降, 黄药开始分解, 当溶液pH为2时, 所测吸光度为0, 黄药已完全分解, pH值在5~10范围内, 黄铜矿对黄药吸附较好, 溶液最佳吸附pH值为9。 在300 nm处测量黄药在黄铜矿表面吸附量, 分别采用Freundlich和Langmuir等温吸附模型方程、 准一级和准二级动力学方程模型对所得实验数据进行拟合, 研究其在黄铜矿表面的吸附动力学和热力学。 结果表明: 在288~303 K范围内, 温度变化对吸附量多少影响不大, 黄药在黄铜矿表面的吸附等温线更符合Langmuir等温线模型, 黄铜矿对黄药的实际平衡吸附量 Qe均小于或接近理论单层饱和吸附量, Qm值均与实验值极为接近, 说明黄药在黄铜矿表面的吸附以单层化学吸附为主。 随着温度升高, 吸附量增加, 说明升高温度有利于吸附过程进行, 黄铜矿对黄药的吸附为吸热过程, 但吸附量增加幅度很小, 说明黄药在黄铜矿表面吸附受温度影响较小。 该吸附过程是一个熵增、 吸热、 自发进行的过程, 热力学参数可通过范特霍夫方程计算得到, 吸附焓变Δ H为48.703 41 kJ·mol-1, 熵变Δ S为219.403 88 J·(mol·K)-1, 吸附自由能变Δ G为-16.054 93 kJ·mol-1, 推测该吸附过程属于化学吸附; 黄铜矿对黄药的吸附更符合准二级动力学方程模型, Qt值随着温度升高而增大, 且变化幅度很小, 表明黄药在黄铜矿表的吸附过程为吸热过程, 但受温度变化较小, 这与热力学分析的结论一致, 对方程拟合所得 Qe值均与实验值极为接近。
Spectrum scanning was conducted to characterize xanthate solution by Ultraviolet spectrophotometry. Two strong absorption peaks at the wavelength of 226.5 and 300 nm could be observed, respectively. And the absorption peak at 300 nm was stronger than that at 226.5 nm. Then, the standard curve method was used to measure concentration of the standard samples with different concentrations, and the data set was fitted linearly. It was shown that linear correlation was good at both wavelengths of 226.5 and 300 nm, and better correlation could be found at 300 nm. Therefore, high concentration xanthate solution could be measured at 226.5 nm, whereas low concentration xanthate solution could be measured at 300 nm. Afterwards, quantitative analysis of xanthate solution at different concentrations was carried out at 300 nm. The results showed that either absorbance was at maximum of 1.672 or minimum of 0.032, the linear correlation of standard curve of xanthate solution still remained good. Correlation coefficient decreased as absorbance increased continuously. It should be noted that concentration of xanthate needed to be limited less than 20 mg·L-1 while conducting quantitative analysis. In addition, concentration of xanthate solution was measured at 300 nm under different PH of xanthate solution. It was found that at pH 3, absorbance decreased and xanthate began to decompose. When pH reached 2, absorbance became 0 and xanthate completely finished decomposition. High adsorption performance of xanthate by chalcopyrite could be explored at pH range of 5~10, and highest performance occurred at pH 9. Furthermore, adsorption capacity of xanthate by chalcopyrite surface was also measured at 300 nm. The experimental data were respectively fitted by different equation models, i. e., Freundlich and Langmuir isothermal adsorption equation model, pseudo-first-order and pseudo-second-order kinetic equation model. Sequentially, adsorption kinetics and thermodynamics of xanthate by chalcopyrite surface were studied. The results indicated that in the range of 288 to 303 K, temperature change exerted little effect on the adsorption capacity. The adsorption isotherm of xanthate by chalcopyrite surface was more consistent with Langmuir isothermal model. The actual equilibrium adsorption capacity of xanthate on chalcopyrite Qe was less than or close to theoretical monolayer saturated adsorption capacity, and Qm values were very close to the experimental values, indicating that adsorption of xanthate by chalcopyrite surface was dominated by monolayer chemical adsorption. With the increase of temperature, the adsorption capacity increased, meaning that temperature increment was beneficial to promote adsorption. The adsorption of xanthate on chalcopyrite was predicted to be exothermic but only small increasing extent of adsorption capacity could be observed. Thus, it would be reflected that the adsorption of xanthate on chalcopyrite is less affected by temperature. The adsorption process was spontaneous, with entropy increase and heat adsorption. The thermodynamic parameters could be calculated by Van’t Hoff equation, namely, adsorption enthalpy change Δ H=48.703 41 kJ·mol-1, entropy change Δ S=219.403 88 J·(mol·K)-1, and the adsorption free energy change Δ G=-16.054 93 kJ·mol-1. Therefore, the adsorption process could be defined as chemical adsorption. Adsorption of xanthate on chalcopyrite was more consistent with pseudo-second-order kinetic equation model. Qt value increased with temperature elevation, and the change range was very small. Consequently, it revealed that adsorption process of xanthate by chalcopyrite surface was endothermic, however, it was affected by temperature to a small extent. This was in agreement with the conclusion of thermodynamic analysis, and the value of Qe obtained by fitting was very close to experimental value.
黄药即黄原酸盐, 通式为: ROCSSM(其中M为碱金属), 是一类最重要的有机合成硫化矿类捕收剂, 主要合成原料为二硫化碳、 氢氧化钠和醇, 根据醇的不同命名为不同的黄药。 黄药在矿物表面或吸附质表面的吸附研究是矿业工程和环境科学学科研究中常会遇到的问题。 常用的方法有红外光谱法[1]、 X射线光电子能谱法[2]、 紫外-可见吸收光谱法[3]和电化学分析法[4]。 其中, 紫外-可见吸收光谱法是一种方法简便、 灵敏度高、 快速、 低成本、 无损分析技术, 近年来已广泛应用于水质检测。
紫外-可见吸收光谱法[5]是对物质进行定性、 定量或结构分析的一种方法。 常规定量分析的方法有: 绝对法、 标准对照法、 比吸收系数法、 标准曲线法、 标准加入法、 解联立方程法等, 其中以标准曲线法最为常用。 在采用标准曲线法进行吸光度测量时, 所测溶液的吸光度控制在0.2~0.7范围内[6]。 Xie[7]等利用301 nm处吸光度值, 采用标准曲线法来检测黄药溶液浓度, 研究乙基黄药和戊基黄药在黄铜矿表面的竞争吸附。 Dá vila-Pulido[8]等利用301 nm处吸光度值, 采用标准曲线法来检测黄药溶液浓度, 以研究钙对黄药在闪锌矿表面吸附的影响。
中国长期以来铜供应不足, 2008年国内铜产量仅占年消费量的74%, 中国生产的铜主要取自黄铜矿。 黄铜矿常与辉钼矿共、 伴生在一起, 使其利用困难。 黄铜矿的回收利用主要是通过浮选方法实现, 目前铜钼矿选矿主要采用铜钼混合浮选— 粗精矿分离的浮选工艺, 在此工艺混合浮选阶段为提高铜钼的回收率, 多采用捕收能力强的黄药类捕收剂[9, 10]。 在紫外-可见吸收光谱范围内对黄药溶液进行光谱扫描, 确定黄药特征吸收峰的最佳波长, 在最佳波长下确定最佳吸光度范围, 在此基础上进行黄铜矿对黄药的吸附热力学与动力学研究, 为铜钼分离及黄铜矿浮选药剂的研究提供理论依据。
材料: 丁基黄药为工业级, 含量为86.2%。 所用氢氧化钠、 盐酸均为分析纯试剂。 黄铜矿纯矿物来自广西, 为手捡分选样品。
主要仪器: TU-1901紫外-可见分光光度计(北京普析通用仪器有限公司); SHA-B型水浴恒温振荡器(常州华普达教学仪器有限公司); HI991002型便携试pH/ORP/温度测定仪计(HANNA); XDQM-2L型变频行星式球磨机(连云港市春龙实验仪器有限公司)。
所购买的黄铜矿纯矿物为块状, 采用压力机将其压碎至2 mm, 然后采用变频行星式球磨机研磨, 将其磨至74 μ m, 所得矿样用于吸附实验。 经化验分析, 黄铜矿纯度为95.66%, 满足实验要求。
向100 mL锥形瓶中加入30 mL黄药溶液, 根据需要调节pH值后加入0.1 g黄铜矿纯矿物, 用保鲜膜皮筋封口, 一定温度下振荡, 振荡器转数150 r· min-1。 一定时间后, 静置、 离心, 抽取上清液, 采用紫外光谱法在300 nm处测量吸光度, 计算上清液中黄药浓度。 其吸附量按下列公式计算
其中: c0是黄药溶液的初始浓度(mg· L-1); ct是t时刻上清液的黄药浓度(mg· L-1); W为黄铜矿纯矿物的重量(g); V为黄药溶液的体积(L)。 若吸附达平衡, ct是吸附平衡时溶液中黄药的浓度, 对应的吸附量为Qe(mg· g-1)。 每次吸附实验均需带上一个空白吸附对比样品, 以此所得上清液做为参比溶液。
紫外-可见分光光度计设备使用参数为: 比色皿为: 1 cm; 扫描范围为: 190~400 nm; 扫描间隔为: 0.5 nm; 扫描速度为: 快; 光谱带宽为: 2.0 nm; 响应时间为: 0.2 s。
1.4.1 黄药溶液光谱扫描
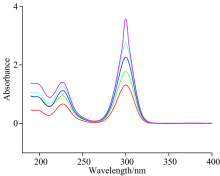
配制不同浓度的黄药溶液, 以蒸馏水为参比进行光谱扫描, 光谱扫描结果见图1。 从图1可以看出, 在紫外区吸收特征峰均出现在波长226.5和300 nm处, 且随浓度增大呈正相关变化; 300 nm处的特征峰高于226.5 nm处的特征峰, 在浓度改变时, 吸收特征峰的位置并没有发生变化。
1.4.2 黄药溶液标准曲线
准确称取0.500 0 g黄药, 溶解于蒸馏水中, 用50 mL容量瓶定容, 得到10 g· L-1的黄药溶液。 将所配制好的黄药溶液稀释, 得到不同浓度的黄药溶液, 在特征波长下对不同浓度的黄药溶液进行吸光度测量, 对所得数据进行线性拟合, 即得到黄药溶液的标准曲线。
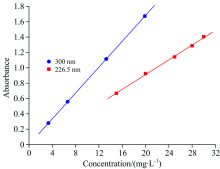
将所配制好的不同浓度的黄药溶液, 分别在波长226.5和300 nm进行吸光度测量, 采用线性拟合的方法处理实验数据, 结果见表1, 图2。 在波长226.5和300 nm处的相关性均较好, 但在波长300 nm处的标准曲线的线性相关性更佳(R2> 0.999), 因此, 本实验选取在特征波长300 nm处进行吸附量测定。 当黄药浓度较大、 检测结果准确度要求不高且需快速得到结果的情况下可以选取在特征波长226.5 nm处进行吸附量测定。
| 表1 黄药标准曲线拟合结果 Table 1 Fitting result of the standard curve of xanthate |
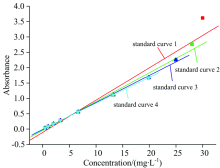
在波长300 nm处对不同浓度的黄药溶液进行吸光度测量, 采用线性拟合的方法处理实验数据, 结果见表2, 图3。
| 表2 不同标准曲线拟合结果 Table 2 Fitting results of different standard curves |
从结果可以看出, 标准曲线2, 3和4的线性相关性均较好, 但标准曲线4的线性相关性更佳(R2> 0.999), 因此, 为追求实验数据的准确性, 在测定黄药浓度时, 黄药浓度最好不要超过20 mg· L-1。 标准曲线4所测量的最大吸光度为1.672, 最小吸光度为0.032, 说明黄药溶液在较高和较低的吸光度时, 仍具有很好的线性相关性, 对溶液中黄药浓度的测量可在较高的吸光度下进行。
对未进行吸附的黄药溶液分别在不同pH值下进行光谱扫描, 以确定pH值变化对特征峰强弱的影响。 在不同pH值下进行黄药吸附实验, 以确定pH值变化对吸附量影响。 在吸附时间为120 min, 吸附温度为303 K时, 溶液pH对黄药在黄铜矿表面吸附量的影响见图4。
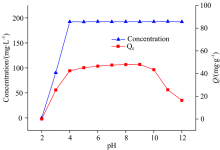 | 图4 pH对黄药在黄铜表面吸附量的影响曲线Fig.4 The effect of pH on the adsorption capacity of xanthate onto chalcopyrite |
从实验结果可以看出, 溶液pH由2增加到12时, 黄药在黄铜矿表面吸附量先增加后减少。 当pH为5~10时, 黄药能够较好的吸附在黄铜矿表面, pH为9时吸附量达到最大。 pH为3时, 黄药开始分解, pH为2时, 吸光度为0, 说明黄药已完全分解, 当溶液pH小于2时, 黄药将完全分解。 在pH大于10时, OH-浓度大幅增加, 与黄原酸根在黄铜矿表面产生竞争吸附, 从而使黄药在黄铜矿表面的吸附量大幅减小, 说明高碱性条件不利于黄药在黄铜矿表面吸附。 因此说明在高酸和高碱性溶液中均不利于黄药在黄铜矿表面吸附的进行。
为了研究黄铜矿对黄药的吸附速率及机理, 分别采用准一级动力学模型和准二级动力学模型[11]对实验数据进行拟合, 并对两者进行了对比。 其表达方程式为
式中: Qe为平衡时黄药的吸附量(mg· g-1), Qt为t时刻黄药的吸附量(mg· g-1), K1为准一级动力学吸附速率常数 (min-1), K2为准二级动力学吸附速率常数[g· (mg· min)-1], 拟合所得的动力学参数见表3, 结果见图5和图6。
| 表3 黄药吸附在黄铜矿表面的动力学模型计算结果 Table 3 Calculation results of kinetics model of xanthate adsorption onto chalcopyrite |
由图5, 图6和表3可知, 准二级动力学方程拟合相关系数优于准一级动力学方程, 且所得到的Qe值与实验值更为接近。 因此, 黄铜矿对黄药的吸附过程更符合准二级动力学方程。 随着温度的升高, Qe值增大, 表明黄药在黄铜矿表面的吸附为吸热过程。
在吸附时间为120 min、 pH为8.5时, 得到不同温度(288, 296和303 K)下黄铜矿对黄药平衡吸附量(Qe)与黄药平衡浓度(ce)的关系。 分别依据Freundlich[12, 13]等温吸附模型和Langmuir[12, 13]等温吸附模型, 采用线性拟合方法处理实验数据, 其结果见图5, 图6以及表3。
Freundlich等温吸附模型方程
式中: ce为平衡浓度, mg· L-1, KF为吸附平衡常数, n为Freundlich的强度系数。
Langmuir等温吸附模型方程
式中: KL为Langmuir常数, L· mg-1; Qm为单位重量最大吸附容量, mg· g-1。
在不同温度下, 分别以lgce为横坐标, 以lgQe为纵坐标作图, 得到如图7所示Freundlich等温吸附线, 分别以ce为横坐标, 以ce/Qe为纵坐标作图, 得到如图8所示Langmuir等温吸附线, 通过所得直线斜率和截距可分别求得KL, Qm, n和KF, 计算结果见表4。
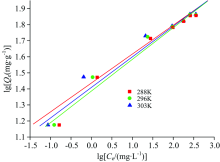 | 图7 不同温度条件下黄铜矿吸附黄药的Freundlich曲线Fig.7 Freundlich adsorption curves of xanthate onto chalcopyrite at different temperatures |
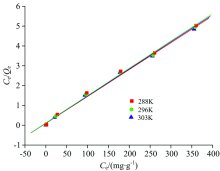 | 图8 不同温度条件下黄铜矿吸附黄药的Langmuir曲线Fig.8 Langmuir adsorption curves for xanthate onto chalcopyrite at different temperatures |
由图7, 图8以及表4的拟合结果可知, 在实验范围内, Langmuir等温吸附模型方程(R2> 0.99)比Freundlich等温吸附模型方程(R2> 0.90)更符合黄药在黄铜矿表面的吸附模型, 黄铜矿对黄药的实际平衡吸附量Qe均小于或接近理论单层饱和吸附量, 说明黄药在黄铜矿表面的吸附以单层化学吸附为主。
从Langmuir方程推算的Qm及实验所得Qe来看, 升高温度, Qm与Qe均增加, 说明温度升高有利于黄药在黄铜矿表面的吸附, 黄铜矿对黄药的吸附为吸热过程, 但Qm与Qe增幅均很小, 说明黄药在黄铜矿表面吸附受温度影响较小。
| 表4 黄药吸附在黄铜矿表面的等温方程计算结果 Table 4 Calculation results of isothermal equation for xanthate adsorption onto chalcopyrite |
因此, 黄铜矿浮选时, 体系中存在的黄药很容易吸附到黄铜矿上, 占据活性基团位置, 从而提高其疏水性进行浮选分离。
通过热力学参数计算, 可以得到与吸附有关的能量变化的深入信息, 以此判断吸附过程自发与否, 吸热或放热, 其参数为Δ G, Δ H和Δ S。 通过紫外-可见分光光度法测定黄药在黄铜矿表面吸附量大小, 采用线性拟合的方法处理实验数据, 计算Δ G, Δ H和Δ S, 判断黄药在黄铜矿表面的吸附机理。 Δ G, Δ H和Δ S可通过范特霍夫方程计算得到, 范特霍夫方程计算式如下[14]
式中: R为摩尔气体常数, 8.314 J· mol-1· K-1; T为热力学温度, K; K为吸附平衡常数。
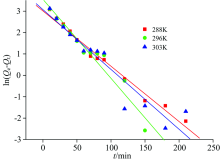
在288, 296和303 K三个温度下的吸附平衡, 以Qe为横坐标, 以ln(Qe/ce)为纵坐标作图, 并且外推至Qe=0时的值[15], 从而得到三个不同温度下的吸附平衡常数K, 如图9所示, 通过lnK值可求得不同温度条件下的Δ G, 可根据lnK-1/T的斜率和截距求得Δ H和Δ S, lnK-1/T关系拟合结果为: y=26.389 69-5.858x, R2=0.983 53, 计算结果见表5。
| 表5 黄药吸附在黄铜矿表面的热力学方程计算结果 Table 5 Calculation results of thermodynamic equation of xanthate adsorption onto chalcopyrite |
由表5知, 3个温度下黄铜矿对黄药吸附的Δ G均小于0, 表明黄铜矿对黄药的吸附是一个自发进行的过程。 在所研究的温度范围, 黄铜矿对黄药吸附的Δ G在-16 kJ· mol-1左右, 温度越高, Δ G越大, 但Δ G增幅较小, 说明此吸附过程受温度影响较小。 所以采用黄药进行黄铜矿浮选时, 黄药会自发吸附到黄铜矿上, 从而提高黄铜矿的可浮性, 达到有用矿物与脉石矿物分离的目的。 一般情况下, Δ H< 25 kJ· mol-1的吸附为物理吸附, Δ H> 40 kJ· mol-1的吸附为化学吸附[16]。 黄药在黄铜矿表面吸附的Δ H在48 kJ· mol-1左右, 大于40 kJ· mol-1, 因此属于化学吸附。 Δ S> 0, 表明此吸附过程是熵驱动的过程。
在紫外光谱范围内, 黄药具有特征吸收峰的波长为226.5和300 nm, 在黄药浓度较小时可以选取在特征波长300 nm处进行吸附量测定。 在黄药浓度较大时可以选取在特征波长226.5 nm处进行吸附量测定。 在波长300 nm下进行黄药浓度测定时, 当标准样品吸光度达到1.672时, 所得标准曲线仍有极好的线性相关性, 对溶液中黄药浓度的测量可在较高吸光度下进行。 在288~303 K范围内, 高酸和高碱性溶液均不利于黄药吸附, 黄铜矿对黄药吸附符合Langmuir等温吸附模型, 该过程是一个熵增、 吸热、 自发进行的过程, 推测该吸附过程属于单分子层吸附。 Qm值均与实验值极为接近, 升高温度有利于吸附过程进行, 但Qm值增加幅度很小, 说明黄铜矿在室温下就可对黄药达到很好的吸附效果。 黄铜矿对黄药的吸附符合准二级动力学方程模型, Qe值与实验值极为接近, 且变化幅度很小, 说明此吸附过程受温度影响较小。 通过计算出来的热力学与动力学参数, 与煤油、 巯基乙酸等浮选药剂的热力学与动力学参数进行对比, 为铜钼分离浮选药剂的选择及研发、 改进提供理论依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|