作者简介: 吕 飞, 女, 1980年生, 浙江工业大学海洋学院副教授 e-mail: lvfei_zju@163.com
臭氧(O3)是一种具有强氧化性作用的杀菌消毒剂, 因其安全无害等特点已被广泛用于肉制品生产加工的减菌处理, 但O3减菌处理对红肉色泽具有较强的负面作用, 且其作用机制尚缺乏研究。 针对肌红蛋白(Mb)存在状态是决定红色肉色泽关键因素的基础, 通过紫外-可见吸收光谱法、 荧光光谱法和圆二色光谱法(CD)研究O3作用下Mb的光谱特性变化, 结合蛋白质氧化特征指标分析和分子动力学模拟技术探究O3对Mb分子的作用效果与机制。 光谱研究结果表明, O3处理可使Mb的紫外-可见光谱图在412 nm左右处的铁卟啉环特征峰及540和580 nm附近的氧合肌红蛋白(OMb)特征峰的强度减弱, 其中铁卟啉环特征峰发生蓝移; 利用固定激发波长280 nm下测定Mb内源性荧光和同步荧光光谱表明O3会降低Mb的荧光强度, 增大铁卟啉基团贡献的荧光峰强度和造成酪氨酸残基荧光光谱特征峰的蓝移; O3作用使Mb三维荧光光谱特征峰强度的下降及光散射强度的增加。 以上变化推断出O3会促进Mb的氧化, 造成其氨基酸残基疏水基团裸露, 使Mb所处微环境及其蛋白构象改变; CD分析表明O3与肌红蛋白接触时间越久, 蛋白质二级结构变化越明显, 造成α-螺旋的含量下降, 无规则卷曲增加。 辅以检测不同强度O3处理Mb的含量及性质的变化, 可知O3处理使OMb含量下降, 高铁肌红蛋白(MMb)含量增加, 同时O3处理Mb的羰基含量增加和巯基含量下降, 这也进一步证实O3作用促进了Mb的氧化, 此外, O3处理Mb表面疏水性的增强, 说明O3造成Mb体系微环境的极性变化。 分子动力学模拟结果显示O3会提高Mb肽链的RMSD值, 影响Mb肽链的稳定性, 减弱铁卟啉环与Mb肽链的相互作用; RMSF结果表明Mb活性口袋附近氨基酸残基的变化较大; 蛋白质二级结构分析与光谱学试验研究结果一致, Mb的α-螺旋的含量下降, 无规则卷曲增加。 总而言之, O3可作用于Mb的氨基酸残基, 导致蛋白质二级结构和疏水性改变, 并发生蛋白氧化及铁卟啉环暴露, 进而引起红色肉色泽发生改变。 该研究可为生鲜红肉护色技术制定等提供一定理论依据。
Ozone (O3) has been widely used for reducing bacteria in fresh meat. However, O3 treatment has a negative impact on the red meat color, and the action mechanism of O3 on red meat color is still lack of research. The existence of myoglobin (Mb) is the basis for determining the key factors of red meat color. Therefore, the spectroscopic characteristics of myoglobin (Mb) under O3 were analyzed by UV-Vis absorption spectroscopy, fluorescence spectroscopy and circular dichroism (CD) spectroscopy. Moreover, the protein oxidation characteristics and molecular dynamics simulation were used to explore the effect and mechanism of O3 on Mb molecule. The results of spectroscopic studies show that the O3 treatment can decrease the intensity peak of the iron porphyrin ring at about 412 nm and the characteristic peak of oxygenated myoglobin (OMb) near 540 and 580 nm in the ultraviolet-visible spectrum of Mb. The characteristic peak of the iron porphyrin ring blue-shifted. It also caused changes in the endogenous fluorescence and synchronous fluorescence spectra of Mb measured at a fixed excitation wavelength of 280 nm, indicating that the fluorescence intensity of Mb was reduced by O3 and the fluorescence peak intensity contributed by the iron porphyrin group was increased and it also caused a blue shift in the characteristic peak of the fluorescence spectrum of the tyrosine residue. The characteristic peak intensity of the three-dimensional fluorescence spectrum decreased and the light scattering intensity increased. It was concluded that O3 would cause the protein oxidation of Mb, the exposure of hydrophobic group of the amino acid residues in Mb and the conformation change of the protein. The CD spectroscopy results show that the longer the contact time between O3 and myoglobin, the more obvious the change of protein secondary structure, resulting in a decrease in the content of α-helix and an increase in random curl. Combined with the chemical detection on the content and characteristics of Mb, it shows that O3 caused the decrease of OMb content, and the increase of MMb, carbonyl and sulfhydryl content, indicating that O3 treatments could lead to the protein oxidation. Moreover, O3 treatments increased the hydrophobicity of protein surface, indicating it resulted in the polarity change of the microenvironment of the protein system. Molecular dynamics simulation results show that O3 can increase the RMSD value of Mb peptide chain, affect the stability of Mb peptide chain, and weaken the interaction between porphyrin ring and Mb peptide chain. The change in RMSF value Mb peptide chain discovered that amino acid residues of Mb near the active pocket changed obviously; Molecular dynamics simulations of protein structural changes were consistent with the results of spectroscopic experiments, namely, the alpha-helix in Mb decreased and the irregular curl increased after O3 treatment. In conclusion, O3 treatment could interact with the residues of Mb, led to the changes in the secondary structure and the hydrophobicity of Mb, and brought on the oxidation of protein and the exposure of iron porphyrin ring, therefore resulting in the change of red meat color. This study can provide theoretical basis for the color protection of red meats.
肌红蛋白(Myoglobin Mb)在哺乳动物生物体内起着储存氧和促进氧在细胞中扩散的作用。 它由一条多肽链和一个血红素辅基构成, 含153个氨基酸残基。 脱氧肌红蛋白(deoxymyoglobin, DMb)、 氧合肌红蛋白(oxymyoglobin, OMb)、 高铁肌红蛋白(metmyoglobin, MMb) 是生鲜畜肉肌红蛋白常见的氧化还原形式, 主导着生鲜肉色泽[1]。 臭氧(O3)是一种安全可靠的广谱杀菌剂, 已被广泛的应用于生产生活[2]。 除了可用于食品工厂的杀菌消毒外, 还可用于改善食品的结构、 功能特性和感官品质等[3]。 在相关肉及肉制品的应用研究中, 发现臭氧虽然能够起到很好的杀菌作用, 但对肉的色泽品质方面都有一定的影响, 特别是在Mb含量较高的“ 红肉” 产品, 经过臭氧处理后的肉色会发生变化而达不到消费者追求的“ 新鲜的肉色” [4, 5]。 目前臭氧对肉色的影响作用具体到相关蛋白质和氨基酸残基等分子方面的研究却鲜见报道。
本文通过紫外吸收光谱法、 荧光光谱和圆二色谱等方法测定肌红蛋白光谱变化, 分析Mb二级结构、 Mb、 蛋白羰基、 巯基含量及表面疏水性, 在此基础上, 结合分子动力学模拟, 探究了臭氧作用下肌红蛋白结构变化规律, 以期为生鲜肉护色技术等提供理论依据。
马心肌红蛋白纯品(98%), 连二亚硫酸钠、 磷酸氢二钠、 磷酸二氢钠, 氯化钠、 均为分析纯, 购自上海阿拉丁试剂公司。 5, 5’ -二硫代双(2-硝基苯甲酸)(DTNB)、 2, 4-二硝基苯肼、 三氯乙酸(TCA)、 盐酸胍、 乙二胺四乙酸(EDTA)、 三羟甲烷(Tris)、 浓盐酸、 尿素、 溴酚蓝均购自购自国药集团化学试剂有限公司。
F20-臭氧发生器(上海康特CONT公司); uSafe 2000便携式臭氧检测仪(深圳山盾科技有限公司); PHS-3C型精密pH计(上海精科仪器有限公司); UV-6100S扫描型紫外分光光度计(上海美谱达MAPADA仪器有限公司); 日立F-2700荧光光谱仪(附带FL Solution软件)(日本日立HITACHI公司); J-815圆二色光谱仪(日本分光JASCO株式会社)。
马心肌肌红蛋白纯品用pH6.8, 50 mmol· L-1的磷酸盐缓冲溶液溶解, 制成浓度为2 mg· mL-1的马心肌肌红蛋白溶液, 经连二亚硫酸钠(Na2S2O4)还原得到OMb主的蛋白溶液。 将上述OMb为主的溶液稀释到0.25 mg· mL-1, 随机分4组, 每组5mL, 分别向溶液的表面通入瞬时输出量为200~350 mg· m-3 O3气体, 通气时间依次为0, 0.5, 1和2 min, 各处理依次标记为CK, OT1, OT2和OT3, 各处理完成后即刻进行各项指标检测。
紫外-可见光谱测定: 选择可见光谱扫描波长范围350~650 nm, 并按照Tang等[6]的方法测定样品在503, 525, 557, 582 nm处的吸光值。
氧合肌红蛋白(OMb)百分含量/%=(0.722R1-1.432R2-1.659R3+2.599)× 100%
高铁肌红蛋白(MMb)百分含量/%=(-0.159R1- 0.085R2+1.262R3-0.520)× 100%
式中: R1, R2和R3分别是吸光率比值A582/A525, A557/A525, A503/A525。
荧光光谱测定: 选择激发波长λ ex=280nm的条件下测定Mb溶液的荧光强度; 并采用分别为Δ λ =20 nm和Δ λ =60 nm测定Mb溶液的同步荧光光谱变化; 以激发波长变化范围(λ ex/nm)在220~360 nm之间, 发射波长变化范围(λ em/nm)在270~550 nm的条件下测定O3处理Mb三维荧光光谱特征变化。
圆二色谱测定: 扫描波长范围在195~250 nm之间, 以磷酸盐缓冲液作为校正, 测定O3处理Mb二级结构变化。 响应时间为2 s, 累计次数为3次。
羰基含量的测定: 参考文献[7]的方法处理蛋白, 在370 nm 下测吸光值, 蛋白质羰基衍生物的含量(nmol· mg-1 蛋白)使用摩尔吸光系数22 000 M-1· cm-1计算。
巯基含量的测定: 参考文献[7]的方法, 在412 nm下测吸光值, 巯基含量(nmol· mg-1 蛋白), 通过摩尔吸光系数13 600 M-1· cm-1 计算得到。
表面疏水性的测定: 按照Chelh等[8]的方法, 取2 mL 蛋白溶液并加入40 μ L 1 mg· mL-1的溴酚蓝溶液, 空白为2 mL磷酸盐缓冲液加入 40 μ L 1 mg· mL-1 的溴酚蓝溶液, 漩涡振荡混匀10 min 后离心(4 ℃, 5 000× g, 10 min), 取上清液于595 nm测定吸光值。 用结合态的疏水溴酚蓝结合量作为表面疏水性指数。
用Gromacs程序包(VERSION 5.1.2)对氧合肌红蛋白(Physeter catodon)和臭氧在水溶液中的相互作用进行MD模拟。 马心氧合肌红蛋白分子pdb文件构建由RCSB PDB数据库(http://www.rcsb.org/)分别下载2v1k(脱氧肌红蛋白, Equus caballus)和1mbo(氧合肌红蛋白, Physeter catodon), 合并编辑制作氧合肌红蛋白, Equus caballus。 构建的氧合肌红蛋白置于立方体盒子中心, 选择溶质原子到盒子壁的距离为1.0 nm, 水分子为SPC216模型。 脱氧肌红蛋白选择GROMOS96 43a1力场, 氧分子力场由Automatic Topology Builder(ATB)网站生成, 然后合并两者, 组建氧合肌红蛋白力场。 臭氧分子的top结构由PRODRG网站完成。 臭氧分子在体系加入水分子后以溶剂形式加入, 未加入臭氧分子的体系为对照体系, 做100 ns的动力学模拟。
MD结果分析: 均方根偏差(RMSD)使用命令rms计算反应体系中肌红蛋白的均方根偏差, 选取肌红蛋白的骨架来拟合计算。 波动均方根(RMSF)使用命令rmsf计算反应体系中肌红蛋白的波动均方根, 评价体系中各氨基酸残基相对于初始晶体结构的均方根波动值。 蛋白质二级结构分析由DSSP命令完成, 计算100 ns内各二级结构残基数量随时间的变化趋势。
试验采用完全随机设计, 重复2次。 数据采用Excel及统计制图分析软件Origin 9.0进行统计分析。
肌红蛋白血红素辅基亚铁离子第六配位被氧占据时为氧合型肌红蛋白(OMb), 在412 nm附近有一个强吸收峰(即为soret带), 是由卟啉环共轭体系的π — π * 跃迁产生的, 在540和580 nm左右各有一个弱吸收峰, 是OMb的特征吸收峰[9]。 当Mb受周边环境变化的影响时, 氧结合部位失活, 被H2O分子填充时, 亚铁离子氧化为三价铁离子, 形成MMb, 高铁肌红蛋白在407, 503和631 nm有特征吸收峰[9, 10]。 如图1, 原主要为MMb的马心肌红蛋白样品在加入连二亚硫酸钠后, 还原得到以OMb为主的蛋白溶液(CK)的光谱图。 如图1(a)所示, 随着O3与Mb接触时间的增大, 蛋白质的紫外-可见吸收光谱受到影响, 发生了明显变化。 Mb在412, 540和580 nm附近的特征峰均明显下降并在412 nm处发生稍微蓝移至407 nm, 表明O3会改变Mb蛋白构象, 从而影响卟啉环稳定性。 根据光谱图数据, 计算肌红蛋白氧化状态相对含量。 如图1(b)所示, 当Mb与O3接触的时间增加, OMb相对含量减少而MMb含量随之明显变大。 说明在O3的作用下, OMb的卟啉环上的亚铁离子发生了氧化, 变为三价铁离子, 产生高铁肌红蛋白(MMb)。
2.2.1 荧光光谱分析
蛋白质的内源荧光主要来源于芳香族氨基酸残基上的色氨酸(Trp)和酪氨酸(Tyr)[9, 11]。 如图2(a)所示, Mb在激发波长为280 nm时, 在327 nm左右处有一个荧光发射峰, 主要由Mb肽链色氨酸残基贡献, 酪氨酸次之。 蛋白质的内源荧光的变化直接反映了蛋白质中氨基酸残基本身及其周围环境的变化情况[12]。 同时在562 nm处也有个最大荧光发射波长, 根据马君燕等[13]对Mb以激发波长为280 nm时的荧光传能实验结果, 发现562 nm处的荧光峰是由铁卟啉基团贡献的, 是Mb肽链色氨酸和酪氨酸残基所吸收的光能量传递至铁卟啉基团上, 进而由铁卟啉基团所产生的荧光发射峰。 由此可以确定562 nm左右的荧光峰是由铁卟啉基团贡献的。 随着Mb与O3的接触时间的增加, 芳香族氨基酸残基贡献的荧光发射峰强度逐渐下降, 而铁卟啉基团贡献的荧光峰强度不断上升, 说明O3与Mb肽链氨基酸残基发生了较强的相互作用, Mb的结构微环境发生改变, 并使深埋在Mb肽链内部的铁卟啉基团裸露, 更易发生氧化。
 | 图2 O3处理肌红蛋白荧光光谱(a)和Δ λ =20 nm(b), Δ λ =60 nm(c)的同步荧光光谱Fig.2 Fluorescence spectra (a) of myoglobin treated with O3 and the synchronous fluorescence spectra of Δ λ =20 nm (b), Δ λ =60 nm (c) |
2.2.2 同步荧光光谱
同步荧光光谱是比普通荧光光谱更为灵敏、 精准的荧光测定方法。 通常蛋白质的同步荧光光谱, 在Δ λ =20 nm时主要显示为蛋白质的酪氨酸(Tyr)残基荧光发射峰, Δ λ =60 nm时则显示色氨酸(Trp)残基的荧光发射峰[11]。 如图2(b)和(c)所示, 这时Mb肽链的酪氨酸残基和色氨酸残基荧光发射峰强度随着与O3的接触时间增加而明显下降, 说明O3与Mb肽链氨基酸残基发生相互作用, 影响其周边微环境, 改变蛋白质构象。 Δ λ =60 nm时, 由色氨酸贡献的荧光特征峰强度不断降低, 位置无明显变化, 而当Δ λ =20 nm时, 则罚生了明显蓝移现象, 最大峰值由289 nm逐渐转移至281 nm, 荧光峰值随与O3接触时间的增大而减小, 酪氨酸残基荧光发射峰左侧出现小峰, 说明O3与Mb相互结合反应是的作用位点侧重于酪氨酸基团, 氨基酸残基微环境的极性减弱, 疏水性增大。
2.2.3 三维荧光光谱
三维荧光谱能够更加生动丰富地展现荧光物质在随着荧光激发波长和发射波长的范围变化而产生不同荧光强度。 图3(a)所示, Mb溶液的三维荧光谱图, 有两个似“ 尖峰” 状的瑞利散射峰(峰1、 峰2), 另有两个似“ 驼峰” 的Mb荧光特征峰(峰a, 峰b)。 在图4(b)中O3通气1 min后的Mb溶液的谱图明显发生变化, 瑞利散射峰1和2的强度变大, 说明O3与Mb相互作用下可能产生结合产物, 致使光散射强度的增大[14]。 未处理Mb峰a和峰b对应的峰顶坐标(λ ex/λ em)和荧光强度分别为280/320 nm, 215.9和230/320 nm, 187.9。 O3处理Mb峰a和峰b对应的峰顶坐标(λ ex/λ em)和荧光强度分别为280/310 nm, 66.34和220/310 nm, 83.94。 O3处理后峰a和b的荧光强度明显减甚, 并发生蓝移, 峰a强度减弱程度略大于峰b, 说明O3与Mb相互作用后, 蛋白质体系所处微环境的极性受到外界影响, 使Mb构象发生了改变。
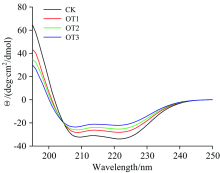
圆二色谱(CD光谱)能够灵敏地检测一些反应引起的蛋白分子的二级结构变化。 在蛋白质或多肽的规则二级结构中, 肽键是高度有规律排列的, 排列的方向决定了肽键能级跃迁的分裂情况, 因此具有不同二级结构的蛋白质或多肽所产生的CD光谱谱带的位置、 吸收的强弱都会相应地不相同[15]。 典型二级结构主要有α -螺旋、 β -折叠、 β -转角、 无规则卷曲四种, 而Mb的二级结构主要以α -螺旋为主。 如图4所示, 经O3处理不同时间的Mb的CD光谱, 是典型的α -螺旋结构为主的CD谱图, 在208和222 nm左右有两个特征负峰, 其峰值反映了α -螺旋相对含量。 α -螺旋结构含量的变化与静电作用有关。 根据所得CD数据通过young方程计算分析, α -螺旋含量由68.0%逐渐减小至37.10%, 无规则卷曲含量由25.50%增至35.90%(表1), 证明Mb二级结构发生变化, 随着与O3接触时间的增加, Mb在195 nm附近正的吸收峰强度下降。 而Mb是由153个氨基酸构成的单一肽链, 其肽链大多为α 螺旋构象, α -螺旋含量明显下降也说明了O3对Mb肽链构象影响较大。 以上结果表明, 同Mb的荧光光谱结果一样, O3的强氧化性会与Mb发生作用, 使Mb的肽链螺旋结构松散, 其稳定性下降, 蛋白质的构象发生改变, 而且与O3接触时间越长, Mb二级结构变化越明显。
| 表1 肌红蛋白二级结构变化 Table 1 Changes of myoglobin secondary structure |
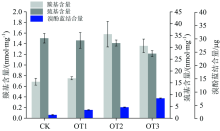
O3是一种具有强氧化物质, 会促进蛋白质的氧化。 蛋白质氧化包括蛋白质骨架断裂、 二硫键生成、 羰基生成、 蛋白质交联及构象变化。 蛋白质氧化后相对地其疏水性、 构象、 溶解度等都会改变, 且蛋白质氧化对肉的颜色、 嫩度、 持水力等都有影响[16]。 由图5可知, CK组肌红蛋白羰基含量为0.68 nmol· mg-1, 与O3发生接触后, 随着接触时间的增加羰基含量也随之上升, 在接触处理2 min后, 羰基含量增加至1.36 nmol· mg-1, 与CK组相比氧化程度加剧(p< 0.05)。 Mb的巯基含量随着与臭氧作用时间的增加而降低, 由CK组的33.88 nmol· mg-1, 减少至OT3组的27.35 nmol· mg-1。 蛋白质的表面疏水性的大小与蛋白质的疏水性基团有关, 当更多分子内部的疏水性基团暴露于水中, 蛋白质的溶解能力会下降, 表面疏水性会增大。 如图5所示, 相应地与O3处理不同时间的Mb的表面疏水性由溴酚蓝结合量表示, CK, OT1, OT2和OT3组溴酚蓝结合量依次为1.43, 3.54, 4.67和8.46 μ g, 表明蛋白质疏水性增强, 蛋白质结合水能力下降。
2.5.1 模拟过程中肌红蛋白RMSD的变化
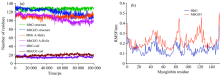
图6所示分别为模拟过程中Mb肽链和铁卟啉环相对于蛋白质骨架的均方根偏差值随时间的变化情况。 从图中可以看出, 未经O3处理的Mb肽链在15 ns后结构达到平稳, 而O3处理的则在80 ns后达到平稳, 且O3处理Mb肽链(MbGO3)的RMSD显著高于未处理, 说明在整个动力学模拟过程仔, O3处理Mb肽链结构变化较大, 且其在80 ns之前一直处于较大波动范围内, 这说明O3与Mb的作用极不稳定。 对于铁卟啉环RMSD的变化, O3处理与未处理有一定的差别, 但区分不大。 这说明铁卟啉与Mb相互作用的减弱主要是由于O3引起Mb肽链结构改变而造成的。
2.5.2 肌红蛋白二级结构变化
图7显示了O3处理和未处理Mb肽链二级结构的对比图, 结果表明: Mb肽链α 螺旋和无规则卷曲在O3处理后均发生较大变化。 O3处理肌红蛋白α 螺旋氨基酸残基量减少, 而无规则卷曲量增加[图7(a)]。 这与本试验研究结果相一致。 图7(b)可知O3处理Mb各氨基酸残基的RMSF值变化较未处理有显著不同。 RMSF值较大时, 二级结构越容易发生变化, 说明Mb氨基酸残基受到O3的影响, Mb二级结构被O3破坏。 这与图7(a)结果相互印证。 由图7b可以看出Mb肽链第83— 94氨基酸残基和103— 127氨基酸残基RMSF变化较大, 其分别位于Mb活性口袋的正面和背面。 说明O3主要从这两个位置来进入Mb活性口袋, 引起肌红蛋白二级结构改变。
运用以上几种不同的光谱技术方法, 可以明显的检测到O3对Mb的结构和性质产生了影响作用。 在紫外可见光波长扫描下得到了Mb在不同氧化状态下的光谱图, 通过观察Mb光谱图的特征峰变化, 可以得知Mb呈现的主要氧化状态情况, 并且选取的特定波长数据估算得知O3会造成了OMb和MMb相对含量的变化; 不同荧光光谱技术对Mb溶液进行扫描检测结果显示O3能够对Mb的构象产生影响, 使其发射内源性荧光的氨基酸残基所处微环境极性发生改变, 氨基酸残基疏水性增大; 而在蛋白质二级结构的CD光谱测定表明随着O3与Mb接触反应时间的增加, α -螺旋含量持续降低, 无规则卷曲增大, 进一步说明蛋白二级结构遭到破坏, 蛋白质的结构稳定性受到了影响。 通过羰基、 巯基和表面疏水性化学指标的检测进一步证实O3对Mb的结构造成了影响, 促使了蛋白质的氧化, 导致蛋白质羰基产物的积累, 巯基含量的下降, 蛋白内部疏水基团的暴露, 表面疏水性增大。 分子动力学模拟更加直观形象的表明O3可以与Mb氨基酸残基发生相互作用, 影响Mb二级结构。 以上结果将有助于了解O3对血红素蛋白反应的作用机制研究, 为抑制生鲜肉色泽劣变措施的制订提供理论参考依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|