作者简介: 黄朝波, 1994年生, 天津科技大学食品工程与生物技术学院研究生 e-mail: huangchaobo94@163.com
近年来, 随着对红曲色素的深入研究, 其越来越多的功能活性被发现, 但其某些致毒作用也使红曲色素的安全性受到了质疑。 因此, 阐明红曲色素在人体中与大分子的相互作用对深入研究其转运代谢及毒副作用具有重要作用。 光谱法是研究溶液中小分子与蛋白质相互作用的一种有效方法, 其具有灵敏度高、 选择性强、 用样量少、 方法简单等优点, 在研究中得到越来越广泛的应用。 为探究红曲色素在体内的转运机制和血液中与转运蛋白的相互作用, 本研究首次用红斑红曲胺(Rubropunctamine, Rub)作为红曲色素的典型代表与牛血清白蛋白(bovine serum albumin, BSA)相互作用。 利用内源荧光光谱、 同步荧光光谱探究不同浓度的Rub对BSA的荧光猝灭作用, 采用Stern-Volmer方程、 Lineweaver-Burk函数和Van’t-Hoff方程对不同温度下BSA与Rub作用后在 λEX/ λEM(280.0 nm/340.0 nm)( λEX/ λEM表示荧光的激发波长和发射波长)的内源荧光强度值确定二者作用类型、 结合位点数及相互作用机理, 进一步利用圆二色谱定量测定了Rub的结合对BSA二级结构影响, 最后运用软件Discovery Studio2.5对Rub与BSA的相互结合进行分子对接模拟。 结果显示: (1) Rub对BSA具有较强的内源荧光猝灭效果, 在 λEX/ λEM(280.0 nm/340.0 nm)的荧光强度下降306.1, 发射波长由338.6 nm蓝移到331.8 nm, 同步荧光显示荧光猝灭主要发生在色氨酸残基上。 (2)Stern-Volmer方程计算得到动态猝灭速率常数 Kq为2.335×1012 L·(mol·s)-1, 远大于此类型允许的最大扩散碰撞常数2.0×1010 L·(mol·s)-1, 判定该猝灭是单纯的静态猝灭过程。 利用Lineweaver-Burk函数计算得到静态猝灭速率常数 Kq随温度升高而减小, 即该复合物在温度升高时变得不稳定。 (3)利用等式lg[( F0- F) /F]=lg K0+ nlg cQ得到两者结合常数可达103 L·mol-1以上, 结合位点数近似为1, 且随着温度增加表观结合常数变小。 (4)不同温度下Van’t-Hoff方程计算得到Δ H, Δ S, Δ G都小于0, 则该相互作用能自发进行且氢键和范德华力是其主要的相互作用力。 (5)圆二色谱测得BSA与Rub结合后二级结构中α-螺旋含量由29.4%降至20.2%; β-折叠由39.9%上升到50.7%; β-转角由6.5%下降到3.5%; 无规则卷曲由24.2%上升到25.6%。 (6)分子对接发现Rub结合点位于 BSA中由Arg458, Asp108, Glu424和Ser428等氨基酸形成的口袋内, 与Arg458有范德华力作用, 与Arg144形成分子内氢键, 影响到Trp213微环境。
In recent years, more and more functional activities have been discovered with the in-depth study of the monascus pigment, but some toxic effects of the monascus pigment have raised questions about its safety. Therefore, it is important to elucidate the interaction between monascus pigments and macromolecules in human body for further study of their transport, metabolism and toxic side effects. Spectroscopy is an effective method to study the interaction of small molecules with proteins in solution. It has been widely used in research for its high sensitivity, strong selectivity, low sample size, and simple method. In this study, rubropunctamine(Rub) was taken as the typical representative of monascus pigment to research the interaction of Monascus pigments with macromolecules bovine serum albumin(BSA). The fluorescence quenching effect of different concentrations of Rub on BSA was investigated by endogenous fluorescence spectroscopy and synchronous fluorescence spectroscopy. Then Stern-Volmer equation, the Lineweaver-Burk function and the Van’t-Hoff equation were used to determine the type of action, the number of binding sites and the interaction mechanism of BSA and Rub. The effect of Rub on the BSA secondary structure was quantitatively determined by circular dichroism spectrum. Finally, using the computer to perform the molecular docking simul- ation on the interaction of Rub and BSA. The results show: (1) Rub has a strong fluorescence quenching effect on BSA, and endogenous fluorescence spectrum shows that endogenous fluorescence decreases by 306.1 and emission wavelength shifts by 6.8 nm. Synchronous fluorescence shows that fluorescence quenching mainly occurs on tryptophan residues. (2) The dynamic quenching rate constant Kq calculated by the Stern-Volmer equation is 2.335×1012 L·(mol·S)-1, which is much larger than the maximum diffusion collision constant allowed: 2.0×1010 L·(mol·S)-1, and the annihilation is a pure static quenching process. (3)The binding constants reach above 103 L·mol-1 which is calculated by the equation lg[( F0- F) /F]=lg K0+ nlg cQ, and the number of binding sites is approximately 1. The apparent binding constant becomes smaller with increasing temperature. (4) Under different temperature, Δ H, Δ S and Δ G are less than zero, so the interaction can occur spontaneously and hydrogen bonding and van der Waals force are the main interaction forces. (5) the α-helical content in the secondary structure of BSA combined with Rub decreased from 29.4% to 20.2%; The β-fold increased from 39.9% to 50.7%; β-rotation decreased from 6.5% to 3.5%; The random coil increased from 24.2% to 25.6%. (6) Rub is located in the pocket formed by Arg458, Asp108, Glu424, Ser428 and other amino acids in BSA, and it has Van Der Waals force with Arg458 and hydrogen bond interaction with Arg144 which affects Trp213 microenvironment.
红曲色素主要是6种色素混合而成[1](表1), 有红斑红曲胺(Rubropunctamine)、 红曲玉红胺(Monascrubramine)、 红斑红曲素(Rubropunctatin)、 红曲玉红素(Monascorubrin)、 安卡红曲黄素(Ankaflabin)、 红曲素(Monascin)[2]。
| 表1 红曲色素六种主要成分 Table 1 The six main composition of monascus pigments |
已有的研究表明, 红曲色素具有多种生理活性。 Alberto Mazza[3], Tshongo[4]和Derosa[5]等研究都有发现红曲米能明显降低血清总胆固醇(TC), 低密度脂蛋白胆固醇(LDLC), 甘油三酯(TG)和葡萄糖值。 Kurokawa等[6]研究发现红曲色素能消除活性氧物质, 使癌细胞内促氧化剂/抗氧化剂不平衡而死亡。 但红曲色素潜在的毒性限制了其在食品行业的进一步应用。 如有报道称Rubropunctatin和Monascorubrin对鸡胚胎具有毒性和致畸作用[7]。 FDA以缺乏对其功效, 安全性和标准化制备方法的保证的原因于2007年和2013年向消费者发出警告, 禁止服用红曲米产品[8]。 Couturier[9]研究发现使用红曲提取物能造成肝脏实质的坏死性破坏, 乳糖蛋白基质崩溃, 胆汁淤积和胆管损伤等副作用。 因此, 深入研究红曲色素在体内与生物大分子的相互作用对进一步探究红曲色素的转运及致毒机理具有重要意义。
红斑红曲胺(Rub)是红曲色素中红色色素主要成份, 其相对分子量353.418, 结构如图1(a)所示。 血清白蛋白是哺乳动物血浆中含量最高的蛋白之一, 也是体内各种小分子的运输载体, 其中牛血清白蛋白(BSA)是一种研究小分子相互作用的经典模型蛋白, 其相对分子量66.4 kDa, 有583个氨基酸残基, 具有稳定心型结构图1(b), 在研究小分子转运和小分子与蛋白相互作用的研究上被广泛使用[10, 11, 12]。
本研究以牛血清白蛋白为模型, 利用内源荧光光谱、 同步荧光光谱, 首次探究不同浓度的Rub对BSA的荧光猝灭作用, 采用Stern-Volmer方程、 Lineweaver-Burk函数和Van’ t-Hoff方程根据不同温度下二者作用后在λ EX/λ EM(280.0 nm/340.0 nm)的内源荧光值确定二者作用类型及结合位点数及相互作用机理, 进一步利用圆二色谱定量测定了Rub的结合对BSA二级结构影响, 最后运用计算机对其相互结合进行分子对接模拟, 明确Rub与BSA相结合位点和作用力的信息。 为阐明红曲色素在体内的运输及进一步研究相关活性功能和潜在生理毒害作用奠定基础。
F-7100荧光光度计(Hitachi, Japan); 圆二色谱Spectrometer J-810(Jasco, Japan); XMTD-204数显恒温水浴锅(天津欧诺仪器仪表有限公司); T1000电子天平电 (美国双杰(兄弟)集团有限公司。 牛血清白蛋白(sigma, V900933); Rubropunctamine( Nova Chemistry, NVIP11864); 磷酸氢二钠(索莱宝, D9790); 磷酸二氢钠(索莱宝, S5830); 氯化钠( 索莱宝, S8210); 无水乙醇(天津市科密欧化学试剂有限公司, 64-17-5); 实验用超纯水。
1.2.1 溶液配制
PBS(储备液0.2 mol· L-1, pH 7.4, 使用时稀释成0.01 mol· L-1)、 BSA溶液(储备液1 mg· L-1, 使用时稀释成0.1 mg· mL-1)、 Rub溶液(25 mg· L-1): 取2.5 mg的Rub充分溶解于2 mL 95%乙醇, 用超纯水定容到100 mL。
1.2.2 荧光光谱分析
精确移取BSA溶液(0.1 mg· mL-1) 1 mL于10 mL比色管中, 将Rub溶液依次取40, 80, 120和160 μ L于10 mL比色管中, 用PBS(0.01 mol· L-1)定容到10 mL, 分别在303, 308和313 K温度下避光水浴反应20 min, 立即进行荧光测量。
测定条件:
三维荧光: 激发波长(λ EX) 200~300 nm, 发射波长(λ EM) 300~400 nm, 激发和发射狭缝宽度5 nm, 间隔5 nm, 扫描速度30 000 nm· min-1, 电压500 V。
内源荧光: 激发波长(λ EX) 280 nm, 发射波长(λ EM) 300~500 nm, 激发和发射狭缝宽度5 nm, 扫描速度1 200 nm· min-1, 电压500 V。
同步荧光: 固定发射波长与激发波长差值为15和60 nm研究同步荧光, 激发波长(λ EX) 200~500 nm, 激发与发射狭缝宽度5 nm, 扫描速度1 200 nm· min-1, 电压500 V。
1.2.2 圆二色谱
测定条件为: 圆形比色皿0.1 cm吸收池, 扫描范围190~260 nm, 步幅1 nm, 扫描速度200 nm· min-1, 氮气吹扫, 恒温25 ℃。
1.2.3 分子对接
BSA三维结构来自于RCSB PDB数据库, PDB ID: 4F5S, Rub三维结构来自pub Chem数据库, pub CID: 6452444, 利用Open Babel GUI对Rub做优化处理。 使用Discovery Studio2.5工具中LibDock模块进行分子对接。 首先对受体BSA进行相关优化(去水, 加氢, 加力场和电荷), 通过软件识别活性中心发现BSA中有22个潜在结合位点。 选择评分最高的位点进行定义, 修改半径为10, 其他选择默认值。 对接后产生91种对接构像, 选择评分最好的作为对接结果分析。
2.1.1 Rub与BSA相互作用的三维荧光光谱
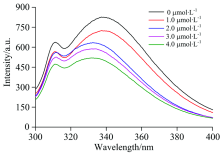
BSA和BSA-Rub体系的三维荧光结果如图2所示。 由图知, (a)和(b)都有两个典型的特征峰在Peak1 λ EX/λ EM(225.0 nm/340.0 nm), Peak2(280.0 nm/340.0 nm)。 其中Peak1是BSA多肽-骨架结构的荧光特征峰, Peak2是内源荧光特征峰。 图2(a)的Peak1(λ EX/λ EM/Intensity)(225.0/340.0/1 262.1)和Peak 2(280.0/340.0/775.4), 图2(b)的Peak1(225.0/330.1/634.5)和Peak2(280.0/330.2/555.2), 可知当加入Rub后较空白组Peak1发射波长蓝移9.9 nm, 荧光强度降低了627.6。 Peak2的发射波长蓝移了9.8 nm, 荧光强度减弱了220.2。 已知BSA空间结构由三个线性排列的不同结构的结构域(Ⅰ — Ⅲ )组成, 每个结构域由两个亚结构域(A和B)组成, 几乎所有的疏水氨基酸残基都存在这两个亚结构域中。 实验结果显示Rub猝灭了BSA的荧光, 说明Rub的结合后让BSA空间结构发生了改变。 发射波长蓝移表明, Rub与BSA相互作用改变了荧光基团微环境的极性, 从而导致BSA体系极性变小。
 | 图2 BSA与BSA-Rub三维荧光光谱Fig.2 3-D fluorescence spectra of BSA and BSA-RubcBSA=0.01 mg· mL-1, the concentration Rub:(a): 0 μ mol· L-1; (b): 11.32 μ mol· L-1, T=303 K |
2.1.2 Rub与BSA相互作用的内源荧光和同步荧光光谱
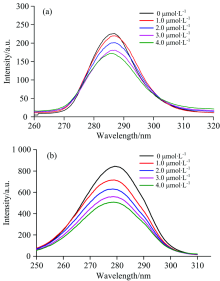
由图3可知, BSA在λ EX/λ EM(280.0 nm/340.0 nm)时具有强烈的特征荧光。 BSA内源荧光主要来源于苯丙氨酸, 酪氨酸, 色氨酸。 由于存在能量传递, 内源荧光中以色氨酸(Trp)产生的荧光为主。 设定激发波长在280.0 nm, 发射波长300.0~400.0 nm, 梯度增加Rub浓度并进行荧光光谱波长扫描。 结果如图3所示, 随着Rub浓度的增加, BSA的荧光强度降低从826.0到519.9, 发射峰蓝移了6.8 nm(338.6~331.8 nm), 峰型没有明显变化。 Rub在浓溶液时有荧光性质, 但其发射峰位于460 nm附近, 所以在此处不会对BSA发射波长造成影响。 结果表明, Rub和BSA的相互作用可强烈地猝灭BSA内源的荧光。
 | 图3 BSA与不同浓度Rub相互作用内源荧光光谱Fig.3 Fluorescence emission spectra of BSA with different concentration of RubcBSA=0.01 mg· mL-1, λ EX=280 nm, T=303 K |
同步荧光(图4)能在不同Δ λ (发射波长减去激发波长, λ EM-λ EX)值将酪氨酸(Trp)和色氨酸(Tyr)残基特征荧光峰分辨出来, 常用来研究小分子对蛋白质中发色团氨基酸残基微环境的影响。 当Δ λ 固定在15和60 nm时, 同步荧光谱能分别给出了酪氨酸和色氨酸残基的荧光特征信息, 从而能够分析Rub与BSA的结合位置[13]。 Δ λ =15和60 nm的同步荧光光谱如图4(a)和(b)所示。 随着Rub浓度增加, 当Δ λ =15 nm时, 代表酪氨酸残基荧光强度λ EX/λ EM/Intensity(286.0 nm/301.0 nm/226.2)到(286.2 nm/301.2 nm/171.9)出现较弱减少但发射波长未出现明显移动。 Δ λ =60 nm时, 色氨酸残基的荧光强度随Rub浓度变化为λ EX/λ EM/Intensity(279.2 nm/339.2/845.1)到(277.6/337.6/504.7), 发射波长由339.2 nm蓝移到337.8 nm, 荧光强度由845.1减少到504.7, 推断色氨酸所处的环境发生改变。 由此知Rub对BSA荧光猝灭主要原因是相互作用后导致色氨酸荧光猝灭, 这是因为Rub与BSA相互作用主要发生在色氨酸附近导致其所处环境发生改变, 使其极性变小, 影响了荧光强度。
2.2.1 动态猝灭常数(Kq)的计算
为了判断BSA-Rub体系荧光猝灭类型和猝灭常数Kq, 研究了梯度温度下BSA和Rub的反应体系。 动态荧光猝灭遵循Stern-Volmer方程[14]F0/F=1+KSVcQ=1+Kqτ 0cQ, 式中: F0与F分别表示Rub加入前后的BSA内源荧光强度; KSV为动态猝灭常数; Kq表示动态猝灭速率常数; τ 0为生物大分子的荧光寿命, 一般为10-8 s, cQ为Rub的浓度(μ mol· L-1)。 按Stern-Volmer方程, 以(F0/F)-cQ作出Stern-Volmer曲线见图5, 动态猝灭相关参数见表2。
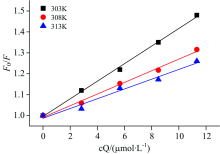 | 图5 不同温度下BSA与Rub相互作用Stern-Volmer曲线Fig.5 Stern-Volmer curves of fluorescence quenching of BSA by Rub at different temperatures |
| 表2 动态猝灭相关参数 Table 2 Dynamic quenching equation parameters |
从表2可以看出, 在3种温度条件下(R2均> 0.99), 随着温度的升高(303~313 K), 斜率值KSV减小, 从4.205× 104 L· mol-1降低到2.335× 104 L· mol-1, Kq值分别为4.205× 1012 L· (mol· s)-1(303 K); 2.784× 1012 L· (mol· s)-1(308 K); 2.335× 1012 L· (mol· s)-1(313 K), 其中最小Kq值远大于猝灭剂对生物大分子的最大扩散碰撞常数2.0× 1010 L· (mol· s)-1 [15], 且该数值随温度升高而降低, 故此判断Rub对BSA荧光猝灭不属于动态猝灭过程, 应该是属于单纯静态猝灭过程, 即BSA与Rub形成稳定基态复合物从而导致BSA荧光光谱的变化。
2.2.2 静态猝灭常数(KLB)的计算
静态猝灭可用Lineweaver-Burk函数1/(F0-F)=1/F0+1/(KLBF0cQ)验证, 式中: F0为BSA本身的内源荧光强度; F为添加不同浓度Rub后BSA的荧光强度; KLB为静态猝灭常数, KLB=Kqτ 0; Kq表示静态猝灭速率常数; τ 0为生物大分子的荧光寿命, 一般为10-8 s; cQ为猝灭剂Rub浓度(μ mol· L-1)。 以1/(F0-F)~1/cQ作图得到不同温度条件下Lineweaver-Burk双倒数函数曲线(图6), 相关参数见表3。
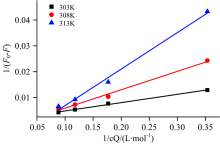 | 图6 不同温度下BSA与Rub相互作用的Lineweaver-Burk函数Fig.6 Lineweaver-Burk curves of fluorescence quenching of BSA by Rub at different temperatures |
| 表3 静态猝灭相关参数 Table 3 Static quenching equation parameters |
从图6和表3看出, 所有直线R2均大于0.98, 线性拟合较好。 Rub对BSA的荧光猝灭符合静态猝灭方程, 随着温度升高斜率变大, 即Kq减小, Kq从4.28× 1012 L· (mol· s)-1减小到9.6× 1011 L· (mol· s)-1。 说明BSA与Rub形成的复合物在温度升高时变得不稳定, 符合静态猝灭的变化趋势。
2.2.3 结合位点n和表观结合常数K0的计算
如果小分子Rub与生物大分子BSA发生静态猝灭相互作用, 则BSA中存在独立的结合位点。 表观结合常数K0和结合位点n可以利用等式lg[(F0-F)/F]=lgK0+nlgcQ计算[16]。 式中: F0和F分别为未加入和加入猝灭剂后荧光物质的荧光强度; K0为猝灭反应的表观结合常数; n为结合位点数; cQ为Rub的浓度(mol· L-1)以lg[(F0-F)/F]对lgcQ作图结果如图7所示。 两者间呈线性相关, 得出线性方程的斜率和截距来计算不同温度下BSA与Rub的表观结合常数K0和结合位点数n, 结果见表4。
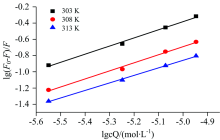 | 图7 不同温度下BSA与Rub相互作用的 lg[(F0-F)/F]-lgcQ图Fig.7 lg[(F0-F)/F] vs lgcQ graph describing the interaction of BSA by Rub at different temperatures |
| 表4 结合常数和结合位点数 Table 4 Binding constants and binding sites |
从表4中可以看出两者结合常数可达103 L· mol-1以上, 属于较强的结合。 结合位点数近似为1, 即一分子BSA有一个Rub结合位点。 随着温度增加表观结合常数变小, 则是因为Rub对BSA是静态猝灭作用, 二者形成的复合物结合稳定性受温度影响较大。
2.2.4 BSA与 Rub之间的作用机理
小分子和蛋白质之间结合作用力包括静电作用、 氢键作用、 范德华力、 疏水作用等。 根据Van’ t Hoff方程[17]Δ G=RTlnK, lnK2/lnK1=[1/T1-1/T2]Δ H/R, Δ G=Δ H-TΔ S[18]计算Rub与BSA之间的热力学参数可以来确定二者之间的作用力类型。 当Δ S和Δ H都为正时, 为疏水作用力; 当Δ H约为0, Δ S大于0时为静电作用力; Δ S和Δ H都小于0时为氢键和范德华力[19]。 不同温度下Rub与BSA体系的相关热力学参数如表5。 由表5知, Δ H< 0, Δ S< 0, 说明氢键和范德华力是该结合体系主要的相互作用力; 而且在不同温度下自由能Δ G都小于0, 所以该反应能够自发进行的。
| 表5 BSA与Rub相互作用的热力学参数 Table 5 Thermodynamic parameters of the interaction between BSA and Rub |
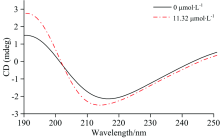
运用CD光谱研究了BSA与Rub相互作用对BSA主链构象影响, 在190~250 nm范围的CD谱如图8, 随着Rub与BSA反应, CD谱整体形状没有明显变化, 其中代表α -螺旋特征负峰波长[20]由214 nm移动至217 nm。 通过采用数据库处理得到BSA二级结构中α -螺旋含量由29.4%降至20.2%; β -折叠由39.9%上升到50.7%; β -转角由6.5%下降到3.5%; 无规则卷曲由24.2%上升到25.6%。 总的来说主要改变是α -螺旋到β -转角的转变。 可能是Rub与BSA中α -螺旋结构中的氨基酸发生氢键缔合等作用, 引起BSA空间变化, α -螺旋数量下降[21]。
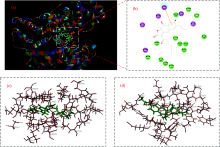
Rub与BSA结合构型用Discovery Studio2.5做分子模拟结果如图9所示。 结合图A分析, 在得分最高的结果中, 结合后Rub位于由Arg458, Asp108, Glu424和Ser428等氨基酸形成的口袋中。 Rub伸进BSA的这个疏水腔内, 两者产生了疏水相互作用。 在图B中Rub与BSA主要依靠氢键与范德华力结合(紫色为氢键作用, 蓝色为范德华力作用), 这与热力学计算结果一致。 在这个口袋中Rub与Arg458有范德华力作用, 与Arg144形成氢键作用, 距离Trp213较近, 影响到其微环境, 导致了其荧光性质猝灭。 图9(c)和(d)中虚线为氢键, 从图中可以发现其氢键作用主要为分子内氢键。
利用多种光谱技术研究了Rub-BSA的相互作用机理。 三维荧光发现其对BSA有明显的荧光猝灭作用。 通过同步荧光发现色氨酸光强度由845.1减少到504.7, 发射波长由339.2 nm蓝移到337.8 nm, 酪氨酸未见明显变化。 进一步运用相关的数学计算得到Rub对BSA猝灭类型为静态猝灭, 二者通过形成稳态复合物导致了BSA荧光值变化, 两者静态结合常数K0可达103 (L· mol-1)以上, 结合位点数n近似为1, 属于较强的结合。 经过热力学相关计算不同温度下的Δ G都小于0, 则反应能自发进行, 且Δ H< 0, Δ S< 0, 则二者作用力的类型为范德华力与氢键。 推测Rub与BSA的结合位置可能位BSA疏水口袋内且更靠近色氨酸, 二者通过次级键相互作用后改变了色氨酸的微环境, 运用圆二色谱表明Rub与BSA结合后降低了蛋白的α 螺旋数量验证了此结论。 最后运用计算机进行分子对接发现Rub主要依靠氢键与范德华力结合于由Arg458, Asp108, Glu424和Ser428等氨基酸形成的口袋中, 距离Trp213较近。 Rub作为红曲色素的一种代表色素, 在本研究详细地阐明了Rub与BSA的相互作用机理, 这对进一步天然红曲色素在体内转运分布及其代谢过程和安全性评估奠定基础。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|