作者简介: 谢鲁源, 1995年生, 清华大学医学院硕士研究生 e-mail: xly16@mails.tsinghua.edu.cn
随着医疗诊断需求的增加, 生物分子检测技术越来越受到人们的重视, 液相生物芯片技术作为一种高通量, 多通道的分子检测手段在近几年得到了飞速发展。 通过层层自组装方法制备以微片为载体的拉曼光谱编码液相生物芯片, 并利用自行搭建的一套高灵敏度、 高分辨率的光学系统, 实现对液相生物芯片的定性与定量分析。 光学系统由拉曼光谱检测系统与荧光显微成像系统耦合而成。 在拉曼光谱检测系统中激光器发射出785 nm波长的激光, 通过二向色镜, 带反反射镜与物镜汇聚到样品上, 样品产生的拉曼散射光, 经物镜, 带反反射镜, 二向色镜与拉曼滤波片, 最后通过凹透镜聚焦到光谱仪的狭缝上, 光谱仪色散实现在线阵CCD上拉曼光谱的获取。 荧光显微成像系统应用光学成像原理, 通过调节凹透镜与405 nm的激发光之间的距离, 使激发光通过物镜均匀的照射到样品之上, 样品激发出的荧光, 通过物镜, 带反反射镜, 二向色镜, 滤波片与相应的凹透镜, 最后成像到面阵CCD上。 改进传统便携式拉曼光谱检测系统光路并选用相应波段的带反反射镜与焦距20倍的物镜完成拉曼光谱检测系统与荧光显微成像系统的耦合。 为了减少两路系统之间的相互影响选用合适的二向色镜以及滤波片, 在提高耦合系统获取数据的准确性中有着重要的作用。 该系统通过对反应之后的液相生物芯片进行拉曼光谱检测, 以完成对每个编码玻片的定性识别, 即解码; 同时激发反应后液相生物芯片的荧光并采集荧光强度图, 根据每个解码玻片上的荧光强度值完成对目标检测物的定量分析。 区别于传统荧光编码液相生物芯片, 拉曼光谱编码具有稳定性更强, 光谱分辨率更高等优点。 该光学系统集拉曼光谱检测系统与荧光显微成像系统于一体, 解决了目前未有基于拉曼编码的液相生物芯片的检测系统的问题, 并且可同时对多种目标物进行识别和定量分析, 提升了实验结果的准确性。
With the increasing demands for medical diagnosis, more and more attention has been paid to the technology of biomolecular detection. As a high throughput and multiplexed molecular detection method, suspension array has developed rapidly in recent years. In this study, a Raman spectra-encoded suspension array with micro-quartz pieces as the carrier was prepared by the layer-by-layer self-assembly method, and a high sensitivity and high resolution optical system was built to realize the qualitative and quantitative analysis of the suspension array. The home-built optical system was obtained by coupling Raman spectroscope with a fluorescence microscope. For the Raman spectroscope, a 785 nm laser was converged on the sample through dichroic mirrors, reflector and object lens. Then the Raman scattering light produced by the sample passed through the objective lens, anti-reflection mirror, dichroic mirror and Raman filter, and focused on the slit of the spectrometer via the concave lens. And finally, Raman spectra can be obtained by the dispersion effect of the spectrometer. For the fluorescence microscope, which used the optical imaging principle, the excitation light could irradiate the sample uniformly through the objective lens by adjusting the distance between the concave lens and the excited light of 405 nm. Then, the emitted fluorescence passed through an objective lens, an anti-reflection mirror, dichroic mirror, a filter and a concave lens, and finally imaged on the matrix CCD. The coupling of the Raman spectroscope and the fluorescence microscope was completed by improving the optical path of the conventional portable Raman spectroscope and selecting the anti-reflecting mirror with the specific band and the objective lens with a focal length of 20×. In order to reduce the interaction between the Raman spectroscope and the fluorescence microscope, the appropriate dichroic mirror and filter were selected to improve the coupling system. The Raman spectra of the suspension array were detected by home-built system to accomplish the qualitative identification of each encoded micro-quartz pieces. At the same time, the fluorescence of the encoded micro-quartz pieces was excited and the fluorescence signal was collected to complete the quantitative analysis of the target analyst according to the fluorescence intensity value on each encoded micro-quartz pieces. Compared with traditional fluorescence-encoded suspension arrays, Raman spectra encoding method has the advantages of stronger stability and higher spectral resolution. This optical system integrates Raman spectroscope and fluorescence microscope, which solves the problem that there is no suspension array detection system based on Raman encoding method at present and can qualitatively and quantitatively analyze a variety of target molecules at the same time, improving the accuracy of the experimental results.
液相生物芯片技术是目前新兴的生物分子检测方法。 它集荧光编码微球、 流式细胞术、 激光检测和高速数字信号处理等多项技术为一体的高通量分子技术, 它主要是以不同种类的荧光编码微球作为载体进行杂交反应和信号检测, 通常多以多色流式细胞仪作为解码和检测平台, 通过把芯片技术和流式细胞检测技术结合到一起, 在液相反应体系中可以实现核酸、 蛋白质等多种生物分子的检测[1]。 液相芯片相比于固态微阵列芯片有反应速率快、 重复性及灵活性好等多种优势, 和其他传统的免疫检测方法相比, 液相生物芯片技术具有高通量、 多指标联合检测、 高敏感性、 高特异性、 线性范围宽、 反应快速、 重复性好以及操作简便等优点[2]。
液相生物芯片主要应用光解码技术, 光学编码利用合成在液相生物芯片中的光学特性的物质或者结构来对液相生物芯片进行编码, 杂交反应后用光源激发微球, 根据发出的特异性光谱进行解码, 从而获得目标分子的种类信息。 荧光编码是目前液相生物芯片技术中最为成熟的编码技术, 已经成目前走向产业化的主流编码方式[3]。 该编码方式主要是将微球与荧光物质相结合, 通过改变荧光物质的颜色与用量, 来获取不同种类的编码微球[4]。 在理论上, 如果不同种类的荧光物质有N种, 用量有n种梯度, 那么可获得的编码数量为Nn种。 由此可以看出其庞大的编码数量。 但是, 一些荧光材料会带来一些无法避免的问题[4]。 不同的荧光材料激发光的波长不同, 所以在解码系统中需要多个光源, 增加了搭建系统的成本。 一些荧光物质荧光稳定性差, 长时间激发, 已发生漂白与荧光猝灭。 部分荧光染料具有较宽的谱峰, 可能会使部分谱峰发生重叠, 从而降低了荧光编码的数量[1]。
拉曼散射光谱, 作为一种非常重要的探测手段, 可以广泛地应用于医学检测, 考古研究, 食品安全等多个领域。 相比于传统的荧光光谱编码方法, 拉曼光谱因为具有极高的光谱分辨率, 稳定的谱峰, 且信号的重现性好等优点, 使得基于拉曼光谱编码的液相生物芯片技术在近年来得到了很好的应用[5, 6, 7, 8, 9]。 荧光显微成像技术是目前非常成熟的成像技术, 在检测分子的激发荧光成像等多方面有着显著的应用。
本文主要工作是通过制备不同拉曼分子载体的液相生物芯片, 并研制了一套基于高灵敏度、 高分辨率拉曼光谱仪和荧光显微成像耦合的系统。 该系统有两条光路系统组成, 一路为拉曼光谱系统, 采用波长为785 nm的激光器作为光源, 通过激发拉曼编码液相生物芯片, 可根据采集得到的拉曼光谱中特征峰的有无对其进行解码识别, 做定性分析; 另一条光路为荧光显微成像系统[9], 由一个波长为405 nm的光源激发反应后液相生物芯片上的荧光标记物, 根据荧光强度来确定待测分子的数量, 实现定量分析。 截至目前, 利用拉曼编码液相生物芯片进行检测的方法的可行性已得到验证, 但将解码和定量分析分开做增加了实验结果的不准确性, 而本文搭建了一套可同时检测的系统, 通过双色激光的可进行实时检测, 完成检测结合的生物分子的种类和数量, 本文的方法及装置, 还可以选用不同形状, 种类, 尺寸的微片或微球来做为不同种类探针分子的载体, 在液相环境下参与杂交反应。 这样让液相杂交反应的载体的制备变得简单可靠, 选择范围更广。
本文搭建的拉曼光谱检测与荧光显微成像耦合系统, 简称RSFM系统, 装置原理图如图1所示。 分为四个模块, 分别为: 荧光显微成像模块, 拉曼光谱检测模块, 耦合模块, 控制模块。
在图1中, 拉曼光谱检测模块, 耦合模块, 控制模块构成了拉曼光谱检测系统[10, 11]。 在拉曼光谱检测系统中, 激光光源1发出785 nm的激光, 经过截止波长为785 nm的二向色镜2, 反射波段为600~1 000 nm的带反反射镜, 最后, 经过物镜使激发光汇聚到样品上, 样品激发出拉曼散射, 拉曼散射光先通过物镜, 在经带反反射镜, 二向色镜和拉曼滤波片, 最后经过双胶合消色差透镜, 使拉曼散射光汇聚到光谱仪当中, 光谱仪进行光谱的色散, 使不同波长的光汇聚到线阵CCD[12]的不同像素点上。 CCD连接控制模块, 在控制模块中完成了对线阵CCD光谱的获取以及实验数据处理。
在图1中, 荧光显微成像模块, 耦合模块, 控制模块构成了荧光显微成像的光路。 在荧光显微成像的光路中, 激发光(405 nm)从激发光源2发出, 经消色差透镜2, 截止波段在405 nm的二向色镜1, 通过调节消色差透镜2, 使激发光在焦距在物镜的前焦点上, 物镜平行射出激发光, 使激发光均匀照射在样品之上, 样品激发荧光后, 通过物镜, 带反反射镜, 二向色镜1, 消色差透镜, 成像到面阵CCD中, 最后, 在控制模块上获取面阵CCD上的荧光显微图像[13]。
基于图1, 要完成系统的搭建, 需要考虑多种问题, 每一个光学器件的选择都要经过缜密分析, 认真的挑选。
(1)光源
在光源选择方面, 选用了及红外波段的光源, 相较于其他波段的光源如: 473和650 nm波段的光源, 近红外波段光源不会激发荧光背景噪声, 这对拉曼光谱的获取显得尤为重要。 因为拉曼光谱强度非常低, 很容易泯灭在背景噪声之中, 所以说荧光干扰对拉曼光谱的影响很大。 选蓝紫光波段的光源, 虽然易激发拉曼散射, 但荧光背景噪声大。 最后, 在成本方面, 红外光光源造价与蓝紫光相近。 所以综合以上几种优势, 本文选用了785 nm的半导体红光激光器, 其出射光的最大的功率可达500 mW。
(2) 二向色镜的选择
在图1中, 可以知道二向色镜在光路有着重要的作用, 它们不仅起到了反射激发光的作用, 而且在接受光的一路起到滤光片的作用, 这就要求在二向色镜选择上要求合适的波段, 并且二向色镜的截止曲线与通过曲线之间斜率绝对值非常大, 过渡曲线非常陡。 在本系统中, 针对激发光源, 荧光显微成像光路中的二向色镜选用的473 nm的截止波长, 在拉曼光谱检测的光路中, 选择二向色镜的截止波长为785 nm, Semrock 公司的LPD02-785RU-25。
(3)消色差透镜的选择
在本系统中, 消色差透镜选择是双胶合消色差透镜, 它是一种把低分散的冕牌玻璃正透镜和高分散的火石玻璃负透镜粘接而成的消色差透镜, 对分散的不同值和透镜形状进行了优化, 实现了最小色差。 因此, 此类透镜可在整个可见光区域使用。 其球差在设计时也进行了优化, 和单个透镜相比, 消色差双胶合透镜的球差要小得多。 使用于无限共轭状态时, 其球差最小。 对不同的光有不同的要求, 如在图1中, 拉曼光路中的消色差透镜3, 焦距大小为50 mm, 它的作用是把拉曼散射光汇聚到光谱仪的狭缝上。 在荧光显微成像光路中, 消色差透镜1, 2分别选择了焦距为120和50 mm, 一个作用是成像在面阵CCD上, 另一个作用是使激发光源聚焦在物镜的前焦点。
(4)滤波片的选择
在前文中提到二向色镜有一定的滤波作用, 但滤波片的性能对实验的影响非常大, 它主要作用是对反射回来的激发光进行滤波。 在拉曼光路中, 拉曼滤波片决定着本系统收集拉曼散射光的效率, 在荧光显微成像光路中, 滤波片决定了荧光显微成像系统的成像质量。 基于以上的需求, 要求两种滤波片的截止频率的斜率非常大, 其通过的波段与阻断的波段之间的变化曲线非常的快。 在本系统中, 拉曼光路中选用的是Semrock公司针对785 nm的激发光设计的长通滤波片, 直径为25.2 mm, 型号为LP02-785RS-25。 在荧光光路中, 选择了THORLABS公司, 针对500 nm左右激发荧光的长通滤波片, 直径为25.2 mm, 型号为FELH500。
基于微片的液相生物芯片的制备流程如图2所示, 主要分为五个流程, 在流程1中的红色小球代表编码的拉曼0报告分子, 如2-萘硫酚, 对甲苯硫酚等。 黑色棒状物代表的是金纳米棒, 流程2中, 长方体代表制备载体微片, 在流程3, Y代表量子点标记的抗原。 在流程1中, 主要是拉曼报告分子与金纳米棒[14]的孵化, 结合完成后, 在流程2中, 拉曼报告分子与金纳米棒的结合物与处理过的微片进行反应, 在流程3接生物探针, 即不同种类的IgG, 经封闭液封闭后得到流程4中所需的液态生物芯片。
液相生物芯片的具体制备步骤如下:
(1) 取拉曼报告子40~60 mg, 加入4 mL左右的无水乙醇中, 超声10 min。
(2) 将制备好的金纳米棒以8 000 r· min-1的转速离心处理10 min, 完成后取出上清液。
(3) 把(1)和(2)中得到的物质混合, 在摇床上均匀搅拌2 h, 然后静置孵化12 h。
(4) 取出微片离心洗涤待用。
(5) 分别配制30 mL左右的PEI溶液和30 mL左右的PSS溶液。 具体做法是2 μ L左右的PEI或PSS加入10 mL浓度为29.25 mg· mL-1的生理盐水中。
(6) 将(4)中的微片依次加入PSS, PEI, PSS溶液进行电性修饰。 每次反应完成之后均用去离子水洗涤, 去除未反应溶液。
(7) 取(3)中孵化好的金纳米棒和拉曼报告分子, 离心洗掉过量的拉曼报告分子, 然后一次用PEI, PSS, PEI进行电性修饰。 反应之后离心洗涤。
(8) 将(6)和(7)步骤得到的经电性修饰后的微片和结合了金纳米棒的拉曼报告分子进行均匀混合, 搅拌12 h。 反应完成后, 洗掉多余的金纳米棒和拉曼报告分子。
(9) 将多巴胺分散在 Tris-HCl 缓冲溶液中(10 mmol· L-1, pH 8.5) , 浓度 2 mg· mL-1。 把上述微片分散在多巴胺溶液中, 室温下搅拌24 h进行表面修饰。 修饰好的微片用去离子水洗几遍后加到100 μ L的PBS缓冲溶液中, 室温下搅拌15 min。
(10) 将10 μ L的IgG溶液和50 μ L的EDC溶液加入到上述分散液中, 37 ℃下搅拌反应2 h后, 用PBS洗去多余未结合的IgG, 用BSA在4 ℃下过夜封闭[1]。
将上述制备好的液相生物芯片和相同量子点标记的抗IgG在37 ℃下结合反应1 h, PBS洗涤去除过量未结合的抗IgG, 得到待检测样品。
分别对单个拉曼报告分子编码的液相生物芯片和拉曼报告分子混合编码的液相生物芯片进行检测。 首先在荧光光路中检测到荧光图像, 如图3(a)和(b)所示, 图3(a)为单个拉曼报告分子编码的液相生物芯片的荧光图像, 图3(b)为混合编码的液相生物芯片的荧光图像。 通过计算不同微片的平均像素强度, 可以知道每一片微片的荧光强度, 根据荧光强弱, 确定微片上结合荧光标记蛋白的多少。 即荧光强度越强, 微片上结合的抗抗IgG越多。 利用这种原理, 完成了对每一个微片的定量分析, 如图4所示。
 | 图4 单个拉曼报告分子编码的荧光强度图Fig.4 Fluorescence intensity image of single kind of Raman reporter molecules encoded micro quartz pieces |
分别为图3(a)中微片进行编号, 得到了图4(a)中编号为1— 19的微片。 对19个微片分别进行定量分析, 得到图4(b)中的像素强度直方图。 通过图4(b), 可以确切得到每个微片的荧光强度。
最后对图3(a)中微片进行拉曼光谱检测, 得到图5。
通过对图4(a)中每一个微片进行拉曼光谱检测, 根据不同物质的拉曼特征峰不同, 分别得到六种物质的解码拉曼光亲如图5所示。 图5(a), (b), (c), (d), (e), (f)分别为4-氨基苯硫酚, 4-氯苯硫酚, 4-羟基苯硫酚, 对甲苯硫酚, 二萘硫酚, 2-硝基苯甲酸。 其中图4(a)编号为1, 4, 5的微片经拉曼光谱检测对应图5中的4-氨基苯硫酚。 图4(a)编号为2, 6的微片的拉曼光谱对应图5中的4-氯苯硫酚。 图4(a)编号为3, 12, 14, 16的微片的拉曼光谱为图5中4-羟基苯硫酚。 图4(a)编号为7, 19的微片对应拉曼散射光谱为图5中的对甲苯硫酚, 图4(a)编号为8, 11, 18的微片经拉曼系统检测对应图5中的二萘硫酚。 微片编号为9, 10, 13, 17的拉曼光谱为图5中2-硝基苯甲酸。
为了增加编码数量, 尝试对两种拉曼报告分子进行混合编码, 和处理单个拉曼报告分子编码的液相生物芯片方式一样, 先对图3(b)中的微片进行1— 12编号, 并进行荧光强度的检测, 如图6所示, 最后对图6(a)中的微片进行拉曼光谱检测, 得到图7。 图7(a)和(b)分别为2-硝基苯甲酸与4-羟基苯硫酚混合物的液相生物芯片的拉曼光谱和4-氯苯硫酚与4-羟基苯硫酚混合的液相生物芯片的拉曼光谱, 可以清楚的观察到混合液相生物芯片的拉曼峰可以完全展示出单个编码的液相生物芯片的拉曼峰, 这就证明了拉曼报告分子的混合编码的可行性。 在图6(a)中编号为1, 9, 11, 12的微片经拉曼光谱检测, 光谱对应的图7(a)。 在图6(a)中编号为2, 3, 4, 5, 6, 7, 8, 10的微片拉曼光谱检测光谱对应图7(b)。
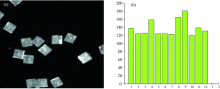 | 图6 混合拉曼报告分子编码荧光强度图Fig.6 Fluorescence intensity image of multiple kind of Raman reporter molecules encoded micro quartz pieces |
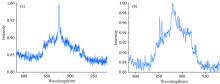 | 图7 拉曼报告分子混合编码的液相生物芯片拉曼光谱检测图Fig.7 Raman spectra of Suspension Array based on mixed Raman encoded reporter molecules |
根据公式:
其中N为拉曼编码总数, n为单个拉曼编码的个数, 已知n=6, 编码总数N=63。 也就是说理论上可以有63种编码方式[15]。 拉曼报告分子混合编码大大的提高了拉曼编码的液相生物芯片的种类与数量, 对高通量的检测有着十分重要的意义。
基于液相生物芯片的光学编解码技术, 首先, 完成了拉曼光谱检测与荧光耦合系统的搭建, 并实现了以微片为载体的拉曼编码的液相生物芯片的制备与免疫反应, 通过实验检验, 实现对液相生物芯片的拉曼光谱检测定性分析与荧光强度检测的定量分析, 最后, 完成了拉曼报告分子的混合编码, 大大提高了编码的种类与数量。 本工作主要有以下几大创新点:
(1) 搭建拉曼光谱检测与荧光显微成像耦合系统, 可同时实现对拉曼编码的荧光液相生物芯片的定性与定量分析。
(2) 通过改进传统的层层自组装的方式来修饰液相生物芯片的载体, 使液相生物芯片制备的重复性更好。
(3) 基于微片载体的拉曼编码的荧光液相生物芯片, 为液相生物芯片种类的选择做出贡献。
本工作改进了液相生物芯片技术, 并填补了未有基于拉曼编码的液相生物芯片的检测系统这一空白, 对液相生物芯片检测技术的发展作出了一定的贡献。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|






