作者简介: 黄双根, 1979年生, 江西农业大学副教授 e-mail: shuang19792@163.com
西维因是一种广谱、 高效的氨基甲酸酯杀虫剂。 提出一个基于表面增强拉曼光谱进行定量和定性分析小白菜中西维因残留的方法。 密度泛函理论B3LYP/6-311G基组被用于计算西维因农药的理论拉曼光谱。 硫酸镁、 PSA、 石墨化炭黑和C18被用来去除叶绿素、 矿物质和维生素等物质的影响。 采用MSC, SNV和归一化三种方法对原始光谱进行预处理, 建立小白菜中西维因残留的偏最小二乘模型。 研究表明, 小白菜中西维因农药残留检测可以达到0.976 mg·L-1以下。 经MSC预处理后所建PLS模型预测性能最好, 当主成分数为9时所建模型的性能最好, Rc为0.977, RMSECV为2.09 mg·L-1, Rp为0.986 5, RMSEP为1.71 mg·L-1。 五个未知西维因农药浓度小白菜样本用来验证模型的准确度, 相对误差为1.98%~7.28%, 预测回收率为95.73%~107.28%, T值为0.397, 小于 t0.05, 4=2.776, 说明模型是准确可靠的。 SERS方法是一种有效的方法, 可以实现小白菜中西维因农药残留的快速可靠检测。
Carbaryl is a broad-spectrum and efficient carbamate pesticide. In this study, we proposed a surface-enhanced Raman scattering (SERS) approach for quantitative and qualitative analysis of carbaryl residues in pakchoi. Density functional theory(DFT) calculations with Gaussian 03 using B3LYP/6-311G basis sets were executed. The experimental vibrational spectrum and theoretical spectrum of carbaryl were contrasted for its assignments of Raman peaks. Magnesium sulfate, PSA, carbopack and C18 were used to remove the influences of fluorescent substances in pakchoi. The limit of detection can achieve the standard of 0.976 mg·L-1 for carbaryl pesticide residues in pakchoi. Primordial spectra were pretreated by three methods of MSC, SNV and Normalization, and then the spectra were used to construct the pesticide residues models by the method of Partial Least Squares (PLS). Based on the results of PLS, carbaryl residues extracted from pakchoi can be predicted by the MSC model with a lower root mean square error of prediction (RMSEP=1.71 mg·L-1) and higher correlation coefficient in the prediction set ( Rp=0.986 5) value. It shows that the model of MSC can accurately predict the carbaryl pesticide residues extracted from pakchoi. Five unknown carbaryl concentration pakchoi samples were prepared for prediction model precision, and the values of relative deviation were calculated to be between 1.98% and 7.28%, and the predicted recovery rates were calculated to be between 95.73% and 107.28%. The T value is 0.397, which is smaller than t0.05, 4=2.776. These demonstrate that there is not evident difference between the measured and predicted values. This study illustrates that SERS method serves as an efficient method for the detection of carbaryl pesticide residues extracted from pakchoi quickly and reliably.
西维因别名1-萘基-N-甲基氨基甲酸酯, C12H11NO2, 是一种广谱高效低毒杀虫剂[1], 有触杀、 胃毒和微弱的内吸作用, 会对人体免疫系统、 神经中枢造成危害, 可用于水果、 蔬菜等多种农作物。 为了确保无公害、 绿色蔬菜, 农业部利用液相色谱和液质联用[2, 3]、 气相色谱和质谱联用[4, 5]等方法制定了一系列农药残留标准, 如NY/T761— 2008, GB2763— 2014等, 这些色谱检测方法由于检测精度、 灵敏度高等特点已得到广泛应用, 但存在前处理复杂、 检测时间长、 成本高等缺点, 难以实现在线检测。 很有必要发展一些新颖的检测方法来弥补这些缺点。
Fleischmann[6, 7], VanDuyne和Creighton[8, 9]课题组研究发现吸附在金、 银溶胶上的吡啶分子产生了强烈的拉曼光谱, 且强烈程度取决于金、 银溶胶尺寸和激发波长, 比普通拉曼信号要强104~106倍, 被称为表面增强拉曼光谱(surface-enhanced Raman spectroscopy, SERS)效应。 SERS技术因其超高灵敏度已经应用于各种生物医学组织的体内和体外检测[10, 11]、 有毒有害污染物质的残留检测、 单分子检测[12], 对粮食、 蔬菜、 水果等食品中农药残留检测方面也取得了一定的进展, 例如乐果[13]、 甲胺磷[14], 毒死蜱[15]、 乙酰甲胺磷及其代谢物[16]、 三种农药(甲基谷硫磷、 亚胺硫磷和西维因)[17]、 混合农药[18]。 谢云飞[19]等利用柠檬酸钠还原硝酸银方法制备银纳米粒子, 对大白菜、 菠菜等6种蔬菜中的甲胺磷农药残留进行SERS检测。 结果表明, SERS方法能够定性定量检测蔬菜中甲胺磷农药残留。 Wijaya等[20]利用一个快速、 简单、 敏感的swab-SERS方法对苹果汁和苹果表面的啶虫脒农药残留进行了研究; 啶虫脒的特征峰634 cm-1作为校正峰, 被用来识别和检测啶虫脒水甲醇溶液、 啶虫脒苹果汁溶液和苹果表面的啶虫脒农药, 检测限分别可达到0.5 mg· L-1, 3 mg· L-1和 0.125 μ g· cm-2。 Kubackova[21]等使用金胶和银胶对艾氏剂、 狄氏剂、 林丹进行SERS检测。 Cu@Ag/β -AgVO3有很好的SERS性能, 被用来检测氨基甲酸酯杀虫剂(呋喃丹、 西维因、 叶蝉散和残杀威), 相比于银纳米粒子, Cu@Ag/β -AgVO3更适合作为SERS基底[22]。 Hou[23]等在鲜茶叶和苹果表面使用金纳米粒子SERS检测了四种农药(水胺硫磷、 甲拌磷、 吡虫啉和溴氰菊酯), 最低检测限分别为0.25, 0.25, 0.5和0.5 mg· kg-1。 SERS结合DFT计算方法被用来检测蔬菜中甲胺磷农药, 在pH值为13.46获得了最优SERS信号。 该方法在0.01~1 000 μ g· mL-1之间有很好的线性关系范围, 回收率在86.7%~96.6%之间, 相对标准偏差在1.2%~2.5%之间[24]。 综上所述, SERS有能力检测农产品中农药残留, 可以满足农产品中农药残留快速痕量检测的需要。 目前利用表面增强拉曼光谱结合化学计量学方法检测小白菜中西维因农药残留还没有报道。
以叶菜(小白菜)为载体, 西维因农药为研究对象, 采用SERS结合化学计量学方法对小白菜单一农药残留进行快速定量检测。 利用快速溶剂前处理方法提取小白菜中西维因农药残留, 采用硫酸镁、 N-丙基乙二胺、 石墨化炭黑和C18去除叶绿素、 矿物质和维生素等物质的影响, 利用便携式拉曼光谱仪和金纳米粒子采集小白菜中西维因农药残留的SERS光谱, 应用化学计量学中标准正态变量变换、 归一化、 多元散射校正等预处理方法对原始光谱进行预处理, 并采用PLS方法建立小白菜中西维因农药残留的预测模型。
便携式拉曼光谱仪(RamTracer-200-HS, 苏州欧普图斯光学纳米科技有限公司); 高精密电子天平(EST200-4, 沈阳天平仪器有限公司); 低速离心机(JW1024, 安徽嘉文仪器设备有限公司); 涡漩混合器(Vortex-Genie 2/2T, 上海凌初环保仪器有限公司); 气相色谱串联质谱仪(Agilent GC 700, 美国安捷伦科技有限公司)。
西维因购于上海阿拉丁试剂公司, 分析纯; 乙腈、 氯化钠、 PSA、 无水硫酸镁、 C18和石墨化炭黑购于国药集团化学试剂北京有限公司, 分析纯; 金纳米粒子(OTR202, 欧普图斯光学纳米科技有限公司); 小白菜(江西农业大学教学试验基地)。
1.3.1 样品制备
西维因标准溶液配制: 准确量取西维因农药标准品200 mg于200 mL容量瓶中, 用乙腈溶剂配制1 000 mg· L-1的农药标准溶液, 放置于4 ℃避光环境中存放。 再用乙腈将1 000 mg· L-1的农药储备溶液分别稀释为100, 50, 20, 15, 10, 5, 2, 1, 0.5和0.4 mg· L-1的系列标准工作液。
小白菜中西维因农药残留的模拟过程及提取: (1)称取洗净的50 g小白菜放置于保鲜膜中, 使用喷壶按比例喷洒浓度为100 mg· L-1的农药标准储备液。 配置87种不同浓度梯度的小白菜样本, 每种浓度复制2份, 编号1— 87。 晾干后, 分别放入搅拌机将样品加工成浆状, 备用。 (2)从制备的样本中分别称取10 g小白菜样本于50 mL离心管中, 依次加入10 mL乙腈、 5 g氯化钠和1 g无水乙酸钠, 摇匀后涡旋混合1 min, 然后以4 200 r· min-1的速度将此离心管离心5 min, 小白菜的上清液为绿色。 (3)取此上清液2 mL放入装有适量无水硫酸镁、 PSA、 石墨化炭黑和C18的15 mL离心管中, 然后再涡旋混合1 min, 主要去除小白菜中叶绿素、 矿物质和维生素等物质的影响, 然后以4 200 r· min-1的速度将此离心管离心5 min, 获得无色上清液, 使用便携式拉曼光谱仪检测样品的表面增强拉曼光谱。 (4)用0.22 μ m有机滤膜过滤步骤(3)获得的无色上清液, 取过滤液1 mL, 加入10 mL离心管, 氮吹。 (5)氮吹后, 在10 mL离心管中加入1 mL乙酸乙酯, 涡旋振荡获得农药的乙酸乙酯溶液。 (6)取步骤(5)的溶液100和900 μ L乙酸乙酯混合, 稀释10倍, 涡旋振荡, 过0.22 μ m有机滤膜, 放置于进样瓶, 使用气相质谱仪检测小白菜样本中西维因农药残留的真实值。
1.3.2 拉曼光谱数据采集
拉曼光谱检测参数如下: 激发波长为785 nm, 功率为200 mW, 积分时间为10 s, 分辨率为2 cm-1, 积分3次求平均, 扫描范围400~1 800 cm-1。 固体样品的采集: 将西维因农药固体标准品置于石英板上, 利用载玻片将其压平后使用仪器自带固体探头直接检测。 液体样品的采集: 向1.5 mL石英瓶中加入500 μ L OTR202, 20 μ L待测样品和100 μ L OTR103, 混合均匀后放入样品池中采集SERS光谱。
1.3.3 计算方法
密度泛函理论是基于量子力学和Born-Oppenheimer approximation的从头算方法中的一类解法, 是一种研究电子结构理论的量子化学方法, 是目前电子结构计算中的领先方法, 也是计算化学领域最常用的方法之一[25]。 西维因农药的分子构型用GaussView 3.07构造, 理论计算采用Gaussian 03量子化学程序包, 计算时采用DFT的B3LYP方法的B3LYP/6-31G(d, p)基组, C, O, H和N原子采用6-31G(d, p)基组。 农药频率计算的结果在Gauss View 3.07软件平台查看, 并用相应的修正因子进行修正。 6是对内层轨道的描述, 用6个高斯函数(GTO)contract一个slater函数(STO), 31是把价层轨道用两组STO描述, d是对非H原子做的极化函数, p是对H原子做的弥散函数。
1.3.4 气相色谱串联质谱试验条件
(1)色谱条件
色谱柱(HP-5MS, 5% Phenyl Methyl Silox, 30 m× 250 μ m × 0.25 μ m), 载气: 氦气, 纯度≥ 99.999%, 恒压64.4696 kPa; 柱流速为1.2 mL· min-1; 进样口温度: 250 ℃; 初始柱温为50 ℃, 保持2 min, 以50 ℃· min-1升至150 ℃, 以5 ℃· min-1升至200 ℃, 以16 ℃· min-1升至280 ℃; 升至300 ℃, 保持2 min; 进样方式: 不分流进样1 μ L。
(2)质谱条件
EI源; 接口温度: 230 ℃; 四极杆温度: 150 ℃; 传输线温度: 280 ℃; 溶剂延迟0 min; 碰撞气为高纯氮气, 纯度> 99.999%; 采集模式: 多反应监测模式(multi-reactions monitoring, MRM)。
1.3.5 数据处理
为了评估SERS方法的灵敏性, 以及叶菜样本的农药浓度与所采集SERS光谱的特征峰的峰强之间的关联, 采集一系列农药浓度叶菜样本的SERS光谱, 叶菜样本的SERS光谱中农药特征峰仍明显的最低浓度被认为是最低检测限[26]。 为了消除基线偏移、 随机噪声和背景的干扰, 采用标准正态变量变换(standard normal variate, SNV)、 归一化(normalization)、 多元散射校正(multiplicative scatter correction, MSC)三种预处理方法对原始光谱数据进行预处理, 利用PLS方法建立小白菜中农药残留的预测模型, 以交叉验证的均方根误差(root mean square error of cross validation, RMSECV)、 相关系数(correlation coefficient in the calibration set, Rc), RMSEP, Rp, 相对偏差分析(relative analysis deviation, RPD)等参数对模型进行综合评价。 利用模型的预测值除测量值获得模型的回收率, 将模型的预测值与测量值之差除测量值获得模型的相对误差值。 配对t检验用来验证模型的准确度。 所有数据分析基于Microsoft Excel 2003, MATAB R2010a, OriginPro 8和SPSS V17.0平台完成[27]。
图1(a)是实验测得的西维因粉末拉曼光谱, 图1(b) 是理论计算的西维因拉曼光谱。 由图可看出, 理论拉曼光谱和实验拉曼光谱, 在峰强度上有一定的差异, 但在出峰位置基本一致。 理论拉曼光谱中有些峰位在实验拉曼光谱没有出现, 这可能是因为理论计算是对孤立的气态单分子形态, 未考虑分子之间的相互作用, 而实际测量的是固体, 存在分子间作用力[28]。
对比与分析图1(a)和(b), 对西维因的拉曼光谱振动模式进行全面的指认, 如表1所示。 在西维因固体拉曼光谱中, 存在4个明显的拉曼振动峰, 分别位于728, 1 374, 1 436和1 578 cm-1处。 其中, 728 cm-1处的拉曼振动峰是由酰胺基21N-19C=20O的弯曲振动引起, 并伴有萘环的呼吸振动; 1 374 cm-1处的拉曼振动峰的峰强最强, 由萘环平面对称伸缩振动引起; 1 436 cm-1处的拉曼振动峰归属于萘环上C— H的面外弯曲振动; 1 578 cm-1处的拉曼振动峰归属于萘环上C=C伸缩振动, 这些结果与文献中西维因的谱峰归属是一致的[17]。 另外, 位于874, 1 014, 1 162和1 716 cm-1附近的振动峰归属于氨基甲酸酯类分子农药, 874 cm-1附近振动峰由酰胺基N— C=O伸缩振动产生, 1 014 cm-1附近拉曼峰由C— O伸缩振动引起, 并伴有平面内C— H形变振动, 1 162 cm-1处拉曼峰由C— O的反对称伸缩振动引起, 1 716 cm-1附近拉曼峰由C=O伸缩振动引起。
| 表1 西维因的理论计算和固体粉末实测SERS光谱及其归属 Table 1 Raman spectral peaks of DFT-calculated and measured SERS for carbaryl and its assignment |
图2a为浓度20 mg· L-1西维因标准溶液的SERS光谱, 图2b为浓度20 mg· L-1西维因标准溶液的普通拉曼光谱, 图2c为乙腈的SERS光谱图。 由图2b可看出, 西维因标准溶液的普通拉曼光谱图和乙腈溶液的普通拉曼光谱一致, 说明在西维因标准溶液的普通拉曼光谱中未出现西维因农药的拉曼特征峰。 背景信号c相对比较微弱, 且出峰位置和西维因的拉曼特征峰不一致。 图2a中, 704, 810, 1 153, 1 374和1 560 cm-1处强度较高, 1 374 cm-1处的拉曼振动峰的峰强最强, 由萘环在平面内对称伸缩振动引起[29], 1 560 cm-1处的拉曼振动峰归属于萘环上C=C伸缩振动[22], 这些特征峰可作为西维因农药的定性定量判别依据。
 | 图2 20 mg· L-1西维因溶液的拉曼光谱 a: SERS; b: 普通拉曼; c: 乙腈的SERS光谱Fig.2 Raman spectra of 20 mg· L-1 carbaryl a: SERS; b: Normal Raman; c: SERS of acetonitrile |
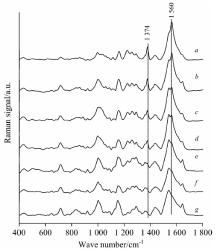
图3为不同浓度西维因标准溶液的SERS光谱。 由图3可看出, 随着西维因标准溶液浓度的增加, 其特征峰的强度不断增强, 但各特征峰的峰强度变化速度不同: 704, 810和1 213 cm-1处随浓度变化较快, 1 153和1 560 cm-1处随浓度变化较慢, 1 374 cm-1处变化最慢, 这可能是因为纳米增强粒子与西维因农药分子中各个基团表面吸附力的大小和方向不同导致的。 从图3中可看出, 随着西维因浓度的降低, 拉曼特征峰的强度逐渐减弱, 浓度为20, 10和5 mg· L-1时, 西维因的6处拉曼峰明显, 易识别; 浓度为0.5 mg· L-1时, 1 374和1 560 cm-1处峰强十分微弱, 但依然能识别, 其他的特征峰已不能识别。 由此表明, 利用SERS技术检测西维因标准溶液的浓度在0.5 mg· L-1以下。
受叶绿素、 维生素、 矿物质、 碳水化合物等物质的干扰, 小白菜中西维因农药残留的SERS光谱信号被削弱。 采用无水硫酸镁、 PSA、 石墨化炭黑和C18对小白菜提取液进行处理, 减弱小白菜提取液中叶绿素、 维生素、 矿物质、 碳水化合物等物质的干扰。 净化前和净化后小白菜中西维因农药残留的SERS光谱如图4所示, 从图中可看出, 净化后西维因的两个特征拉曼峰1 374和1 560 cm-1峰强显著增强, 有利于小白菜中西维因农药残留的SERS检测。
 | 图3 西维因标准溶液的SERS光谱 a— f: 20, 10, 5, 2, 1, 0.5 mg· L-1Fig.3 SERS spectra of carbaryl solutions a— f: 20, 10, 5, 2, 1, 0.5 mg· L-1 |
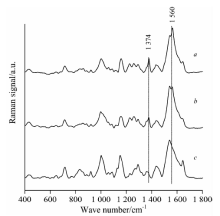 | 图4 小白菜中西维因农药残留的SERS光谱 a: 净化; b: 未净化; c: 空白小白菜基质Fig.4 SERS spectra of carbaryl in pakchoi a: Purification; b: Without purification; c: Blank |
图5为不同浓度的小白菜中西维因农药残留的SERS光谱。 图5a— c中, 1 374和1 560 cm-1处特征峰明显, 易识别; 浓度为2.032 mg· L-1时, 1 374和1 560 cm-1处的峰强度明显降低, 依然能识别; 浓度为0.976 mg· L-1时, 1 374 cm-1处特征峰依然存在, 能识别, 而1 560 cm-1处的拉曼特征峰峰强十分微弱, 已无法识别; 浓度为0.669 mg· L-1时, 其SERS光谱与小白菜空白提取液的SERS光谱基本一致, 未出现西维域农药的拉曼特征峰。 因此, 利用表面增强拉曼光谱方法检测小白菜中西维因农药的最低检测浓度在0.976 mg· L-1以下。 从图5中还可看出, 西维因溶液的拉曼特征峰强度随浓度的增大而增强。 因此, 可采用化学计量方法建立小白菜中西维因农药残留的预测模型, 对西维因农药进行定量分析。
利用GS-MS方法测量87个样本的真实值, 范围为0.976 0~43.322 0 mg· L-1。 根据87个样本的测量值, 采用2: 1的分配方案, 从每3个样品中选择2个作为校正集, 剩余的1个作为预测集, 所以校正集由58个样品组成, 预测集由29个样品组成, 如表2所示。
| 表2 小白菜中西维因农药残留的测量值 Table 2 The measured values of carbaryl pesticide residues extracted from pakchoi |
拉曼光谱采集时, 会受到随机噪声、 基线漂移、 电荷耦合器件(charge-coupled device, CCD) 热稳定噪声和外界杂散光等因素影响, 直接影响模型的可靠性和稳定性。 因此, 需要对原始光谱进行预处理, 增强特征信息, 提高模型的预测能力。 采用三种预处理方法(MSC, SNV和normalization)对原始光谱预处理, 预处理后的光谱用来建立农药残留的预测模型, Rc, RMSECV, Rp和RMSEP被用来评估预测模型的性能。 表3为原始光谱经不同预处理方法后所建PLS预测模型的结果。
| 表3 不同预处理方法小白菜中西维因农药残留的PLS模型的结果 Table 3 The PLS models results of carbaryl in pakchoi by different preprocessing methods |
 | 图6 MSC模型的校正集(a)和预测集(b)中预测值与测量值的散点图Fig.6 The scatter diagram of measured and predicted values in calibration set (a) and prediction set (b) by MSC model |
由表3可知, 经三种预处理方法后所建模型的预测结果均优于原始光谱, 原始光谱MSC预处理后, 当主成分数为9时所建PLS模型的性能最好。 模型的Rc为0.977, RMSECV为2.09 mg· L-1, Rp为0.986 5, RMSEP为1.71 mg· L-1, 较高的Rc和较低的RMSECV说明采用SERS技术结合PLS方法预测小白菜中西维因农药残留是可行的。 图6为经MSC预处理所建PLS模型校正集和预测集中预测值与测量值的散点图。
2.6.1 相对误差和回收率
按照1.3.1节所述的前处理方法, 对五个未知西维因农药浓度小白菜样本进行处理。 用GC-MS方法测定五个未知浓度农药小白菜样本的真实值。 对五个未知西维因农药浓度小白菜样本分别采集SERS信号, 用所建立的预测模型对5个未知浓度农药小白菜样本进行预测, 将真实值与预测值的进行比较, 结果见表4。 由表4可知, 本方法的预测结果与GC-MS方法结果基本一致, 真实值与预测值相对误差为1.98%~7.28%, 回收率为95.73%~107.28%, 表明利用SERS方法快速检测小白菜中西维因农药残留是可行的。
| 表4 小白菜中西维因农药残留的预测值和测量值 Table 4 The predicted and measured values of carbaryl pesticide residues extracted from pakchoi |
2.6.2 配对t检验
表5为5个未知小白菜样本西维因农药残留的真实值与预测值的配对t检验结果。 t=0.397, 其绝对值小于t0.05, 4=2.776, 表明真实值与预测值之间无明显差异, 利用SERS方法快速检测小白菜中西维因农药残留的预测结果是准确可靠的。
| 表5 测量值与预测值配对t检验结果 Table 5 t-test results between measured values and prediction values |
利用快速溶剂前处理方法对小白菜中西维因农药残留进行提取。 研究结果表明SERS技术能够实现小白菜中西维因农药残留的快速检测。 整个试验包括样品前处理、 光谱采集、 光谱分析和定量预测等过程可在15 min内完成, 远低于传统的色谱检测方法所需要的时间。 小白菜中西维因农药的残留检测浓度能够达到0.976 mg· L-1以下。 采用标准正态变换、 多元散射校正和归一化对小白菜西维因提取液的原始拉曼光谱进行预处理, 结果表明, 经MSC预处理后所建PLS模型预测性能最好, 当主成分数为9时所建模型的性能最好, Rc为0.977, RMSECV为2.09 mg· L-1, Rp为0.986 5, RMSEP为1.71 mg· L-1。 研究结果表明SERS技术能够实现小白菜中西维因农药残留的快速定量检测, 为食品中其他农药的残留快速检测提供了一个可行方案。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|