作者简介: 万文博, 1983年生, 西安工业大学光电工程学院讲师, 博士后研究人员 e-mail: 155216513@qq.com
激光诱导植物荧光寿命测量法是在植物荧光光谱分析法基础上开发的一种评估植物生长状况及环境监测的新技术。 根据植物叶绿素荧光信号的物理特性, 利用信息仿真技术开发了一种叶绿素荧光寿命校正方法, 可提高植物叶绿素荧光寿命的测量精度。 利用激光诱导叶绿素荧光寿命测量系统分别测得叶绿素荧光及其背景信号, 先用解卷积法叶绿素荧光信号中分离出荧光衰减函数, 可获取荧光寿命估计值。 再结合叶绿素荧光寿命校正技术就能反演得到高精度的植物荧光寿命。 仿真与实验结果表明: 该方法可实现高精度的植物荧光寿命实时监测; 并对不同含量的叶绿素提取液进行了测试, 构建了植物荧光寿命与叶绿素含量的对应关系模型。 未来该技术可用于遥感监测海洋、 湖泊、 河流中藻类植物的生物含量。
Laser-induced chlorophyll fluorescence lifetime measurement is a novel technique for evaluating plant growth status and environmental monitoring. This method is developed on the basis of plant fluorescence spectrum analysis technique. According to the physical properties of chlorophyll fluorescence signal and information simulation technology, a laser-induced chlorophyll fluorescence lifetime correction technique for improving the chlorophyll fluorescence lifetime measurement accuracy is presented in this paper. Laser-induced plant fluorescence lifetime measurement system was used to collect the chlorophyll fluorescence and its background signal. Then, the chlorophyll fluorescence decay function can be separated from the plant fluorescence signal in deconvolution algorithm, and fluorescence lifetime estimation can be obtained. Finally, the chlorophyll fluorescence lifetime correction technique was used to retrieve the precision values of fluorescence lifetime. The results of simulation and experiment show that real-time monitoring of high-precision chlorophyll fluorescence lifetime can be achieved in this method. Based on this, a large number of different concentrations chlorophyll solution were measured, and the relationship model of chlorophyll content and the fluorescence lifetime was built. In the future, this method can be used for remote sensing to monitor the algae biomass in the ocean, lake or river.
随着人类工业水平的不断提高, 绿色植物遭到严重破坏, 如果能够利用现代遥感技术实现对植物生理信息的实时监测, 那么就可构建全球植物病变预警系统, 以改善人类生存环境。 植物光合作用的速率能够通过CO2吸收、 放氧及荧光三个方面来表达[1, 2, 3, 4, 5]。 理论上, 就可根据植物荧光的发射速率评估植物的生长状况。 通过测量植物荧光来获取植物生理信息的技术已成为当前世界农业与环境遥感领域的一个热点。 美国国家航空航天局与日本温室气体探测卫星光谱小组合作在2011年已经公布了一幅地球植物荧光光谱图, 展示了地球陆生植物的荧光光谱的分布状况。 近期欧洲空间局的植物荧光探索(fluorescence explorer, FLEX)计划也已经初显成效, 计划在下一研究阶段发射植物荧光监测卫星[6]。
荧光测量技术中, 一般通过测量物质产生的荧光强度或荧光寿命值对被测物质的成分进行分析。 荧光寿命反映的是荧光光子的衰减时间, 不易受环境光、 探测器摆放位置等外界因素的干扰, 因此植物荧光寿命监测具备更好的测量稳定性[7, 8, 9, 10]。 而激光具有强度高、 传播速度快等优点, 利用激光作光源可实现远距离、 大范围植被生理状况的遥感探测。 以植物光合作用理论为基础, 构建激光诱导植物荧光寿命与植物生理信息的关系模型。 最终可实现通过测量植物荧光寿命, 再利用植物生理状况与荧光寿命的关系模型分析植物的生理状况的目标。 植物叶绿素含量是反映植物生理状况的重要指标, 根据植物多样性原则, 不同植物叶绿素荧光寿命与含量对应关系存在一定差异。 在实际遥感探测中大多数情况探测器获取的荧光光子来自不同植物, 因此这里选择研究植物荧光寿命与混合植物叶绿素含量之间的关系。
荧光寿命的测量难度大, 常用的测量方法都存在明显缺陷[11, 12, 13, 14]。 这里采用的激光诱导植物荧光寿命测量技术是生物光学领域研究信号变化过程的最新技术, 可直观地反映植物叶绿素荧光信号的衰减情况[15, 16]。 但是由于叶绿素荧光信号的物理特性, 造成在利用解卷积法处理叶绿素荧光数据过程中, 会产生很大的迭代累积误差, 而传统的校正技术在校正迭代累计误差过程用到的荧光衰减因子本身是经验值, 存在一定误差, 这就造成最终不能够得到的高精度的结果。 根据叶绿素荧光信号的特性, 结合信息仿真技术, 提出了一种新型叶绿素荧光寿命校正方法, 不但能够有效抑制解卷积过程中迭代累积误差, 而且能够校正荧光衰减因子不精确造成的反演误差, 从而获取高精度的叶绿素荧光寿命值。 经大量实验证明: 这种荧光寿命反演算法可快速、 精确地反演植物荧光寿命。 该技术可应用于荧光激光雷达, 以提高其信息处理速率及测量精度, 推进了星载植物荧光激光雷达系统进行全球植物生理信息实时监测的研究进程, 并且也为植物荧光雷达及其他植物荧光的光谱分析技术提供了新的解决方案, 具有重要研究意义。
用激光脉冲照射植物, 激发其产生荧光。 探测器实际接收到的植物荧光信号为激光脉冲信号、 被测荧光衰减函数与探测器时间响应函数的卷积[17, 18, 19, 20], 如式(1)所示
其中: p(t)为激光脉冲信号, g(t)表示植物荧光衰减函数, irf(t)表示光电探测器的时间响应函数, m(t)则为光电探测器获取到的植物荧光信号。 蒸馏水或石英玻璃等不产生荧光的物质的荧光衰减函数g(t)值恒为1[21], 当用这些物质作测试材料时, 光电探测器接收到的反射激光脉冲信号表示探测系统响应函数
如将探测系统响应函数srf(t)代入式(1)可得
因此, 只要在测量荧光信号前获取srf(t), 再用m(t)对其解卷积就能得到g(t)。 根据式(4)即可反演植物的荧光寿命。
这里A为初始荧光强度, τ 表示荧光寿命。
解卷积算法是反演荧光寿命的关键技术。 向前迭代卷积法是目前反演叶绿素荧光寿命效果相对较好的一种算法[22, 23], 但依然存在误差。 为提高精度, 可根据植物荧光的特性, 对反演荧光寿命过程中的误差进行精确校正。
1.2.1 向前迭代卷积法的改进
首先将式(3)转化成离散形式, 再根据离散卷积定理就能推导出荧光衰减函数的反演公式
根据式(5)可求得荧光衰减函数g(n)。
在反演叶绿素荧光寿命过程中, 由于系统响应函数的初始值srf(0)极小, 依照式(5)每次计算g(n)值时, 都要除以srf(0)。 除以一个极小数就相当于乘以一个极大数, 所以每次除法运算的截断误差将被不断放大, 这样荧光衰减函数g(n)的累计误差会越来越大, 所以运用该法反演得到的荧光寿命误差会很大。 每次计算所得g(n)的误差可表示为
其中, δ n(n=0, 1, 2, …, N)表示式(5)中m(n)除以srf(0)产生的截断误差, 这里N为正整数。 依次类推可将式(6)转化为式(7)形式
当g(n)小于g(n)的真实值时, σ n< 0; 而g(n)大于g(n)的真实值时, σ n> 0。
尽管每次除法运算的截断误差δ n极小, 但每次计算g(n)时, 前一次的截断误差都会累积到本次运算中, 且都要再除以极小值srf(0)。 那么每次计算g(n)时上次累计的截断误差将被放大很多倍。 另外, 系统响应函数srf(t)实际记录的是激光脉冲信号, 而m(t)记录的是激光诱导荧光信号。 激光脉冲信号的初始值srf(0)是极其微弱的激光信号, 无法激发物质产生荧光。 而实际激光诱导荧光信号的初始值m(0)并不是激光脉冲的初始信号激发的, 而是激光脉冲初始信号后边较强的激光信号激发出的。 因此, 理论上系统响应函数初始值srf(0)趋于0; 而激光诱导荧光信号函数的初始值m(0)应该是一个略大于0的值。 实际中很难从探测仪器记录的数据中筛选出真实的srf(0)和m(0)。 通常的办法是在被测信号初始值附近选择最接近0的正值作为信号初始值, 实际中m(0)≈ srf(0)。 由于荧光衰减函数的初始值g(0)=m(0)/srf(0), 而srf(0)的实际值总大于0, 所以实际反演的g(0)就也会偏小, 从而σ 0< 0。 那么随σ n不断被放大g(n)值相对其真实值的负偏移量将越来越大。 因此, 被实际反演得到的荧光寿命值将严重偏小。
为解决向前迭代卷积法反演的叶绿素荧光寿命存在误差这一难题, 提出了荧光衰减因子ε (0< ε < 1) 这一概念。 假定m(t)的数据长度为M, srf(t)的数据长度为N, 则g(t)的长度L应为M-N+1。 实际叶绿素荧光寿命反演过程中, 提取g(t)的前(M-N+1)ε 个数据, 设为gE(t)。 再利用三次Hermite插值方法沿横坐标方向对gE(t)放大1/ε 倍, 可得到gE(t/ε )。 再由gE(t/ε )反演被测叶绿素的荧光寿命。 荧光衰减因子ε 被定义为
式中: tsrf与tm分别表示srf(t)与m(t)有效数据的长度。 tsrf被定义为从srfmax下降到srfmax/10的数据长度, 这里srfmax表示srf(t)的最大值; tm被定义为从mmax/e到mmax上升时间的数据长度与mmax到mmax/e下降时间的数据长度之和, 这里mmax为m(t)的最大值, e取2.72。 这里定义的有效数据长度是经验值, 并不精确, 所以须引入修正系数α (0< α < 1)对有效数据长度进行修正, α 值的确定是荧光寿命修正技术的关键。 由gE(t/ε )可知, 荧光寿命与荧光衰减因子ε 成反比; 再由式(8)可知, 荧光寿命与有效衰减时间的修正系数α 成正比。
1.2.2 荧光衰减因子的确定
荧光衰减因子ε 的确定是荧光寿命校正技术中的关键步骤。 通过仿真得到某一荧光寿命值为τ 的激光诱导荧光信号模型, 用改进后的向前迭代解卷积法处理这个仿真信号, 反演结果为τ e。 再通过对比τ e与τ , 对α 不断调整, 最终可获得一个与τ 值很接近的τ e。 此时对应的荧光修正系数α 为最优化的荧光修正系数。 详细步骤如下所示:
(1)构建荧光寿命为τ 的理想荧光衰减函数模型h(t)为
将理想荧光衰减函数h(t)代入式(3), 即用h(t)替换式(3)中的g(t), 可构建相应的仿真激光诱导荧光信号模型m(t)
再用改进型向前迭代解卷积法(α 的初始值可在区间[0.1, 0.9]中取任意值), 使m(t)对srf(t)作解卷积处理。 即可得到荧光寿命为τ e的荧光衰减函数, 这里τ e为荧光寿命估计值。
(2)对比荧光寿命估计值τ e与荧光寿命理想值τ , 对荧光修正系数α 进行调整。 由于荧光寿命与修正系数α 成正比。 若τ e偏小, 应将修正系数α 调大; 若τ e偏大, 则应将修正系数α 调小; 若τ =τ e, 说明此时的修正系数α 恰好为被测荧光寿命值τ 对应的最优化修正系数。 经大量仿真, 获得了范围4~12 ns、 间隔时间为0.25 ns的荧光寿命与其对应的最优化修正系数α , 如图1所示, 并拟合τ ~α 的关系曲线。 这样就可通过该曲线获取任意荧光寿命相对应的最优化修正系数α 。
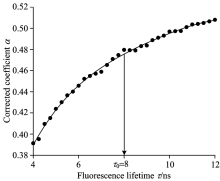 | 图1 荧光寿命与其最优化修正系数的对应关系(4~12 ns)Fig.1 Relationship between fluorescence lifetime and its optimal correction coefficient (4~12 ns) |
(3)将最优化修正系数α 代入式(8), 就可得到最优化的荧光衰减因子。 在运用改进后的向前迭代解卷积法处理激光诱导叶绿素荧光信号时, 选取的α 值越接近被测荧光寿命所对应的最优化修正系数, 反演结果的精度就越高。
1.2.3 荧光寿命的校正
尽管可通过τ ~α 的关系曲线获取任意荧光寿命对应的最优化修正系数, 但不可能提前预测被测荧光寿命来获取其最优化修正系数α 。 早期研究中, 凭经验估计α 值, 具有一定实用价值, 但要实现荧光寿命的高精度测量这种方法显然不可靠[24, 25, 26]。 因此, 提出了一种荧光寿命校正方法, 其程序流程图如图2所示。
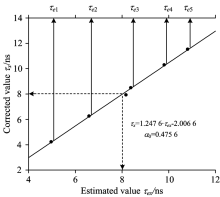
首先, 选取任意荧光寿命τ 0与其对应的最优化修正系数α 0作参考点。 第二步, 选取大量不同的荧光寿命值τ x, 并利用式(10)构建它们对应的仿真激光诱导荧光信号mx(t)。 再用改进型后的前迭代解卷积法(α =α 0)使mx(t)对srf(t)作解卷积处理, 从而可得到一系列的荧光寿命估计值τ ex, 这一步如程序流程图第三步所示。 由于荧光修正系数α 0不能表示任意荧光寿命值对应的最优化修正系数, 所以反演得到的各仿真激光诱导荧光信号的荧光寿命τ ex仅为估计值。 这样通过大量仿真计算就可绘制τ ex~τ x平面。 图3表示以τ 0=8 ns与α 0=0.475 6为参考点时绘制的τ ex~τ x平面。 图中拟合的直线被称为荧光寿命校正曲线, 表示荧光寿命估计值与校正值的对应关系。 其线性方程为
其线性相关系数为0.99。
在实际荧光信号处理过程中, 通过改进后的迭代解卷积法(α =α 0)对实际的激光诱导叶绿素荧光信号处理, 获得叶绿素荧光寿命的估计值τ e, 再将τ e代入式(11)的变量τ ex, 最终可得到精准的荧光寿命值τ x。 这一过程如图2程序流程最后三步所示。 存在一种特殊情况, 当被测荧光寿命恰好等于τ 0=8 ns(其最优化校正系数α 0=0.475 6)时, τ ex=τ x=8如图3所示。
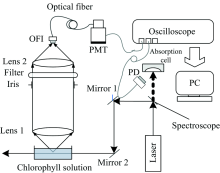
图4是激光诱导植物荧光寿命测量系统的原理图。 采用输出波长355 nm的Nd:YAG激光器作光源。 先利用高反分光镜剔除掉夹杂在光源中的基频光与二倍频光后, 再用两块反射镜分别对355 nm的激光光束进行反射, 使其入射盛放植物叶绿素溶液的石英比色皿, 溶液中的叶绿素分子受激发向四周发射荧光, 这些荧光透过凸透镜1后被转化为一束平行光, 经中心波长680 nm的窄带滤光片滤光, 可提取其中680 nm波长的荧光, 再由凸透镜2将这些荧光汇聚到光纤接口(optical fiber interface, OFI)。 由光纤将接收到的荧光传递给光电倍增管(photomultiplier, PMT), 荧光信号在PMT中经光电转换后, 示波器就能采集到叶绿素荧光信号m(t); 同时在355 nm高反分光镜后放置一个激光吸收盒吸收高反分光镜分离出去的基频光与二倍频光, 激光吸收盒在吸收这部分激光时, 会向四周散射出微弱的激光, 在激光吸收盒附近放置一个光电二极管(photo-diode, PD) 来接收这部分激光散射光, 以触发数字示波器启动采集荧光信号。
用不会产生荧光的石英比色皿盛满蒸馏水, 并将窄带滤光片更换为光学衰减片以防激光损伤PMT的感光器件。 激光脉冲照射蒸馏水后, 向四周发射的激光散射光被光学衰减片衰减后聚焦到光纤接口, 再由光纤将激光散射光传递给PMT, 激光散射光在PMT中经光电转换, 示波器就能采集到激光散射光信号, 此时示波器采集到的信号就为系统响应函数srf(t)。 将示波器采集到的荧光信号与探测系统响应分别转存到计算机并进行处理, 即可反演植物叶绿素溶液的荧光寿命。
为证实改进后的迭代解卷积算法的正确性, 用Matlab (7.4.0)计算软件对5组不同荧光寿命的仿真激光诱导荧光信号进行处理。 通过式(12)构建荧光寿命τ i(i=1, 2, 3, 4, 5)分别为4.35, 6.23, 8.63, 10.35和11.62 ns的理想荧光衰减函数。
设初始荧光强度值A为1。 再根据这5个理想荧光衰减函数, 分别绘制对应的衰减曲线, 如图5所示。
根据式(10), 将这5个理想荧光衰减函数hi(t)分别与系统响应函数srf(t)作卷积运算, 就能构建相应的仿真激光诱导荧光信号mi(t)。 这5个仿真激光诱导荧光信号与系统响应函数的波形如图6所示。
 | 图6 仿真激光诱导荧光信号与系统响应的信号波形Fig.6 Signal wave form of laser-induced fluorescence by simulation and the systemic response |
如图1所示, 当τ 0=8 ns时, 修正系数α 的真实值与拟合值的偏差最大, 分别为0.479 6与0.475 6。 选择这个位置(τ 0=8 ns, α 0=0.475 6)作参考点修正荧光寿命估计值τ ex, 若误差可满足测量需要, 那么以τ ~α 曲线上的任意点作参考点修正荧光寿命估计值, 都可满足测量要求。 以τ 0=8 ns与α 0=0.475 6为参考点, 做τ ex~τ x平面并绘制荧光寿命校正曲线, 如图7所示。
采用改进型向前迭代解卷积法(α 0=0.475 6)使5个仿真激光诱导荧光信号mi(t)分别对系统响应函数srf(t)做解卷积处理, 即可得到mi(t)相对应的荧光衰减函数gei(t), 根据gei(t)绘制它们对应的衰减曲线, 如图8所示。
由式(4)分别计算这5个荧光衰减函数的荧光寿命估计值τ ei。 图7为以τ 0=8 ns与α 0=0.475 6为参考点时绘制的τ ex~τ x平面。 将荧光寿命估计值τ ei分别代入图7中所示的校正曲线方程中的自变量τ ex, 即可得到相应的荧光寿命校正值τ x, 分别为4.36, 6.35, 8.73, 10.35与11.60 ns, 它们分别与初设的理想荧光寿命很接近, 平均相对误差小于1%。
根据上述方法, 进行了大量仿真运算, 对改进后的前迭代解卷积算法的误差进行了详细分析, 分析结果如表1所示。 表1中的仿真次数指在相应荧光寿命范围内随机选取的仿真样本个数, 且各随机样本的荧光寿命皆不相同。 实际中, 若在τ ~α 关系曲线上选取与实际修正系数α 偏差较小的点作为参考点, 那么测量误差会更小。
| 表1 荧光寿命测量方法仿真计算的误差分析(4~12 ns) Table 1 Error analysis for the simulation of fluorescence lifetime measurement method (4~12 ns) |
选取生长状态良好的法国梧桐、 银杏、 墨叶碧玉、 金钱草及冬青叶片, 分别裁剪出10 cm2, 再将这些叶片组剪成2 mm宽的条状, 将这些叶片放入80 mL用80%的丙酮与95%的乙醇以体积比2:1配制成的混合溶液里。 约24 h后植物组织变白时, 就可得到这几种植物的混合叶绿素提取液。 用紫光LED灯照射提取液, 激发其产生叶绿素荧光, 再用光谱仪获取其光谱, 如图9所示。 叶绿素提取液在约680 nm波长处的荧光最强, 因此在设计激光诱导植物荧光寿命测量系统时, 选择使用中心波长680 nm的滤光片。
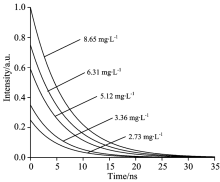
分别配制2.73, 3.36, 5.12, 6.31和8.65 mg· L-1的叶绿素溶液进行测试。 在用图4所示的示波器采集的数据取30次平均值。 用示波器采集各溶液的荧光信号m(t)及系统响应函数srf(t)的波形如图10所示。 对采集到的信号去噪后, 再用m(t)对srf(t)解卷积就能得到叶绿素的荧光衰减曲线, 如图11所示。
 | 图10 不同浓度叶绿素溶液的荧光信号波形(30次平均值)Fig.10 Measured fluorescence signal curves in different concentrations of chlorophyll solution |
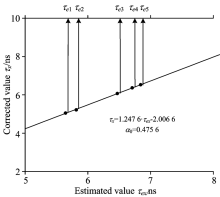
根据式(4)计算出各荧光衰减函数对应的荧光寿命τ ej, 分别为5.70, 5.88, 6.51, 6.79与6.88 ns。 由于在使用改进后的前迭代解卷积算法进行荧光寿命反演时, 选定的荧光修正系数α 0=0.475 6并不是任意被测荧光寿命对应的最优化修正系数, 所以τ ej仅为估计值, 还须对其进行校正。 以τ 0=8 ns, α 0=0.475 6为基准, 作τ ex~τ x平面图, 并且拟合荧光寿命校准曲线如图12所示。
这里的5种不同浓度溶液的荧光寿命估计值τ ej与其校正值的关系如图12中校正曲线上的5个圆点所示, 圆点的横坐标分别表示这5种浓度溶液荧光寿命的估计值τ ej。 将这5个估计值τ ej分别代入图12中荧光寿命校正曲线方程式的变量τ ex, 即可计算出它们相应的荧光寿命的校正值τ x。 这5种浓度叶绿素溶液的荧光寿命测量结果如表2所示。 经大量实验证明: 叶绿素溶液的浓度与其荧光寿命值成正比例关系, 由此可见, 植物叶绿素含量与其荧光寿命具有相关性。
| 表2 不同浓度叶绿素溶液荧光寿命的测量结果 Table 2 Measured results of chlorophyll solution fluorescence lifetime in different concentrations |
为获取叶绿素含量的标定曲线, 配制一组叶绿素浓度分别相差~0.25 mg· L-1的溶液。 用如图4所示的激光诱导叶绿素荧光寿命测量系统分别获取各溶液的激光诱导叶绿素荧光信号, 再分别运用改进后的向前迭代解卷积法反演各溶液的叶绿素荧光寿命, 就可拟合出表示叶绿素荧光寿命与叶绿素含量关系的标定曲线, 其线性相关系数r=0.965 4, 如图13所示。 如果运用这种方法进行大量类似工作, 就能得到高精度的叶绿素含量标定曲线, 从而实现高精度的叶绿素含量分析。 即通过测量未知溶液的叶绿素荧光寿命, 再由标定曲线展示的叶绿素含量与荧光寿命之间的关系来评估被测溶液的叶绿素含量。
通过构建激光诱导叶绿素荧光寿命测量系统, 运用叶绿素荧光寿命校正技术成功反演了不同叶绿素含量溶液的荧光寿命。 仿真与实验结果表明, 该方法不但测量精度高、 速度快而且具有远距离测量植物荧光寿命的优势, 可实现植物荧光寿命的遥感监测, 这种技术不但能够连续监测湖泊、 河流等水样的叶绿素含量, 而且具有遥感监测活体植物生理状况的前景。 这些特性表明激光诱导荧光寿命校正技术在农业与环境遥感监测领域应用潜力巨大, 植物荧光寿命即将成为评估植物生理信息的一项新指标。 下一研究阶段将应用该方法对海洋、 湖泊、 河流的叶绿素荧光寿命进行实时监测, 以研究浮游植物叶绿素荧光寿命随季节的变化情况。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|