作者简介: 赵德华, 1990年生, 河北科技大学环境科学与工程学院硕士研究生 e-mail: zhaodward@163.com
以蛋白核小球藻、 铜绿微囊藻、 斜生栅藻为敏感藻, 研究了莠去津、 敌稗、 敌草隆、 灭草松四种除草剂及其混合剂对藻类光合特性的影响规律, 实验同时确定了三种微藻荧光对除草剂的最佳响应时间。 实验结果表明, 除草剂显著降低了藻细胞类囊体膜中光系统Ⅱ的最大光合效率( Fv/Fm)、 实际光合效率(Y(Ⅱ))、 绝对电子传递速率(ETR)和光化学猝灭系数( qP), 而非光化学猝灭系数( qN)呈现上升趋势, 400 μg·L-1敌草隆使蛋白核小球藻 Fv/Fm参数值下降了41%。 实验选用的三种实验藻在四种除草剂单独和混合胁迫下均发生了不同程度的光抑制效应, 表现出光合效率、 电子传递速率、 光合活性的降低和光保护能力的增强, 藻类自身具有一定的光保护机制可以降低除草剂的影响。 除草剂能够影响藻细胞叶绿素荧光强度, 其中灭草松对蛋白核小球藻的影响最为显著, 在400 μg·L-1灭草松影响下蛋白核小球藻的叶绿素荧光强度下降了44%。
Chlorella pyrenoidosa, Microcystis aeruginosa and Scenedesmus obliqnus were selected as sensitive algae in this experiment. The effect of microalgae Phtosynthesis characteristic was studied after exposure of 4 kinds of herbicides (Atrazine, Diuron, Propanil and Bentazone) and its mixture. Meanwhile, the best response time of microalgae fluorescence to the herbicides was determined in this study. The results showed that 4 selected herbicides significantly reduced the algal cells in the thylakoid membrane of light system Ⅱ maximum photosynthetic efficiency ( Fv/Fm), the actual photosynthetic efficiency (Y(Ⅱ)), the absolute electron transport rate (ETR) and photochemical quenching coefficient ( qP), however, increased non-photochemical quenching coefficient ( qN) with the increasing herbicide dosages. The Chlorella pyrenoidosa at 400 μg·L-1 Diuron had the largest decrement of Fv/Fm(41%). Algae all displayed the effects of different degree on photoinhibition in conditions of 4 kinds of herbicides individual and mixing stressing, with the decrease of photosynthetic efficiency, electron transfer rate and photosynthetic activity, but increase of light protection ability. Algae itself had a certain light protection mechanism that could reduce the influence of herbicides stress. Herbicides affected the intensity of chlorophyll fluorescence, in which the effect of Bentazone on Chlorella pyrenoidosa was the most significant. The intensity of Chlorella pyrenoidosa chlorophyll fluorescence at 400 μg·L-1 Bentazone had the largest decrement (44%).
近年来化学除草剂的使用得到大面积推广, 除草剂在土壤和水中的残留和迁移现象已引起了环境污染问题, 给农业生产和人类生活环境带来了巨大的危害和隐患[1, 2]。 除草剂属于难降解有机物, 其环境问题在于其残留时间长、 降解缓慢; 而且大部分除草剂具有土壤淋溶性, 易被雨水、 灌溉水等淋溶至较深的土层而污染地下水; 同时也可随地表径流进入河流、 湖泊, 污染地表水[3, 4]。 除草剂对生态环境的危害十分巨大, 可在生物体内富集并影响其生长, 更为严重的是可损伤动物的肝脏、 肾脏等代谢器官[5]。 根据除草剂具有不同的作用机理和实际使用中的联合使用以及环境中多种除草剂共存等因素, 对除草剂混剂生物效应的研究显得尤为必要。 综上所述, 研究除草剂及其混剂的生物毒性对评估其对生态环境的影响具有重要意义。
常规的理化检测方法仅可以定量分析有毒污染物的含量, 而不能够反映出有毒污染物对环境的综合生物效应, 生物毒性检测作为一种预测和控制有毒污染物的重要手段, 它能直观、 全面的反映有毒污染物对生物种群的综合毒性, 综合不同有毒污染物间的相互作用, 可判定有毒污染物的浓度和生物效应之间的关系, 同时可对污染物的环境监测和综合评价提供理论依据[6]。
藻类作为食物链中的初级生产者通过光合作用为各级消费者提供有机物, 藻类的健康程度可直接反映出水生生态系统的受污染程度。 藻类中的微藻对污染物毒性响应敏感、 易连续培养、 保存稳定、 繁殖快且代谢旺盛, 是较理想的测试生物, EL-Sheekh等[7]发现, 水体中莠去津会影响小球藻体内脂肪酸和蛋白质的水平, 当莠去津的浓度达到15 μ mol· L-1时小球藻的总饱和脂肪酸受到完全抑制。
叶绿素荧光动力学参数被视为光合作用中揭示植物光合生理状况与环境胁迫关系的理想探针, 可在逆境条件下且不用破坏活体样本就可以灵敏的反映出光合作用的生理状态[8, 9, 10]。 叶绿素荧光动力学技术已经受到广泛应用, 与传统理化分析方法和色谱技术检测方法比较, 该技术最大优势在于仪器体积小, 操作简单, 检测快速, 分析周期短, 无复杂前处理过程, 供试藻易培养, 并且适用于野外现场连续在线监测[11, 12]。 国内有研究指出逆境条件可影响植物光合反应中的光能转化效率、 量子产量、 光合活性、 光保护能力、 电子传递速率等, 但研究内容多集中在光强变化、 温度变化、 氮磷浓度、 重金属浓度、 硅浓度等逆境胁迫上[5, 13, 14, 15, 16, 17, 18, 19], 而除草剂胁迫几乎为空白, 因此, 研究除草剂对微藻叶绿素荧光的影响显得非常必要。
本文采用叶绿素荧光参数作为主要指标研究了除草剂对微藻的影响规律, 以蛋白核小球藻、 斜生栅藻、 铜绿微囊藻微为实验藻, 研究莠去津、 敌草隆、 敌稗、 灭草松及其混剂胁迫下各微藻叶绿素荧光强度和叶绿素荧光参数的变化规律, 通过分析各项指标, 探讨除草剂对微藻光合生理的影响, 评价各检测指标的敏感性, 为使用微藻作为指示生物对除草剂的生物毒性检测提供理论基础。
主要仪器设备: 水样调制叶绿素荧光仪(WATER-PAM WALZ), 人工气候箱(RGX-250), 可见光分光光度计(722型)。
实验藻种: 蛋白核小球藻、 斜生栅藻、 铜绿微囊藻购于中国科学院武汉野生藻种库。
藻液培养基: BG11培养基(青岛海博公司)。
除草剂标准品: 莠去津(Atrazine)、 敌稗(Propanil)、 敌草隆(Durion)、 灭草松(Bentazon)标准品购自农业部环境保护科研检测所。 对应结构式如图1。
1.3.1 实验藻的培养
培养条件为将适量藻液接种到无菌的BG11培养基中, 进行预培养。 培养条件: 温度为(25± 10) ℃, 湿度为75% RH, 光照为2 000 lx, 时间设置为12 h(昼)/12 h(夜)。 藻种在培养中每日固定时间人工摇晃培养瓶3次, 并更换培养瓶在培养箱中的位置, 避免光照不充分。
1.3.2 三种藻生长对数期的确定
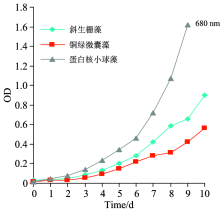
接种藻液后, 利用可见分光光度计每日固定时间取藻液进行光密度(OD)值的测量, 测量条件波长为680 nm, 连续10 d, 并进行绘制横坐标为时间纵坐标为光密度的微藻生长曲线, 确定微藻的生长对数期。
1.3.3 除草剂梯度浓度的设置
设置莠去津、 敌草隆、 敌稗、 灭草松浓度序列为: 0(对照组), 20, 40, 60, 80, 100, 150, 200, 400 μ g· L-1。
除草剂混剂实验设计为100 μ g· L-1莠去津的浓度与敌草隆、 敌稗、 灭草松的上述浓度设置用于胁迫微藻, 形成三种混剂, 即100 μ g· L-1莠去津与20~400 μ g· L-1敌草隆、 100 μ g· L-1莠去津与20~400 μ g· L-1敌稗、 100 μ g· L-1莠去津与20~400 μ g· L-1灭草松。
1.3.4 藻荧光对除草剂最佳响应时间的确定
利用叶绿素荧光动力学参数藻细胞类囊体膜中光系统Ⅱ 最大光合效率(Fv/Fm)在除草剂胁迫环境下随时间的变化来选择最佳响应时间, 取对数期藻液在100 μ g· L-1除草剂浓度环境胁迫下, 进行检测时间为第0, 10, 20, 30, 40, 50和60 min的叶绿素荧光动力学参数Fv/Fm的测试, 做出Fv/Fm随时间变化的趋势, 选择参数变化到最低点的时刻为最佳响应时间。
除草剂混剂最佳测试时间取两种除草剂最佳测试时间的平均值。
1.3.5 叶绿素荧光动力学参数测定
叶绿素荧光动力学参数利用水样调制叶绿素荧光仪测得。 用对数期微藻在最佳响应时间测定。 测定前藻液需在暗箱放置5~10 min, 每组实验做三组平行样。 测定的叶绿素荧光动力学各参数包括: 光系统Ⅱ 最大光合效率Fv/Fm, 实际光合效率Y(Ⅱ ), 光化学猝灭系数qP, 非光化学荧光猝灭系数qN, 光系统Ⅱ 绝对电子传递速率ETR。 各参数计算公式如下:
最大光合效率: Fv/Fm=(Fm-Fo)/Fm
实际光合效率: Y(Ⅱ ) =(Fm'-F)/Fm'
光化学猝灭系数: qP=1-(F-Fo')/(Fm'-Fo')
非光化学荧光猝灭系数: qN=1-(Fm'-Fo')/(Fm-Fo)
绝对电子传递速率: ETR=PARⅡ Y(Ⅱ )/Y(Ⅱ )max
式中Fo为最小荧光, Fm为最大荧光。
1.3.6 藻液叶绿素含量(叶绿素荧光强度)的测定
因为瞬间荧光数值(F)和叶绿素含量在一定范围内成正相关, 通过校正可利用水样叶绿素荧光仪测出叶绿素的含量。 为避免校正过程中产生的误差, 本实验的叶绿素含量用相对含量(实验测得的叶绿素含量与接种时的含量的比值)来进行表示[20]。
因为微藻在对数期内, 个体形态和生理特性较一致, 且具有代谢旺盛、 生长迅速、 代时稳定等特点, 所以选用对数期微藻为供试藻。
从图2可以看出, 蛋白核小球藻调整期为1~5 d, 对数期在第6 d开始, 铜绿微囊藻调整期为1~7 d, 对数期在第8 d开始, 斜生栅藻调整期为1~6 d, 对数期为第7 d开始。 可依据培养天数选取对数期微藻进行后续实验。
叶绿素荧光参数Fv/Fm代表光系统Ⅱ 的最大光能转化效率和最大量子产量, 此参数值在非环境胁迫下波动小, 当受到胁迫时其值显著降低[21], 因此可作为受胁迫程度的主要指标, 可利用Fv/Fm随除草剂作用时间的变化来判断最佳响应时刻。
从图3可以看出, 不同除草剂对三种微藻的Fv/Fm随时间变化的影响有明显不同, 可得出蛋白核小球藻对莠去津、 敌稗、 敌草隆、 灭草松四种除草剂的最佳反应时间分别为: 10, 10, 40和50 min。 铜绿微囊藻对应为: 40, 10, 20和20 min。 斜生栅藻对应为: 40, 60, 60和10 min, 可依据最佳测试时间进行后续实验, 除草剂混剂最佳反应时间取两种除草剂最佳反应时间的平均值, 即蛋白核小球藻对莠去津-敌稗、 莠去津-敌草隆、 莠去津-灭草松的最佳反应时间分别为: 10, 25和30 min。 铜绿微囊藻对应为: 25, 30和30 min。 斜生栅藻对应为: 50, 50和30 min。
2.3.1 除草剂对蛋白核小球藻叶绿素荧光参数的影响
图4所知, 四种除草剂胁迫后的叶绿素荧光动力学参数均受到影响。 微藻类囊体膜中光系统Ⅱ 中的最大光合效率、 实际光合效率、 绝对电子传递速率与光化学猝灭系数, 即光系统Ⅱ 光合活性, 均随除草剂浓度增加呈下降趋势。 敌草隆显著(p< 0.05)降低了Fv/Fm, Y(Ⅱ ), qP, ETR, Fv/Fm在最高浓度?胁萋⌒财认陆档?0%。 其余除草剂相比敌草隆对蛋白核小球藻影响较弱。 对于qN, 即微藻光系统Ⅱ 的光保护能力, 随敌稗、 敌草隆、 灭草松浓度的增加其值有升高的趋势, 均与对照组有显著性差异(p< 0.05), 莠去津组则随浓度的增加其值上升不明显。
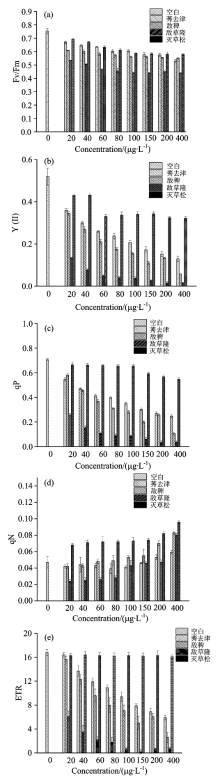 | 图4 四种除草剂对蛋白核小球藻叶绿素荧光参数的影响Fig.4 Four kinds of herbicides effect on Chlorella pyrenoidosa chlorophyll fluosescence parameters |
2.3.2 除草剂对铜绿微囊藻叶绿素荧光参数的影响
从图5可以看出, Y(Ⅱ ), qP, ETR随除草剂莠去津、 敌稗、 敌草隆浓度的升高而显著降低, 以敌草隆影响最明显。 四种除草剂在三种藻相比之下其对蛋白核小球藻Fv/Fm的影响较弱, 其中灭草松影响较为明显, 但随浓度变化的影响没有显著性差异, 说明铜绿微囊藻比蛋白核小球藻对除草剂的胁迫具有较强的耐受性。 qN随浓度增大有升高的趋势, 与对照组差异显著, 四种除草剂中以莠去津的影响最为显著(p< 0.05)。
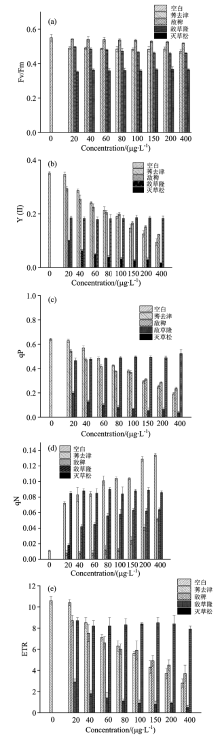 | 图5 四种除草剂对铜绿微囊藻叶绿素荧光参数的影响Fig.5 Four kinds of herbicides effect on Microcystis aeruginosa chlorophyll fluorescence parameters |
2.3.3 除草剂对斜生栅藻叶绿素荧光参数的影响
从图6可以看出, 除草剂莠去津、 敌稗、 敌草隆对Y(Ⅱ ), qP, ETR的影响较为显著, 随浓度的增大下降趋势越明显, 其高浓度显著或极显著地降低了Y(Ⅱ ), qP及ETR, 而灭草松的影响相对较小且不具有随浓度改变的变化趋势。 而四种除草剂对Fv/Fm的影响相比蛋白核小球藻仍然较弱, 下降趋势不明显, 说明斜生栅藻和蛋白核小球藻对除草剂的胁迫同样具有较强的耐受性。 qN则表现出有随莠去津、 灭草松浓度增大而升高的趋势, 与对照组差异显著, 除草剂中同样以莠去津的影响最为显著(p< 0.05), 敌稗、 敌草隆处理组则表现不明显, 可得出斜生栅藻对于不同除草剂的胁迫存在差异性。
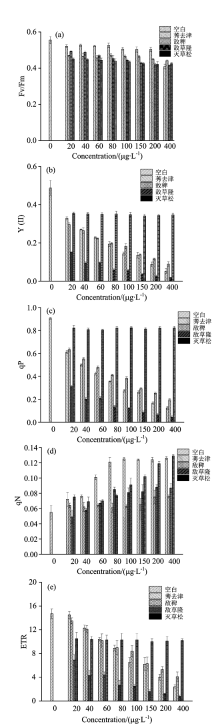 | 图6 四种除草剂对斜生栅藻叶绿素荧光参数的影响Fig.6 Four kinds of herbicides effect on Scenedesmus obliqnus chlorophyll fluorescence parameters |
2.3.4 混合除草剂对三种微藻叶绿素荧光参数Fv/Fm的影响
由于四种除草剂有不同作用机理, 为了进一步研究除草剂混合后是否有增效或拮抗作用效果, 故进行除草剂混剂实验。
从图7可以看出, 因Fv/Fm可准确反映受胁迫程度, 故仅用Fv/Fm参数作分析, 根据此参数实验组值与空白组值之间的差异, 莠去津分别与敌稗、 敌草隆、 灭草松的混合剂对三种藻最大光合效率的影响对比单种除草剂有不同程度的协同增效作用或拮抗作用。 表现为三种除草剂混剂对蛋白核小球藻最大光合效率有拮抗作用, 以莠去津灭草松混剂最为显著, 随着浓度的升高拮抗作用越明显, 高浓度组单剂和混剂参数值差异达到18%, 可分析为除草剂不同机理效果产生了对最大光合效率拮抗作用。 三种除草剂混剂对铜绿微囊藻最大光合效率有协同增效作用, 以莠去津敌稗混剂最为显著(p< 0.05), 最高浓度参数差异达到9%, 可分析为除草剂不同作用机理效果产生了协同效果。 斜生栅藻则对莠去津敌稗混剂表现出协同增效作用而对莠去津敌草隆混剂和莠去津灭草松混剂表现出拮抗作用。
叶绿素是一类参与光合作用的重要色素, 其含量可直接反映藻类的健康程度。 从图8可以看出, 经四种除草剂胁迫后的叶绿素荧光强度均有不同程度的降低, 且随除草剂浓度的上升有较明显的下降趋势。 灭草松显著降低了蛋白核小球藻和斜生栅藻的叶绿素荧光强度, 分别降低44%和37%, 说明两种藻类叶绿素对灭草松比较敏感。 四种除草剂对铜绿微囊藻的影响较小, 下降趋势较其他两种藻较弱。 方差分析可得, 高浓度实验组与对照组间均有显著性差异(p< 0.05), 且蛋白核小球藻受除草剂的影响最大其次为斜生栅藻, 说明3类藻种中, 蛋白核小球藻对除草剂的响应最为敏感。 此结果与除草剂对叶绿素荧光参数的影响结果基本一致, 进一步说明铜绿微囊藻更有较强的耐受性。
莠去津、 敌稗、 敌草隆、 灭草松同属于光合作用光系统Ⅱ 抑制剂, 分别对应属于三氮苯类、 酰胺类、 取代脲类和苯噻二嗪类, 四种除草剂有不同的作用机理[22]。
莠去津作用机理可简单描述为在光反应过程中其结合在质体醌的位置, 质体醌被阻止再与光系统Ⅱ 结合和进行传递电子, 而这些未传递的电子就会与细胞膜中的油脂类物质发生反应, 破坏细胞膜, 最终导致细胞死亡。 敌草隆作用机理是和光系统Ⅱ 中核心蛋白D1结合后, 改变了D1蛋白质的结构, 从而阻碍了HC
Fv/Fm光系统Ⅱ 的最大光合效率, 指光系统Ⅱ 的最大光能转化效率、 最大量子产量, Y(Ⅱ )光系统Ⅱ 的实际光合效率, 指光系统Ⅱ 的实际光能转化效率、 实际量子产量, qP光化学猝灭系数, 指光系统Ⅱ 吸收的能量用于进行光化学反应中电子传递的比例和开放态的光系统Ⅱ 反应中心所占的比例, 可以反映光合活性的高低, 光化学猝灭同时能够体现光系统Ⅱ 反应中心的开放水平。 qN非光化学荧光猝灭系数, 代表了光系统Ⅱ 吸收的能量用于耗散为热量的比例, 也就是植物耗散过剩光能为热量的能力, 即光保护能力, 当光系统Ⅱ 反应中心天线色素吸收了过量的能量时, 若不能迅速的耗散就会损坏光合结构更严重者会造成光合结构的失活, 所以非光化学猝灭可体现出的是一种植物的自我保护机制, 是对光合结构起一定的保护作用。 ETR指光系统Ⅱ 的绝对电子传递速率, 即经过光系统Ⅱ 的绝对线性电子流速率。 此五种参数为叶绿素荧光典型参数因此具有代表性, 可分别反映光合作用光系统Ⅱ 的各主要指标。 有学者指出Fv/Fm可作为在逆境胁迫环境下植物发生光合抑制现象的灵敏指标, 本实验结果表明, 三种藻的Fv/Fm随着除草剂浓度梯度的升高而有不同程度的降低, 说明在四种除草剂的胁迫下, 三种藻产生了光抑制或光系统Ⅱ 结构发生破坏。 Y(Ⅱ )随着除草剂浓度梯度的升高, 其值也呈现下降的趋势, 表明三种藻的光系统Ⅱ 的实际光能转化效率、 实际量子产量也在逐步降低。 qP随着除草剂浓度的升高同样有不同程度的降低, 表明光系统Ⅱ 中开放部分在减少, 光合电子传递链的电子传递受阻。 qN随除草剂浓度的升高而增大, 表明藻类的非化学能量耗散不断增加, 此现象利于耗散过剩的激发能, 从而保护光合结构, 使得藻类本身对除草剂的胁迫做出了一定的自我保护作用, 来增加对环境胁迫的适应性, 可反映出藻类对环境有一定的耐受性。 ETR除灭草松处理组外, 其余处理组均有随除草剂浓度的升高而显著降低, 表明除草剂抑制了藻类光合电子传递速率, 抑制了光合作用, 灭草松对光系统Ⅱ 电子传递速率影响较弱, 可能由于灭草松作用机理所导致。 荧光参数表现与除草剂机理一致, 从而证明了四种除草剂可降低光合活性和影响光合作用中的电子传递。 除草剂混剂对三种藻的影响不同结果可分析为不同藻类之间存在种间差异, 还可能为除草剂混合后改变了藻类的受胁迫环境, 增大或减少了除草剂药效, 从而表现出不同于除草剂单独胁迫结果。
藻类中的叶绿素具有吸收光能并将能量用于光合生理活动的功能, 叶绿素的含量在很大程度上可影响到藻类的光合作用效率。 有学者指出[23], 光抑制型除草剂可以显著降低叶绿素的含量, 本实验进一步验证了此结论, 四种除草剂处理后对三种藻类的叶绿素荧光强度均有不同程度的降低, 且随除草剂浓度越高下降趋势越明显, 同时表明灭草松对三种藻类叶绿素含量影响最为显著。 对于叶绿素含量指标, 四种除草剂对蛋白核小球藻和斜生栅藻影响较大, 同样表明蛋白核小球藻和斜生栅藻相对于铜绿微囊藻较敏感, 此结果与除草剂叶绿素荧光参数的影响结果基本一致, 进一步说明铜绿微囊藻对于除草剂的胁迫具有更强的耐受性。
莠去津、 敌稗、 敌草隆、 灭草松会导致藻类的光合作用中的光能转化效率、 最大量子产量、 实际光能转化效率、 实际量子产量、 光合活性和电子传递速率不同程度的下降, 以及光保护能力上升, 同时会影响到藻类叶绿素荧光强度的下降, 且均随除草剂浓度的升高影响越显著。 三种藻类对除草剂的胁迫具有一定的自我保护机制, 同时得出对除草剂的耐受性存在一定的差异性, 对于敏感程度依次为: 蛋白核小球藻、 斜生栅藻、 铜绿微囊藻。 然而, 蛋白核小球藻对除草剂混合剂的耐受性较强, 斜生栅藻次之, 铜绿微囊藻最弱。 因此, 可以根据对除草剂的敏感程度选取合适的最优敏感藻用于评价水生态系统除草剂的生物毒性, 同时也可以指导农业生产中除草剂混合剂使用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|