作者简介: 禹 强, 1992年生, 中国科学院重庆绿色智能技术研究院硕士研究生 e-mail: yuqiang215@mails.ucas.ac.cn
抗生素制药废水是污水处理中比较难处理的废水。 抗生素与微生物作用的机理研究对于解决抗生素废水处理问题具有重要意义。 拉曼光谱作为一种对样品无损, 非侵入型, 并且对水不敏感的检测手段, 已越来越多地用于生物、 医学的研究。 从普通污水处理反应器的活性污泥里通过涂布法和平板划线法分离得到了4株对头孢他啶具有抗性的菌株, 研究了其对头孢他啶的降解效果, 降解率最高达45.44%。 采用16S rRNA基因测序进行菌种鉴定, 得到这些菌种分别属于气单胞菌属, 芽孢杆菌属和红球菌属。 对筛选出的细菌进行不同条件下拉曼光谱测定, 探讨了细菌拉曼光谱的测试条件, 结果显示CaF2是测定生物样品拉曼光谱时效果最好的基底。 通过拉曼光谱技术和主成分分析法对菌种进行了差异分析, 提取了三个主成分, 累积荷载达到83.9%。 其中, 第一主成分主要包括 748, 1 003和1 126 cm-1等比较明显的峰位, 第二主成分包括1 661和1 448 cm-1, 第三主成分只有855 cm-1。 本研究利用拉曼光谱对活性污泥筛选的抗性菌株进行生物大分子的差异表征, 通过拉曼光谱对抗性菌种进行了较好的区分, 与基因测序的结果相吻合, 证明了拉曼光谱用于抗生素废水生物处理作用机理研究的可行性及优越性。
Antibiotic pharmaceutical wastewater is difficult to be treated in wastewater treatment field. The study of interaction mechanism between antibiotic and microorganism is of great significance for solving antibiotic wastewater treatment problem. As Raman spectroscopy offers a nondestructive, noninvasive, and water-insensitive test tool, it has been more and more widely applied in the study of biology and medicine. This work isolated 4 strains of antibiotic-resistant bacteria from activated sludge taken from sewage treatment reactor by using streak plate method and spread plate method, and the drug degradation effect of these strains is assessed, which shows the highest degradation rate reached 45.44%. Besides, sequence of these strains’ 16S rRNA gene was analyzed to ide.pngy them, and the result shows that these strains belong to Aeromonas sp., Bacillus sp. and Rhodococcus sp.. Raman spectroscopies of these stains under different conditions were taken to investigate the best test condition of bacteria’s Raman spectroscopy, and the result shows that CaF2 can be the best substrate. Then the Raman spectroscopies of these strains were obtained and the difference among them is analyzed by using principal component analysis, and three principal components were extracted, of which the accumulated load reached 83.9%. Among all the variables, 748, 1 003, 1 126 cm-1 belong to the first principal component, 1 661, 1 448 cm-1 belong to the second, and 855 cm-1 belongs to the third. This research characterized biological macromolecules of stains screened from activated sludge by Raman spectroscopy and well distinguished them, proving the reliability and superiority of Raman spectroscopy for applying to mechanism study of microorganism interaction in wastewater treatment.
随着抗生素的大量使用, 水环境中的抗生素含量逐渐升高[1], 抗生素废水的处理在污水处理领域也成为了一个亟待解决的问题。 为此很多研究工作都对抗生素废水生物处理影响因素进行了探究, Yang等[2]研究了污泥龄, 反应时间和温度对微生物降解抗生素的影响; Zhu等[3]研究了抗生素胁迫下, 生物膜反硝化、 硝化和碳氧化作用的差异, 并对微生物群落进行了分析; Muller等[4]研究了不同共代谢基质对微生物降解抗生素效果的影响, 这些研究都从宏观上对抗生素生物降解机制进行了一些探索, 但缺乏对微生物与抗生素相互作用的直接认识。 目前还没有比较好的、 直接的方法或手段对微生物与抗生素作用的微观机理进行研究。
拉曼光谱是一种物质分子的“ 指纹” 光谱[5], 能够对样品进行原位、 非侵入、 无标记的检测, 已经越来越多的应用于生物学、 医学研究[6-9]], 董蓉等利用拉曼光谱记录了强碱为诱导剂条件下芽孢生理变化过程, Carey等[10]利用拉曼光谱研究了在细菌内他唑巴坦对β -内酰胺酶的抑制作用, Cheng等[11]利用表面增强拉曼光谱对血液中分离的抗喹诺酮类药物大肠杆菌进行了检测, Jung等[12]通过拉曼光谱评价了绿脓杆菌生物膜的抗菌效果, 由此可见, 拉曼光谱在研究微生物体内物质变化过程[13, 14], 以及医学上病原菌的诊断[15, 16]都具有重要的应用, 但这些研究中大多都是针对特定已知物质或酶, 拉曼光谱的应用还有待进一步发展。 拉曼光谱用于废水生物处理的研究还比较少, 本研究筛选了常规活性污泥中具有抗生素抗性的菌种, 并对其拉曼光谱检测条件做了探究, 验证了拉曼光谱用于微生物作用微观机理研究的可行性, 并为更深入的机理研究奠定基础。
采用头孢他啶作为本研究所用的抗生素, 这是一种常用的第三代头孢菌素类抗生素, 作用于细菌细胞壁的合成过程[17]。 活性污泥取自实验室反应器, 将污泥悬浮液稀释100倍后接种至含有抗生素的液体LB培养基(蛋白胨10 g· L-1, 酵母粉5 g· L-1, NaCl 5 g· L-1)中, 添加头孢他啶的浓度为100 mg· L-1。 接种好的菌液在摇床中培养2 d, 培养转速为120 r· min-1, 温度为30 ℃。
从培养基中取菌液梯度稀释至10-6倍, 取200 μ L的稀释菌液均匀涂布于含有头孢他啶的固体LB培养基(液体LB培养基中按每100 mL加2 g琼脂粉配制而成), 头孢他啶的浓度也为100 mg· L-1。 在30 ℃下恒温培养24 h。 用接种环挑选形貌不同的菌落在新的培养基上进行划线分离, 并培养24 h。 重复划线培养2代, 以得到菌落单一的纯菌。 每次划线的培养基菌涂布100 mg· L-1的头孢他啶, 以达到持续筛选的目的。 所有的操作均在无菌超净台上进行。
(1)细菌培养。 配制固体无机盐培养基: Na2HPO4· 12H2O 3.8 g, KH2PO4 1 g, KCl 3 g, MgSO4· 7H2O 0.2 g, NH4NO3 1.15 g, Fe2(SO4)3· H2O 0.01 g, NaMoO4· 2H2O 0.01 g, MnSO4· H2O 0.01 g, 琼脂粉(每100 mL添加2 g), 在无机盐培养基表面均匀涂布100 mg· L-1的头孢他啶溶液。 将前述分离得到的纯菌接种至含有抗生素的无机盐培养基中, 进一步筛选出能在只含头孢他啶的无机培养基上生长的菌株。
将进一步筛选出的各细菌经过扩培后分别接种200 μ L至液体无机培养基中, 配方同前, 加入抗生素的初始浓度为250 mg· L-1, 置于摇床上, 以120 r· min-1摇动, 30 ℃培养48 h。 隔12 h取1.5 mL菌液于离心管中待用液相色谱分析头孢他啶含量。
(2)头孢他啶含量测定。 用液相色谱分析抗生素的残留量, 采用Agilent 1260 Infinity液相色谱仪, 流动相为磷酸缓冲溶液(磷酸氢二钠3.6 g, 磷酸二氢钾1.4 g, 加水溶解并稀释至1 000 mL)与甲醇(色谱纯)以4:1配制而成, 流速为1.0 mL· min-1; 检测波长254 nm。
采用Solarbio公司(北京)的头孢他啶(纯度98%)制备浓度分别为100, 200, 400, 500, 600, 800和1 000 mg· L-1的头孢他啶标准溶液, 测得各标准溶液的出峰面积, 拟合得到标准曲线。
将各时间点取的菌液在5 000 g离心力下离心10 min, 取上清液经0.22 μ m滤膜进行过滤。 操作均在无菌超净台上进行。 取过滤后的溶液0.5 mL至进样瓶中, 再用液相色谱进行分析, 通过峰面积插入标准曲线得到头孢他啶浓度。
利用16S rRNA鉴定法对筛选出的菌株进行鉴定。 操作流程主要包括细菌DNA基因组提取, 利用特异引物扩增16S rRNA序列, 并纯化扩增产物, 然后对产物进行DNA测序获得16S rRNA序列, 将获得的序列与数据库已知细菌的DNA序列比对, 即可得到菌株的属别。 上述实验均由上海美吉生物医药科技有限公司完成。
拉曼光谱仪采用的是Reinshaw公司生产inVia Reflex显微拉曼光谱仪。 使用532 nm半导体激光源, 光谱分辨率1 cm-1, 采用100× 物镜, 单点曝光时间为10 s, 激光功率为50 mW, 采集次数为1次, 扫描波数范围为700~1 800 cm-1。
(1)分别采用普通载玻片, 石英玻璃片, 氟化钙作为基底, 相同条件下测试样品的拉曼光谱。
(2)单个细菌样品和多菌体样品的拉曼光谱。 将筛选的细菌在液体LB培养基中培养24 h。 取1 mL菌液至1.5 mL离心管, 在5 000 g离心力下离心5 min。 去除上清液, 加入蒸馏水, 使细菌重新悬浮, 并振荡菌液洗去细菌表面培养基及其他杂质, 蒸馏水重复洗3次, 得到细菌的水溶液, 吸取50 μ L于石英片上, 尽量使液滴平铺, 使细菌分散, 将载玻片进行干燥(含水时会造成细菌的运动), 即得到单个细菌样品, 在拉曼光谱测试时, 选取分离较好的单个细菌进行测试。 多菌体样品即为多个同种细菌, 制备需经过同样的操作进行细菌的清洗, 重复清洗后, 在5 000 g离心力下离心5 min, 去除上清液得到分离的菌体, 吸取滴加至基底后, 直接将样品置于载物台上进行拉曼测试。
(3)不同菌种的拉曼光谱测定。 制作各菌种的多菌体样品, 采用石英片基底, 在相同的参数条件下测得拉曼光谱。 各菌株分别随机取3个点进行测定, 每个点重复测定3次。 对得到的光谱先进行平均光谱计算, 然后对光谱进行平滑降噪, 再对光谱的基线进行样条曲线拟合, 去除基线, 读取峰位及峰高。
(4)PCA主成分分析(principal component analysis)。 使用SPSS统计分析软件(IBM)对光谱数据进行PCA分析。 选取测得光谱中峰形较好, 且峰位稳定的峰, 读取峰高, 作为PCA分析的变量; 计算各变量相关系数, 继而对变量进行降维处理, 计算出主成分, 得出各变量在主成分上的荷载; 最终得到各光谱数据的主成分得分图。
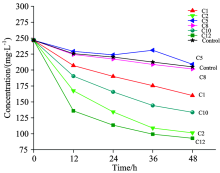
通过划线分离, 并通过含有头孢他啶的固体LB培养基筛选, 共得到14株纯菌株, 分别编号为C1— C14。 对这14株菌株进一步利用只含头孢他啶的固体无机盐培养基进行筛选, 有7株细菌长出了菌落, 分别为C1, C2, C5, C8, C10, C12。 将这7株菌株分别接种至抗生素浓度为250 mg· L-1的液体无机盐培养基中, 利用液相色谱分析出抗生素浓度随时间变化如图1所示。
根据抗生素浓度变化曲线, 空白对照组中的抗生素浓度下降, 说明头孢他啶本身在培养条件下会出现一定降解, 这与顾佳萍等[18]的报道一致。 菌株C5的培养液中在36 h时出现了上升, 显然是实验误差, 根据整个折线的趋势, 菌株C5, C8与空白对照组中抗生素浓度接近, 说明其对抗生素不具有降解作用, 而C1, C2, C10, C12对抗生素具有明显的降解作用, 扣除抗生素的自发降解, 四种菌株对抗生素的降解率分别为18.24%, 41.99%, 28.96%, 45.44%。
对C1, C2, C10, C12进行16S rRNA测序鉴定菌种, 鉴定结果C1, C2同为气单胞菌属(Aeromonas sp.), 革兰氏阴性菌; C10为芽孢杆菌属(Bacillus sp.), 革兰氏阳性菌; C12为红球菌属(Rhodococcus sp.), 革兰氏阳性菌。
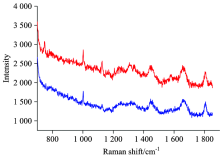
对普通玻璃、 石英、 氟化钙三种基底进行了比较, 在532 nm的激发光下, 进行测试, 分别得到相应的光谱, 如图2所示。 普通载玻片在900~1 200 cm-1处有很强的峰, 而蛋白质的峰位主要在这个区间[19], 峰高达到了5 000, 会严重影响蛋白质光谱信息的获取; 石英在750~850 cm-1处有明显的峰, 1 000~1 200 cm-1处有较小的峰, 前者的峰高达到了4 000, 一些核酸物质的特征峰在这个区间段, 但是对于900 cm-1以后的物质信息获取影响较小; CaF2在700~1 750 cm-1之间都有着良好的基线水准, 有一些小的峰峰高都在500以内。
用三种基底分别测定C1(气单胞菌属细菌属)的拉曼光谱, 普通玻璃载玻片背景非常强, 细菌本身的光谱信息基本被掩盖; 石英片在小于900 cm-1的波段信号受影响很大, 大于900 cm-1后的信号也受到了一定影响, 但能够显示出一些细菌本身的信息; CaF2作为基底测出的光谱背景较小, 显示出的细菌光谱信息丰富, 如图3所示。 相比而言, 普通玻璃的背景过强, 特别对于生物样品, 其拉曼信号比较弱, 背景干扰将更大, 信息损失很严重如图3(a)所示; 石英片也有一些背景峰, 但是比较靠前, 生物体的拉曼信号主要集中在600~1 800 cm-1之间, 因此信息的损失并不太严重, 如图3(b)所示; CaF2是三者中在600~1 800 cm-1范围内背景最小的, 基本是比较平直的一条线, 细菌本身的信号基本都能得以显现, 如图3(c)所示。 主要原因可能由于CaF2是一种难溶于水的离子晶体, 其离子键很强, 拉曼活性弱。 同时CaF2非常稳定, 不会对生物样品造成影响。 因此, 生物样品的拉曼测试, CaF2是一种比较理想的基底。
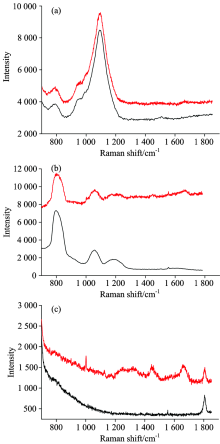 | 图3 (a)玻璃载玻片(b)石英片(c)CaF2作为基底时C1的拉曼光谱(上)及背景(下)Fig.3 Raman spectroscopy of C1 (up) and the background (down) when (a) Glass (b) Quartz (c)CaF2 to be substrate |
多菌体样品和单个细菌测出的拉曼光谱区别也有显著差异。 如图4所示, 多细菌样品的拉曼光谱与单个细菌的拉曼光谱相近, 但比单个细菌的拉曼光谱展现了更多的信息, 更多峰强比较小的峰显现了出来, 同时也具有更高的信噪比。 说明拉曼光谱虽然能测定极少量的物质, 但样品过少时, 背景影响较大; 反之, 样品量较多时可以减少背景对样品光谱的影响, 增加样品量有助于提高拉曼光谱测定的稳定性和准确度, 因此, 多菌体的拉曼光谱更能准确反映细菌内的物质信息。
对筛选出的抗性菌C1, C2, C10, C12进行拉曼测定, 同时以菌株C8作为对比, 将得到的原始拉曼光谱进行去基底, 平滑等处理后得到了如图5所示的拉曼光谱。 由于是多细菌测得的拉曼光谱, 反映了各菌种拉曼光谱的平均值, 从直观上, 各菌种的拉曼光谱基本波形类似, 都具有明显的几处峰: 748 cm-1(碱基T), 1 003 cm-1(苯丙氨酸), 1 126 cm-1(蛋白质、 葡萄糖C— C振动), 1 172 cm-1(蛋白质CH2变形振动), 1 308 cm-1(酰胺Ⅲ ), 1 338 cm-1(碱基A、 色氨酸), 1 585 cm-1(色氨酸)[20], 说明在细菌的拉曼光谱中, 蛋白质和核酸的拉曼信号是较强的, 为主要信息, 而脂质和糖类信号较少, 或者不如蛋白质和核酸信号强。
为了更深入地对各种类菌株的拉曼光谱进行深入的差异分析, 对各组数据进行了PCA分析, 每个菌株随机取3个不同的样本点进行测定, 每个点测定3次, 对每个点测得的光谱求出平均光谱, 共得到来自5个菌株的15个光谱数据。 分析过程采集了748, 782, 817, 855, 920, 972, 1 003, 1 127, 1 171, 1 308, 1 448, 1 585, 1 661 cm-1共13个峰形较好峰, 以备峰高作为变量, 共提取了3个主成分, 3个主成分的累积荷载平方和达到83.9%, 说明这个主成分分析有效地提取了各光谱的主要差异, 能较好的全面反映光谱特征。
如图6(a)所示, 在主成分1和主成分2分析图中, 各菌株的数据能够较好的分开, 除了C1和C10的得分数据点区域有交集, 其他的数据点都比较好的分离, 但图6(b)主成分1和主成分3的得分图中, C10的数据点和其他菌种的数据点很好的分开了, 说明在所采集的峰值数据中, 各菌株拉曼光谱是有明显差异的, PCA分析的效果比较好。 显然, 拉曼光谱显示出了很强的分辨能力, 通过物质的差异表征了不同菌种的差异。 与传统的生物分析, 菌种鉴别相比, 拉曼光谱测定大大减少了工作量和工作时间, 具有很大的应用优势和潜力, 随着拉曼光谱技术在生物领域更广泛的应用, 其准确性和分辨能力将会得到更大的改善。
 | 图6 各菌数据(a)主成分1和2(b)主成分1和3得分图Fig.6 (a) PC1 and PC2 , (b) PC1 and PC3 score plots of different strains |
根据PCA分析得到1 308, 748, 920, 1 127, 1 171, 1 003, 972, 1 585, 817, 782 cm-1在第一主成分上荷载较大, 主要是蛋白质主链C— C键, 碱基中PO2键的特征光谱, 而第二主成分荷载较大的则是1 661和1 448 cm-1两个峰值, 是酰胺Ⅰ 和糖类C— H2振动的特征峰[15], 855 cm-1处峰值在第三主分上荷载较大, 其代表的则是酪氨酸对羟基苯环振动。 在本实验条件下, 细菌光谱中蛋白质、 核酸的信息量比较大, 并且具有相似性, 主要成分比较类似, 糖类和脂质所反映的信息较少, 但是蛋白质与核酸的比例会有所不同, 这种差异不太容易直观的分析, 但能够通过统计分析方法表现出来; 各菌种更细致的差异则来源于蛋白质的侧链构象、 氨基酸的种类等, 如峰1 448和855 cm-1, 这些也包含在拉曼光谱的信息中。 能显示出生物体内更精细的物质结构, 这是拉曼光谱相对于其他测定物质成分方法的优势所在。 某些具有特殊拉曼信号的细菌则可通过特殊拉曼信号区分, 如芽孢杆菌中的吡啶二羧酸钙就是一种拉曼信号极强的物质, 凭此可以区分芽孢态的芽孢杆菌。 总的来说, 拉曼光谱对生物成分的测定不需要根据对象进行方法的选择, 无需针对性的测定, 得到的是所有物质成分的信息, 显然这是极具优势性的特点。
(1) 从活性污泥中筛选出了对头孢他啶具有抗性且具有降解能力的四个菌种, 鉴定其分别属于气单胞菌属、 芽孢杆菌属和红球菌属。
(2) 实验证明测定细菌拉曼光谱时, CaF2基底产生的背景较少, 基线比较平直, 是最为理想的基底材料。 相比单个细菌而言, 多菌体样本多, 得到的光谱信息更多, 信噪比也更高, 背景干扰也会更小。
(3) 各菌种拉曼光谱的PCA分析, 较好的区分了各个不同的菌种, 说明了拉曼光谱能够对物质, 生物大分子的差异进行表征, 也说明了拉曼光谱在研究微生物作用过程、 物质变化的巨大潜力, 这也将为抗生素制药废水生物处理的微观机理研究提供一种很好的工具。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|