作者简介: 黄林生, 1977年生, 安徽大学电子信息工程学院副教授 e-mail: linsheng0808@163.com
杀螟硫磷是一种在农作物上广泛使用的有机磷杀虫剂, 常用于玉米上害虫的防治。 过量或者不合理施用导致的残留积累关系到食品安全和人体健康。 常规检测杀螟硫磷的方法有气相色谱-质谱法、 高效液相色谱法, 其准确性虽好, 但存在需要专业人员介入、 样品前处理复杂、 检测时间长等缺点。 表面增强拉曼光谱(SERS)法具有分析速度快、 检测灵敏度高和特异性好等优点, 被广泛应用于农产品中痕量残留的快速检测。 利用表面增强拉曼光谱结合化学计量学方法实现玉米中杀螟硫磷残留的准确检测。 以两步种子生长法合成的纳米金棒作为拉曼增强基底, 测量600~1 800 cm-1范围内的拉曼光谱。 对比杀螟硫磷乙醇溶液和金棒的光谱, 确定杀螟硫磷的特征峰在650, 830, 1 082, 1 241, 1 344和1 581 cm-1处。 采用简单预处理方法快速提取玉米中的杀螟硫磷残留。 将受污染的玉米样品粉碎后, 利用乙醇溶剂对残留进行两次提取, 每次获取的提取液经离心获得上清液, 将上清液合并混匀, 在水浴中蒸发浓缩, 浓缩后的上清液用于采集SERS光谱。 每个浓度制备50个平行样本。 各浓度残留提取液中的残留参考值采用色质联用方法测定。 对比残留提取液的光谱, 1 082, 1 241和1 581 cm-1处特征峰强度随残留浓度的降低而迅速变弱甚至消失, 650, 830和1 344 cm-1处的特征峰直至残留浓度为0.48 μg·mL-1时依然可见。 当浓度低至0.37 μg·mL-1时, 所测光谱与空白提取液光谱相似。 采用主成分分析(PCA)提取不同浓度杀螟硫磷残留光谱的主体信息, 其中残留为0.37 μg·mL-1和空白提取液光谱的主成分得分重叠, 进而判断SERS方法对玉米中杀螟硫磷残留的检测限可达到0.48 μg·mL-1, 低于国家规定的农作物中最大残留限, 体现出SERS检测的高灵敏性。 选取浓度为14.25 μg·mL-1的50个样本分析其650, 830和1344 cm-1处的特征峰强度变化可知, 所采集的光谱呈现出较好的重复性, 相对标准偏差(RSD)值仅为3.12%。 对杀螟硫磷残留的定量分析采用支持向量机回归(SVR)实现, Savitzky-Golay卷积平滑和小波变换(WT)用于本次光谱数据的预处理。 校正集和预测集样本的划分采用Kennard-Stone算法实现, 模型的性能采用校正均方根误差(RMSEC)、 校正集决定系数($R^{2}_{c}$)、 预测均方根误差(RMSEP)和预测集决定系数($R^{2}_{p}$)评估。 最优模型为SVR结合WT所构建的, 具有最小的预测误差, 其中校正集的RMSEC=0.103 2 μg·mL-1, $R^{2}_{c}$ =0.999 74, 预测集的RMSEP=0.134 1 μg·mL-1, $R^{2}_{p}$=0.999 60。 同时, 最优模型的预测值与色质联用法所测值基本一致, 其预测回收率为95.31%~100.66%。 以上表明, SERS结合化学计量学方法检测玉米中杀螟硫磷残留是准确可行的, 且有望推广到农作物中多种农药残留的检测, 为农产品的安全检测提供一种新思路。
Fenitrothion, an organophosphate insecticide widely appeared in agricultural crop cultivation, is commonly used to prevent and control insect pests in maize. However, excessive or unreasonable application lead to the accumulation of pesticide residues in maize, which concern to agricultural products safety and human health. The routine methods for fenitrothion detection are chromatography-mass spectrometry and high performance liquid chromatography, which are both highly accurate. Nevertheless, the shortcoming of above methods is that they need well-trained personnel, complicated sample preparation, considerable detection time. Surface-enhanced Raman spectroscopy (SERS) has the advantages of rapid speed, high sensitivity, excellent specificity, and extensively applied for rapid detection of trace residues in agricultural products. In this paper, an accurate methodology for detection of fenitrothion residues in maize was developed using surface enhanced Raman spectroscopy and chemometric methods. The gold nanorods solution synthesized by the two-step seed-mediated growth method was used as Raman active substrate. And SERS spectra of 600 to 1 800 cm-1 were measured. Comparing SERS spectrum of ethanol solution with fenitrothion and gold nanorods, the characteristic peaks of fenitrothion were determined at 650, 830, 1 082, 1 241, 1 344 and 1 581 cm-1. A simple pretreatment method was developed for extraction of fenitrothion residues in maize. Maize contaminated with fenitrothion was grinded, and then ethanol solution was added to extract fenitrothion residues twice. Next, the two extraction were centrifuged and the supernatant were acquired, followed by mixed, concentrated and evaporated in water bath. The concentrated supernatant was used for SERS measurement. Fifty samples were prepared for each concentration of fenitrothion residues in maize. Reference value of residue in extraction solution was detected by gas chromatography-mass spectrometer. Through observing the spectrum of maize extraction with fenitrothion residues, the characteristic peak intensity of 1 082, 1 241 and 1 581 cm-1 were rapidly weakened or even disappeared as the fenitrothion residues decreased in different concentration residues extraction whereas the peak at 650, 830 and 1 344 cm-1 remained visible with fenitrothion of 0.48 μg·mL-1. Spectra of extraction with 0.37 μg·mL-1 fenitrothion residues were basically consistent with uncontaminated samples extraction. Principal component analysis (PCA) was adopted to extract the main information of spectra of fenitrothion residues. The principal component scores for spectra of 0.37 μg·mL-1 fenitrothion residues and uncontaminated samples were overlapped in scatter plot while others were distributed in different positions. It can be further determined from the scatter plot that the detection limit of fenitrothion in maize could reach 0.48 μg·mL-1, which is lower than the maximum residue limit of China in crops, suggests SERS is of high sensitivity. The intensity variation of characteristic peak of 650, 830 and 1 344 cm-1 in 50 samples with a concentration of 14.25 μg·mL-1 fenitrothion residues were analyzed, and the collected spectra showed a good repeatability while the relative standard deviation (RSD) was only 3.12%. Support vector machine regression (SVR) was employed for quantitative analysis of fenitrothion residue. Additionally, Savitzky-Golay convolution smoothing and wavelet transform (WT)were used for the pretreatment of spectral data. The calibration and prediction set of samples were divided by Kennard-Stone algorithm. Quantitative evaluation of model performance was based on root mean square error of correction (RMSEC), coefficient of determination of correction ($R^{2}_{c}$), root mean square error of prediction (RMSEP) and coefficient of determination of prediction ($R^{2}_{p}$). Optimal regression model, which has minimal prediction error, was developed by SVR and WT. The correction set of RMSEC and $R^{2}_{c}$ were 0.103 2 μg·mL-1 and 0.999 74 while the prediction set of RMSEP and $R^{2}_{p}$ were 0.134 1 μg·mL-1 and 0.999 60 respectively. Furthermore, the predicted value of optimal model was basically in consonance with GC-MS, and predicted recovery of fenitrothion residues in maize was 95.31%~100.66%. Results demonstrates that SERS combined with chemometric method is feasible to detect fenitrothion residues in maize. This method is expected to be generalized to detect varieties of pesticide residues in other crops, providing a novel approach for the safety detection of agricultural products.
杀螟硫磷具有较好的触杀与胃毒作用, 可防治半翅目、 鞘翅目等害虫, 常用于玉米、 水稻、 大豆及蔬菜上的害虫防治。 过量与不合理的施用会引起杀螟硫磷在作物上的残留积累。 这些残留对人体、 牲畜具有毒害作用, 易引起神经系统中的胆碱积累, 具体表现为恶心、 呕吐、 腹痛、 腹泻、 昏迷等, 急性中毒还可危及生命。 对农作物中残留的准确检测是避免其损害的重要技术方法[1]。 目前, 常规的杀螟硫磷检测方法有气相色谱-质谱法(gas chromatography-mass spectrometer, GC-MS)[2]、 高效液相色谱法(high performance liquid chromatography, HP-LC)[3], 这些方法准确性虽好, 但存在需大型仪器与专业人员介入、 试剂消耗大、 样品前处理复杂以及检测速度慢等缺点。 面对广泛存在的农药残留问题时, 上述方法显得捉襟见肘。 因此, 通过简单的样品前处理, 准确检测出杀螟硫磷残留对农产品安全和人体健康具有重要的意义。
光谱类方法是一种较为理想的快速检测方法, 包括近红外光谱[4]、 拉曼光谱以及表面增强拉曼光谱[5]等。 近红外光谱在水相环境中会受到明显的干扰, 不适用于作物中的有害物残留检测。 拉曼光谱不受水体影响且具有指纹效应, 其光谱的谱峰反映了被测物分子的化学键振动与转动信息, 在物质检测方面有着广泛应用。 但拉曼光谱受限于较小的拉曼散射截面, 信号强度较弱, 无法对农作物中的痕量残留提供准确的检测。 在粗糙贵金属纳米颗粒之间的局部等离子体共振增强和被测物分子与纳米粒子之间的吸附增强的共同作用下, 拉曼信号会获得极大的增强, 由此获得的光谱被称为表面增强拉曼光谱(surface-enhanced Raman spectroscopy, SERS)[5, 6]。 同时, SERS光谱还具有检测快速与特异性好等优点, 因此被广泛用于农产品中各种痕量残留的快速检测。 Giovannozzi等[7]以不同尺寸的金纳米颗粒为增强基底, 结合SERS技术快速检测液体牛奶中的三聚氰胺, 最低检测浓度达0.17 mg· L-1。 Yuan等[8]利用SERS技术, 以燕麦、 豌豆等农作物为研究对象检测谷物上的脱氧瓜萎镰菌醇, 检测最低浓度分别为10-4 mol· L-1和10-6 mol· L-1。 Mü ller[9]等利用SERS技术检测柑橘类水果和香蕉上的噻苯咪唑, 并结合密度泛函理论确定噻苯咪唑的特征峰, 检测限分别为78和2 mg· kg-1。 Huang等[10]采用SERS技术结合快速预处理方法, 实现了大米中的毒死蜱残留的快速检测, 最低检测浓度为0.506 mg· L-1。 杀螟硫磷作为作物上广泛使用的有机磷杀虫剂之一, 文献中未见过利用SERS检测作物上的杀螟硫磷残留, 本文将利用SERS检测玉米上的杀螟硫磷残留。
同时, 基于化学计量学方法的光谱智能分析可避免专业技术人员的介入, 进而实现真正意义上的快速检测。 常用于光谱分析的方法包括预处理方法和建模方法。 其中, 卷积平滑、 导数[11]以及小波变换[12]等方法可以有效扣除荧光背景, 减小基线漂移和随机噪声, 增强特征信息, 提高模型的预测能力, 常用于拉曼光谱的预处理。 多元线性回归(multiple linear regression, MLR)、 偏最小二乘回归(partial least squares regression, PLSR)和支持向量机回归[13](support vector machines regression, SVR)等为光谱建模分析中常见的回归模型, 具有较好的稳健性和预测能力。
本文旨在结合SERS光谱和化学计量学方法对玉米中杀螟硫磷残留进行准确检测。 首先, 建立一种快速简便的方法提取玉米中杀螟硫磷残留。 以均一的纳米金棒为增强基底, 采集残留的SERS光谱。 然后, 结合SVR与不同预处理方法对所采集的光谱进行建模, 实现了玉米中杀螟硫磷残留的量化分析。 希望通过本研究, 为农产品安全检测提供一种新思路。
杀螟硫磷乙醇溶液(1 g· L-1)购买于国家标准物质平台。 玉米样品购买于合肥周谷堆农贸市场。 无水乙醇、 溴化十六烷基三甲铵(CTAB)、 三水合四氯金酸、 柠檬酸三钠、 抗坏血酸、 硼氢化钠以及硝酸银购买自国药集团化学试剂有限公司(上海)。
污染样品获取: 将高浓度杀螟硫磷溶液用50%乙醇溶液稀释, 获得浓度为20, 15, 10, 8, 5, 2, 1, 0.5和0.4 mg· L-1杀螟硫磷溶液, 避光保存备用。 称取5 g玉米样品, 向其中添加不同浓度的杀螟硫磷溶液, 获得加标残留为20, 15, 10, 8, 5, 2, 1, 0.5和0.4 μ g· g-1污染样品。
杀螟硫磷残留提取: 将被污染的玉米样品粉碎, 置于15 mL离心管中, 加入10 mL 50%乙醇, 经超声均质器混匀后, 以4 000 r· min-1的速度离心10 min, 取上清液。 向残渣中再次加入10 mL 50%乙醇, 重复混匀、 离心获取上清液。 将两次上清液合并, 在60 ℃水浴中蒸发浓缩至5 mL, 浓缩后的上清液用于采集SERS光谱。 每个浓度制备50个样本。 提取液中杀螟硫磷残留的参考值采用气质联用仪(GC-MS)测定。 其中, GC-MS对加标残留为20, 15, 10, 8, 5, 2, 1, 0.5和0.4 μ g· g-1污染玉米样品提取液的检测均值为18.95, 14.25, 9.67, 7.76, 4.80, 1.96, 0.97, 0.48和0.37 μ g· mL-1。 气质联用仪为岛津GC-MS-QP2010SE, 检测结果由安徽大学现代实验技术中心提供。
SERS增强基底采用两步种子生长法合成的金纳米棒(GNRs), 具体合成方法参见文献[14]。 所获得的金纳米溶胶溶液经过离心浓缩后, 取2 μ L滴加在硅片上形成金膜作为增强基底。 将2 μ L被测溶液滴加在基底上, 待溶液蒸发后进行光谱采集。 SERS光谱测量使用便携式拉曼光谱仪(必达泰克i-Raman785 Plus, 美国)。 具体参数如下: 785 nm激发波长、 激光功率为200 mW、 拉曼位移分辨率为2.2 cm-1, 光谱采集范围为600~1 800 cm-1, 积分时间为6 000 ms, 积分1次。 随机选取样本点采集光谱, 取5条光谱的均值作为一条分析光谱, 每个样品采集2条分析光谱。
首先, 所获得的光谱使用多项式拟合算法去除光谱的基线, 漂移便于后续的分析处理。 主成分分析(principal component analysis, PCA)用于提取杀螟硫磷残留光谱的主体信息, 判别SERS技术对玉米中杀螟硫磷残留的检测限。 为了实现基于SERS光谱对残留的量化分析, 支持向量机回归(support vector machine regression, SVR)算法用于回归模型的建立。 在此之前, 光谱预处理算法Savitzky-Golay(S-G)卷积平滑, 小波变换(wavelet transform, WT)将被用于光谱的预处理, 减弱荧光背景和干扰噪声对分析模型的干扰。 校正数据集与测试数据集(4:1)采用Kennard-Stone(KS)算法选择。 以校正均方根误差(root mean square error of correction, RMSEC)、 校正集决定系数(coefficient of determinationof correction,
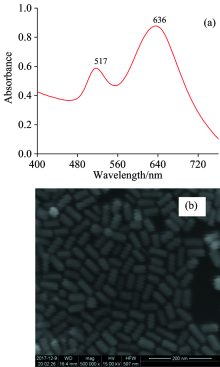
对金棒溶胶的形貌结构采用紫外可见吸收光谱图像与扫描电镜(SEM)图像进行表征。 如图1(a)所示, 金棒的两个表面等离子体共振吸收峰为517和636 nm。 517 nm为横向共振吸收峰, 636 nm为纵向共振吸收峰, 分别对应的是沿着金棒长轴和短轴的电子振动。 从图1(b)的SEM图像可以看出, 金棒的外貌形态基本一致, 具有良好的均一性。
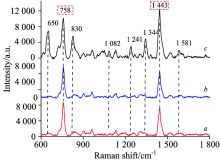
SERS光谱具有指纹特性是应用于物质检测与分析的基础, 其特征峰反映了被测物分子的化学键振动与转动信息。 为确定杀螟硫磷的特征峰, 实验分别测量杀螟硫磷乙醇溶液(20 mg· L-1)、 乙醇溶液和金棒的SERS光谱(图2)。 由图可知, 金棒的光谱在758和1 443 cm-1位置出现两个特征峰, 这是由金棒中残留的CTAB引起的, 且在20 mg· L-1杀螟硫磷溶液和乙醇溶液的光谱中依然明显, 也表明乙醇无SERS特征峰。 同时, 杀螟硫磷的特征峰分别出现在650, 830, 1 082, 1 241, 1 344和1 581 cm-1处。 根据杀螟硫磷分子结构与拉曼峰位归属可知[15], 在1 581 cm-1处的谱峰为苯环C=C伸缩振动, 在1 344和1 241 cm-1可归属为NO2对称和非对称伸缩振动, 1 082 cm-1处谱峰反映了苯环C— N伸缩振动, 830 cm-1为苯环-硝基剪式摇摆振动, 650 cm-1则为C— C弯曲振动。 因此, 在650, 830, 1 082, 1 241, 1 344和1 581 cm-1处的特征峰可作为SERS光谱检测杀螟硫磷的判别依据。
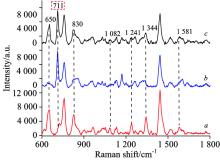
复杂体系中被测物分子的SERS光谱会受到体系中其他成份的干扰, 出现一些变化, 如光谱峰位的增加、 消失、 重叠以及减弱。 为确定玉米提取液中杀螟硫磷的SERS光谱特征, 实验对比了20 μ g· mL-1杀螟硫磷乙醇溶液、 空白提取液和含18.95 μ g· mL-1残留提取液的光谱(见图3)。 空白提取液和污染样品提取液均在711 cm-1出现新的特征峰, 这是由玉米中淀粉所导致, 但并未干扰到杀螟硫磷特征峰的出现。 污染样品提取液中杀螟硫磷在1 241和1 581 cm-1处的特征峰变弱却依然可见, 而在650, 830和1 344 cm-1处的特征峰依然明显。 实验结果表明SERS光谱可应用于玉米中杀螟硫磷残留的检测。
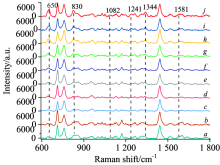
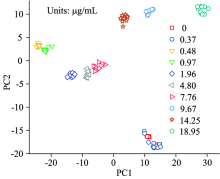
污染玉米样品经提取后, 测量了其对应提取液的光谱(如图4)。 由图可知, 在1 082, 1 241和1 581 cm-1处的特征峰强度随着提取液中残留浓度的减弱而迅速变弱直至消失, 而650, 830和1 344 cm-1处特征峰直至残留浓度为0.48 μ g· mL-1依然可以识别。 当残留浓度低至0.37 μ g· mL-1, 所得光谱与空白提取液光谱相似, 杀螟硫磷对应的特征峰未在光谱中出现。 为了进一步确定SERS技术对玉米中杀螟硫磷残留的检测限, 将所获得的光谱进行PCA处理, 所得的主成分得分见图5。 由图可知, 含0.37 μ g· mL-1残留提取液的光谱与空白提取液光谱的主成分得分重叠在一起, 而其他浓度对应的主成分得分分布在整个散点图的不同位置。 上述现象表明本次实验对玉米中杀螟硫磷残留的检测限可达到0.5 μ g· mL-1(提取液残留为0.48 μ g· mL-1), 低于国家规定的杀螟硫磷在农作物中的最大残留值(5 μ g· g-1)。
基于SERS光谱的定量分析, 光谱的重复性决定着量化分析的优劣。 图6展示了含14.25 μ g· mL-1杀螟硫磷残留的不同玉米样本提取液光谱在650, 830和1 344 cm-1处特征峰强度变化情况。 由50个不同样本获取的光谱特征峰呈现了较好的重复性, 相对标准偏差(relative standard deviation, RSD)仅为3.12%。
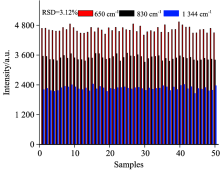 | 图6 含14.25 μ g· mL-1杀螟硫磷玉米提取液在650, 830, 1 344 cm-1处特征峰强度变化图Fig.6 Intensity variation of characteristic peaks of maize extraction with 14.25 μ g· mL-1 fenitrothion at 650, 830 and 1 344 cm-1 |
| 表1 不同回归模型对玉米中杀螟硫磷残留的分析结果 Table1 Predicted results of fennethine residues in maize using different regression models |
为了实现基于SERS对玉米中杀螟硫磷残留的定量分析, SVR用于构建回归模型。 由于所采集光谱除了被测物自身信息外, 还存在由外界杂散光和荧光背景所引起的干扰, S-G卷积平滑和WT用于减弱或者消除非目标因素对光谱的影响, 进而提高模型的稳定性和预测能力。 实验结果如表1所示, SVR所构建的模型对提取液中的杀螟硫磷残留具有较好的预测准确度(RMSEC=0.130 8 μ g· mL-1,
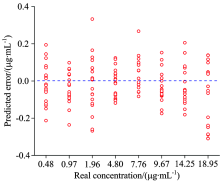 | 图7 最优SVM模型对不同浓度残留的预测误差Fig.7 Predicted error of optimal SVM model for residue at different concentrations |
| 表2 玉米中杀螟硫磷残留的预测回收率 Table 2 Predictedrecovery of fennethine residues in maize |
利用SERS技术结合化学计量学方法实现玉米中杀螟硫磷残留的准确检测。 采用一种简单预处理方法提取玉米中杀螟硫磷残留, 通过GC-MS检测结果可知, 其处理回收率高于92.5%。 不同浓度残留的提取液的光谱被测量, 对玉米中杀螟硫磷检测限可达0.5 μ g· g-1, 远低于国家规定的农作物最大残留限, 体现了该检测方法的高灵敏性。 杀螟硫磷残留的量化分析通过结合SVR, S-G卷积平滑和WT来实现, 最优模型的分析误差达到RMSEP=0.134 1 μ g· mL-1, 同时, 预测回收率为95.31%~100.66%。 由此可知, SERS结合化学计量学方法可以很好地实现玉米中杀螟硫磷残留的准确检测。 我们相信此方法可以进一步扩展到其他农作物中各种农药残留的定量分析中, 为农产品安全检测提供可靠的技术手段。
致谢: 感谢安徽大学现代实验技术中心所提供玉米提取液中杀螟硫磷残留检测。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|