作者简介: 苏同福, 1970年生, 河南农业大学化学系教师 e-mail: sutongfusua@126.com
为了解生物体内L-阿拉伯糖在代谢过程中的合成与降解机制, 采用太赫兹和拉曼光谱系统, 对其指纹区的振动进行检测。 结果表明, L-阿拉伯糖太赫兹图谱在频率49.5和72.2 cm-1分别检测出了振动吸收, 其中72.2 cm-1的振动为首次检出。 该振动频率与其折射率图谱反常色散的频率基本一致, 故这两个振动吸收可以作为L-阿拉伯糖的特征吸收。 最为重要的是, 在该频域内, 检测得到图谱的波型与三种异构体理论值简单叠加后波型极为相似, 故可以初步判定样品含有三种构象异构体(α-型、 β-型和l-型结构), 非单一组分, 而是混合组分; 对于拉曼图谱而言, 其特点简洁而明晰, 一般将指纹区的振动, 从高到低分为四个区域: 吡喃环结构的伸缩振动、 亚甲基的摇摆振动、 环上羟基的扭曲振动及环骨架扭曲和畸变振动。 同时也根据密度泛函理论B3LYP/6-311G**基组, 分别对L-阿拉伯糖的三种构象异构体的振动进行模拟计算, 利用势能分布对这些振动进行归属和指认。 与理论值相比, 振动频率检测值有不同程度的红移, 即振动频率向低频发生了偏移, 其原因是样品内不同分子间相互影响所致。
In order to further understand the synthesis and biodegradation mechanism of L-arabinose during the course of metabolism, terahertz time-domain spectroscopy and laser Raman spectrometer were used to measure the vibrations of their groups in this paper. The results shows that: in the frequency range of 5~85 cm-1 frequency range, The 49.5 and 72.2 cm-1 vibrational peaks were detected and the two vibrations were in agreement with the frequencies of anomalous dispersion in the curve of refraction index, the second peak was detected for the first time. Therefore, the two vibration peaks could be as characteristic absorption peaks of L-arabinose because of their strong absorption. To the most, the wave type of terahertz spectra in this range was very similar to the theoretical wave type of the simple combinations of the three isomers, and the sample was not a single component, but a mixture of three isomers. Raman spectra showed that vibrations of L-arabinose were concise and clear and that vibrations in fingerprint frequency ranges were divided into four characteristic vribrational regions(from high to low): stretching vibrations of bonds in pyran cycle, rocking of methylene, twisting of H—O in cycle and torsions and deformations of cycle skeleton, including puckering. The vibrations of α-, β- and open chain isomers were calculated by B3LYP/6-311G** according to DFT, respectively. The vibrations of the three isomer were assigned by potential energy distribution. Comparisons between observed and theoretical curves were that frequencies of theoretical curves showed red shift for vibrations of L-arabinose and the exact causes must be confirmed by further tests.
L-阿拉伯糖是一种五碳糖, 是组成糖链如半纤维素等的基本结构单元之一[1], 天然存在的阿拉伯糖以L型的为主, 也是食品中常见的甜味剂。 自1988年[2]提出糖生物学的概念以来, 糖的研究日益受到人们的关注, 糖类化学从有机化学领域的研究转向了有机化学与生物学相结合的领域。 对糖类的认识, 已经深入到免疫、 分子识别、 生长、 发育、 遗传等生物化学反应过程, 不再局限于糖类研究的传统领域。 近年来, 人们对L-阿拉伯糖进行了大量的研究[3, 4, 5, 6], 发现该物质具有抑制蔗糖代谢的功能, 应用于减肥、 控制糖尿病等临床过程。 美国、 日本等国家将阿拉伯糖列为抗肥胖剂、 营养补充剂或非处方药, 以及调节血糖的专用保健品添加剂。 2008年我国将L-阿拉伯糖列为可以在“ 各类食品, 但不包括婴幼儿食品” 中使用的食品资源, 同时还在医药和保健食品、 生物试验、 香精香料等领域有较为广泛的用途。 最近, 对阿拉伯糖的研究, 不再局限于L型, 对D-阿拉伯糖也进行深入的研究和探讨, 发现D-阿拉伯糖可以抑制或干扰D-核糖、 D-果糖的代谢, 被称之为稀有阿拉伯糖[3]。 鉴于阿拉伯糖应用的广泛性, 人们也注重了对阿拉伯糖的制备、 提取以及分析[7, 8]等方面的研究, 但其在植物体内的合成机制, 尚有诸多问题有待于进一步研究和探讨。 研究L-阿拉伯糖在指纹区(1 200 cm-1以下)的特征振动, 对判断其在生物体内合成机制是至关重要的。 故本文旨在研究L-阿拉伯糖分子内基团的振动特别是在指纹区的振动, 并对这些振动进行确切的指认和归属。 太赫兹射线技术的发展进步, 为糖类研究提供了新的技术手段, 开辟了更为细致的研究领域。 目前, 该技术已经用于对许多物质[9, 10]的检测, 但有效检测频域较窄(5~90 cm-1), 且对其基团的振动, 不易归属; 物质红外图谱提供信息较为丰富, 但较为复杂, 特别是指纹区的振动无法辨认, 解析困难, 无法提供有价值的信息, 而拉曼图谱却较为简单。 本文拟用太赫兹和拉曼技术相结合的方法和手段, 对生物体内存在的L-阿拉伯糖的振动进行研究, 并根据势能分布(potential energy distribution, PED), 对其振动特别是指纹区的振动进行归属和指认, 同时也将其检测值与理论值进行比较, 以便为进一步了解阿拉伯糖在生物体内生物化学反应提供基本数据, 为其进一步的应用打下基础。
本实验装置采用太赫兹图谱测定装置与文献[11]报道一致, 主要设备包括THz(Terahertz)探测器、 飞秒激光器和THz发射器等。 本装置使用Spectra-Physics公司生产的锁模钛宝石脉冲激光器, 平均输出功率为0.87 W, 输出中心波长为800 nm, 脉冲宽度小于100 fs。
将阿拉伯糖样品(Feinbochenica Gmbh & Co.)在6 MPa条件下压制成直径为13.0 mm、 厚度为0.883 mm的薄片, 样品和聚乙烯的比例为1:1, 在N2的保护下, 温度为19.8 ℃, 湿度为29.5 RHM, 激光功率0.87 W, 检测频率范围为5~87 cm-1。 拉曼图谱检测使用拉曼光谱仪(JY-HR-800), 激发波长532 nm, 检测范围50~4 000 cm-1之间。
采用Gaussian 09[12]软件包, 根据密度泛函理论B3LYP/6-311G* * 基组对吡喃L-阿拉伯糖的α 型、 β 型和链式结构
(open-chain isomer, l型)三种典型的构型, 分别进行优化, 结果没有出现虚频, 并得到其相应稳定结构。 图1为三种典型异构体各原子标号顺序示意图。 图1中(a)为L-阿拉伯糖α 型与β 型两种结构的标号顺序, 图1(b)为阿拉伯糖链状结构标号顺序示意图。 该物质三种典型异构体各原子之间的参数包括键长、 键角、 二面角、 偶极矩和能量等列于表1。 根据优化结果, 得到其太赫兹吸收图谱和拉曼图谱。 对L-阿拉伯糖三种异构体图谱计算, 模拟所得的振动既是其红外活性, 也是其拉曼活性。 三种典型不同异构体各原子或/和基团的振动列于表2, 振动模采用Pulay等的定义[13], 对其振动进行归属。
 | 图1 优化后 L-阿拉伯糖各原子的编号(a): L-α -型和L-β -型结构; (b): L-l-链状结构Fig.1 Atom numbers of the optimized structures of L-arabinose(a): L-α -isomer and L-β -isomer; (b): L-l-isomer |
| 表1 L-阿拉伯糖三种异构体各原子之间的参数 Table 1 The parameters between atoms of three types of arabinose |
| 表2 L-阿拉伯糖三种异构体振动的归属 Table 2 Assignments of vibrations of L-arabinose isomers |
图1(a)是阿拉伯糖的吡喃型结构, 包括α 型和β 型结构, 两结构原子标号一样。 图1(b)L-阿拉伯糖的链状结构, 结构中含有一个亚甲基, 其振动的频率和强度与其他基团相比, 都有独特之处。 表1显示了三种结构异构体各个原子之间的参数, 包括键长、 键角、 二面角等数值。 从三者的能量数值来看, β -吡喃型的阿拉伯糖能量最低, 故在样品体系中的含量较高, 而链状结构能量最高, 在样品体系中的含量最低。 从三者优化的结构来看, 碳链上每一碳原子上各原子或基团与相邻碳原子上的原子或基团之间, 尽可能形成交叉式结构, 使其能量达到最低, 结构最为稳定。
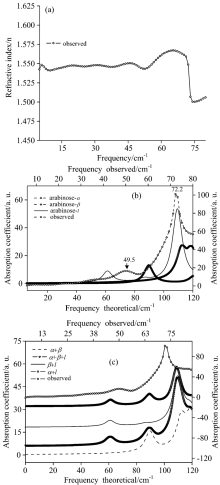
将样品和参考信号的时域图谱进行快速傅里叶变换, 可以得到其折射率和吸收系数图谱, 太赫兹图谱包括折射率图谱和吸收系数图谱, 分别列于图2(时域图谱、 频域图谱和透射图谱本文没有给出)。 为了更好地探讨L-阿拉伯糖在太赫兹频域内的振动, 将其三种异构体在5~85 cm-1内振动曲线的理论值也列于图2。
图2(a)是L-阿拉伯糖的折射率图谱, 从图上可以看出, 样品折射率的数值大约在1.5~1.6之间, 并在大约50和72 cm-1频率处分别有一个反常色散, 故在相应频率处各有一个明显的振动。 图2(b)显示, 样品在5~80 cm-1有两个明显的振动吸收, 其频率分别为49.5和72.2 cm-1, 与折射率图谱中两个反常色散处的频率基本是吻合的。 其中, 在49.5 cm-1振动峰与葛敏等报道的一致[10], 但72.2 cm-1的振动吸收当时尚未检测出来, 其原因有待于进一步研究, 且两者的吸收峰系数差异较大, 前者的吸收系数大约20左右, 而后者较大, 达到了100左右, 约为前者的5倍。 图2(b)也显示: L-阿拉伯糖三种典型的构象异构体在太赫兹频域内的振动吸收, 各具特点。 从计算结果来看, α 型异构体在89.0 cm-1处有一个明显的振动吸收, 该振动频率在本实验检测范围之外; β 型异构体的最低振动频率为112.2 cm-1, 该振动频率也在检测范围之外; 相反, 链状异构体在61.2和86.5 cm-1处有两个振动吸收, 相比而言, 前者的吸收系数约为后者的4倍, 在109.3 cm-1处有一个较强吸收, 且其吸收强度分别为61.2和86.5 cm-1两振动频率吸收的7倍和15倍。 图2(b)还显示, 三种异构体振动理论曲线与实际检测曲线都有明显的不同, 很有可能是样品由多种异构体不同振动吸收叠加所致。 图2(c)是不同构型异构体组合后的太赫兹吸收系数曲线图(假定组合时各组分含量均等, 且忽略倍频)。 从该图可以看出, α -、 β -与链状型异构体三组分和α -与l-型异构体两组分的简单之和的图谱非常相似。 因此, 可以认为L-阿拉伯糖样品中含有α -, β -与l-型异构体三组分, 其各组分的含量有待于进一步研究和探讨。 图2(c)还显示, 在太赫兹频域内, 吸收频率理论值在实际检测中向低频移动, 故可以检测值中在49.5和72.2 cm-1的振动吸收, 分别是l-型异构体61.2 cm-1和α -异构体89.0 cm-1的振动吸收。 三种不同异构体在太赫兹频域内的振动归属, 列于表2。
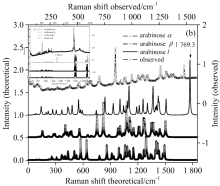
图3是L-阿拉伯糖拉曼图谱在检测范围为50~3 500 cm-1曲线。 图3(a)是检测值与α -, β -与链状三种异构体在位移50~4 000 cm-1范围内拉曼振动的理论值曲线。 该图显示, 在3 000和3 800 cm-1附近, 分别L-阿拉伯糖C— H和O— H的伸缩振动, 其振动较为单一, 容易归属。 该图还显示, 样品检测值与理论值相比, 这些振动在一定程度上发生了红移, 即振动频率降低。 与红外图谱相比, L-阿拉伯糖在指纹区的拉曼振动, 简洁明晰, 根据其势能分布, 对该频域内的振动进行归属和指认, 同时也为了研究的方便, 将阿拉伯糖低于1 800 cm-1的拉曼振动的归属, 列于表2。 图3(b)为阿拉伯糖在拉曼位移50~1 800 cm-1范围内的振动曲线。 图3(b)表明, 理论值和检测值之间有一定的差异。 在l-型异构体曲线上, 在1 769 cm-1的振动为L-阿拉伯糖醛基C=O的伸缩振动, 且强度较大, 显示出链状结构的独特性。
表2是L-阿拉伯糖三种典型构象异构体拉曼振动的归属。 从表2可以看出, 对于三种结构中能量最低的β -型异构体, 在1 200 cm-1以下的区域, 可以将拉曼振动分为以下几个区域。 在1 200~820 cm-1位移区域内, 主要是L-阿拉伯糖吡喃型环状结构上的C— C, C— O和C— H等的伸缩振动。 在拉曼位移820~460 cm-1区域内的振动, 可以将其归属为环上亚甲基上的摇摆振动, 相应地在460~250 cm-1以下, 由环上羟基H— O的扭曲振动, 逐渐过渡到环上亚甲基碳原子基团扭曲振动, 再到亚甲基碳原子上基团的扭曲振动, 且六元环的对称变形和不对称变形也发生在这个区域。 在位移250 cm-1以下, 主要归属为环上骨架对称扭曲和不对称扭曲振动、 对称畸变和不对称畸变以及分子内六元环骨架的puckering振动等。
从L-阿拉伯糖样品的太赫兹图谱可以看出, 太赫兹吸收图谱中振动吸收与折射率图谱中反常色散的频率基本一致, 故这两个振动吸收是得到确认, 其归属列于表2。 拉曼图谱也显示, 在指纹区的拉曼振动提供的信息是非常丰富的, 总的来说可以分为四个区域, 振动的具体归属, 参看表2。 拉曼图谱和太赫兹图谱都表明, 检测值与理论值相比, 振动频率和强度都有一些差异。 产生这种现象的原因一般有几个: 首先是聚集状态, 检测的样品是有许多单个晶体分子或基团协同作用和相互影响的, 基团振动受到分子间与分子内的氢键、 范德华力等以及差向异构体(包括呋喃型L-阿拉伯糖本文忽略)之间的相互影响, 而理论值的计算只是气态状况下一个单个分子, 且不考虑分子之间的相互作用; 其次是温度, 检测值是在室温条件下进行的, 而理论值是在298.15 K下进行模拟的; 再次, 样品中不同构型异构体分子和各基团之间的组频、 倍频等对图谱的影响, 也没有考虑进去。 鉴于太赫兹频域内, 检测值的振动与三种不同异构体理论值吸收曲线的简单相加基本一致, 因此可以认为, 所检测的L-阿拉伯糖至少是由α -型、 β -型和l-型结构三种异构体共同组成的, 至于其各组分在样品中的含量以及样品是否含有呋喃型糖等问题有待于进一步研究。 L-阿拉伯糖在生物体内进行生化反应究竟是链状结构还是环状结构(包括吡喃型和呋喃型)参与了半纤维素、 几丁质等合成, 以及合成过程的机制等都需要进一步的实验研究和证实。 本研究中, 在太赫兹频域内, 发现了49.5和72.2 cm-1振动吸收, 这与文献[11]报道只检测出一个振动, 其原因有待于进一步的探讨; 但这两个振动, 吸收强度较大, 故可以做L-阿拉伯糖特征振动吸收峰。
采用太赫兹光谱系统, 对L-阿拉伯糖在5~85 cm-1频域内的振动吸收进行了检测。 结果发现, 在该频域内有两个明显的振动吸收, 与折射率图谱的反常色散基本吻合, 且强度较大, 故可以作为L-阿拉伯糖的特征吸收。 根据密度泛函理论, 在B3LYP/6-311G* * 水平, 对样品在该频域内的振动吸收进行计算, 并与检测值对比, 结果显示检测曲线与L-阿拉伯糖的α -型异构体、 β -型异构体和l-型异构体三者曲线之和基本一致, 因此, 有理由认为检测样品为三者异构体的混合物, 但各组分含量有待于进行研究。 尽管链状结构在样品含量较少, 但还是可以用太赫兹射线将其检测出来, 显示了太赫兹射线技术的独特性。 采用激光拉曼光谱仪对样品在50~4 000 cm-1范围进行了测定, 并用势能分布对其振动进行归属和指认, 结果显示, 在指纹区提供基团振动信息明晰而丰富, 可以将拉曼振动分为四个区域, 从高频到低频一般可以归属为碳链上亚甲基上基团的摇摆振动、 环上羟基H— O的扭曲振动、 环上亚甲基碳原子基团扭曲振动组合振动、 亚甲基原子碳上基团的扭曲振动以及六元环的对称变形和不对称变形也在这个区域。 250 cm-1以下, 主要归属为环上骨架对称扭曲和不对称扭曲振动、 对称畸变和不对称畸变以及分子内六元环骨架的puckering振动。 采用太赫兹光谱、 拉曼光谱与密度泛函相结合, 检测并找到L-阿拉伯糖特征吸收, 特别是太赫兹频域内集体振动模的振动, 为研究阿拉伯糖在生物体内代谢的合成机制提供了一条有效的方法和途径。
致谢: 本数据的处理得到了厦门大学化学系吴德印教授、 苏亚琼博士、 大连理工大学化学系石磊博士的帮助, 在此表示衷心的感谢!
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|